Kemisk induceret Hudcarcinogenese model ved brug af Dimethylbenz [a] anthracen og 12-O-Tetradecanoyl Phorbols-13-acetat (DMBA-TPA)
Summary
To-trins hudcarcinogenese induceres af to topisk anvendte kemikalier. En mutagen 7, 12-dimethylbenz [a] anthracen) forårsager mutationer i Epidermal celler og en kontinuerlig anvendelse af generelle vækst stimulator 12-O-tetradecanoyl phorbols-13-acetat accelererer huden papilloma dannelse.
Abstract
Kræft er en af de mest ødelæggende sygdomme hos mennesker. Eksperimentelle kræft modeller er vigtige for at få indsigt i det komplekse samspil mellem forskellige celletyper og gener i at fremme tumorprogression og til at give en platform til afprøvning af effekten af forskellige terapeutiske tilgange. En af de mest almindeligt anvendte eksperimentelle inflammatoriske kræft modeller er DMBA-TPA to-trins hud carcinogenese model. Tumor dannelse induceres i denne model af den topikale anvendelse af to forskellige kemikalier, 7, 12-dimethylbenz [a] anthracen (DMBA) og 12-O-tetradecanoyl phorbols-13-acetat (TPA), der tilsammen forårsager papilloma dannelse i huden. Som det primære resultat er papilloma dannelse i huden, modellen er en ideel, pålidelig, og reproducerbare måde at løse både tumor initiering (tumor-fri overlevelse) og tumorprogression (antal og størrelse af synlige tumorer). Virkningerne af DMBA-TPA behandling overføres via en inflammatorisk mekanisme, hvilket gør denne model specielt egnet til at studere rollen af immunsystemet i tumordannelse. Denne model er dog begrænset til huden og andre overflader, hvor kemikalierne kan påføres. Der findes en detaljeret protokol i denne artikel, hvor modellen kan bruges korrekt.
Introduction
Kræft er en af de førende dødsårsager i verden. Derfor er der et krav om at udvikle pålidelige eksperimentelle sygdomsmodeller for at opnå en bedre forståelse af sygdommen samt for at udforske potentielle terapeutiske tilgange. En af de mest almindeligt anvendte eksperimentelle in vivo modeller til at studere hudkræft udvikling er den kemisk induceret to-trins hud carcinogenese model1,2. Modellen giver et værktøj til at studere tumor initiering, forfremmelse, og progression i tillæg til specifikke begivenheder såsom immuncelle infiltration og angiogenese.
At bruge to-trins hud carcinogenese model, bagsiden hud af mus er behandlet med to forskellige kemikalier, der tilsammen fremkalde tumordannelse. Modellen initieres med en lav dosis af mutagen, DMBA, efterfulgt af længerevarende udsættelse for tumor promotoren, TPA3 (figur 1). Dmba muserer DNA tilfældigt ved at danne kovalente addukter med DNA fra Epidermal celler og primære keratinocyt stamceller4,5,6,7. Nogle af disse tilfældige mutationer finder sted i en proto-oncogene, såsom Hras1 (mutationer i Kras og NTM opdages også) og omdannelsen af proto-onkogener til onkogener driver tumordannelse under ordentlige stimuli. TPA, igen, er den mest almindeligt anvendte tumorvækst fremmende middel. Dens molekylære mål er proteinkinase C (PKC)8. TPA aktiverer også WNT/β-køreledningen i signalering, der er afgørende for tumordannelse i model9. Gentagen og langvarig udsættelse for fremme agent fører til øget celle signalering, øget produktion af vækstfaktorer, og en lokal inflammatorisk reaktion, som er indlysende på grund af øget DNA-syntese og inflammatorisk celleinfiltration i den behandlede hud.
De vigtigste inflammatoriske mediatorer i DMBA-TPA-modellen er blevet identificeret10. Interleukin-17a (Il-17a) er kendt for at være særligt tumorigent i dmba-TPA-modellen11,12. Det virker i synergi med interleukin 6 (Il-6) og deltager i makrofag og neutrofilrekruttering13,14. Desuden har CD4+ T- celler og neutrofiler vist sig at være tumorigent i dmba-TPA-modellen. Endelig kan makrofager også fremme tumor i model15,16,17.
Under forfremmelses fasen forstærkes celle spredningen af de muterede celler, og et vedvarende hyperplasi af epidermis vedligeholdes1. Dette fører til papilloma udvikling i huden i 10 – 20 uger, hvorefter papillomer begynder at konvertere til maligne tumorer, plade celle karcinomer (SCCS)2. Men mindre end 10% af papillomer fremskridt til malignitet, selv om denne procentdel også afhænger af den genetiske baggrund af musene2,18. I årtier var det ikke kendt, hvilken type celler blev oprindeligt muteret i tumorer fører til malignitet, selv om nogle undersøgelser havde rapporteret klart forskellige funktioner i de Maligne tumorer i forhold til benign papillomer19,20. Men, nylige undersøgelser har i høj grad øget vores forståelse på den klonale oprindelse af tumordannelse i DMBA-TPA model21. 22. 23. det blev påvist, at både knoglemarv-afledte epiteliale celler og hårsæk stamceller bidrager til tumordannelse22. Stage-specifikke Lineage Tracing undersøgelser har afsløret, at godartede papillomer af monoklonale oprindelse, men de rekruttere nye epiteliale cellepopulationer21,23. Men kun en af celle klonerne fungerer som en drivkraft for carcinogenese; den indeholder en HRAS-mutation23. Progression til karcinom dannelse er forbundet med en klonal feje23.
Det kræftfremkaldende DMBA initierer papilloma dannelse og TPA fremmer tumorvækst. Derfor kan tumor initiering undersøgt separat fra kampagnen ved at afbryde eksperimentet før TPA-behandlingsperioden. Som tumorprogression er undersøgt ugentligt det giver en stor mulighed for detaljeret tumorvækst analyse i hele studiet. Fordi tumorer er genereret af eksterne kemikalier, en onkogen mutation i kimcelle er unødvendig. Således er det ligetil at studere virkningerne af en genetisk baggrund (f. eks. knockout/transgene vs. vildtype) på tumor2. I sum, DMBA/TPA Skin Cancer model er en særlig nyttig tilgang til at studere rollen af immunsystemet i tumorprogression samt til evaluering af tumor initiering og forfremmelse skridt selvstændigt eller indbyrdes afhængige.
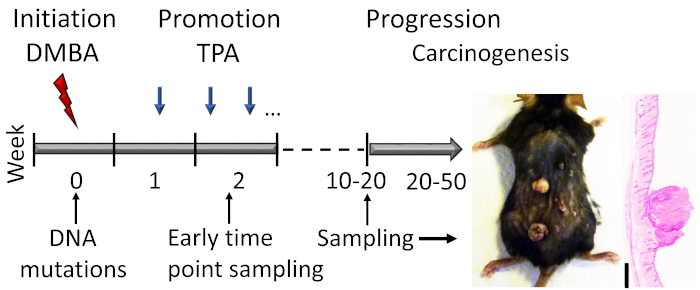
Figur 1: DMBA-TPA-induceret hud carcinogenese model skitse. Det kræftfremkaldende dmba påføres topisk for at inducere DNA-mutationer i Initierings fasen af modellen. Den vækstfremmende agent TPA administreres 2x om ugen for at øge celle spredningen under forfremmelses fasen, hvilket fører til udviklingen af papillomer i huden. Dyr ofres, efter at papillomas respons når et plateau, sædvanligvis inden for uger 15-20, afhængigt af muternes genetiske baggrund. En lille del af papillomer kan videreudvikle sig til VKF inden for 20 – 50 uger. For at studere tidlige hændelser i Initierings fasen og den tidlige forfremmelses fase kan der indsamles prøver (f. eks. kort tid efter den anden TPA-applikation). Et repræsentativt fotografi og hematoxylinlegemer og eosin farvede tværsnit af papillomer på en C57BL/6 mus hud efter 19 ugers behandling er vist. Scale bar = 0,1 mm. Klik her for at se en større version af dette tal.
Protocol
Representative Results
Discussion
DMBA-TPA-induceret hudkræft er en af de mest almindeligt anvendte kræft modeller, fordi det er meget reproducerbare og giver oplysninger om tumorprogression fra initiering til malignitet. Den vigtigste resultatmåling, papilloma dannelse, er let og pålideligt kvantitativ. Modellen henvender sig både tumor initiering (tumor-fri overlevelse) og progression (tumor tal og størrelser) samtidig. Modellen er velegnet til at studere forskellige forbindelser, såsom potentiel terapeutisk, og virkningerne af individuelle gene…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dette arbejde blev finansieret af det finske Akademi (tilskud 25013080481 og 25013142041 (I.J.), 286377 og 295814 (M.P.), 287907 (T.J.)), Päivikki og Sakari Sohlberg Foundation (M.P., T.J.), Finnish Medical Foundation (T.P.), den konkurrencedygtige statslige forskning Finansiering af området for ekspert ansvar på Tampere Universitets Hospital (Grant 9V049 og 9X044 (M.P.), 9X011 og 9V010 (T.J.)), den konkurrencedygtige stats forskningsfinansiering af Fimlab Laboratories-laboratoriets ekspert ansvarsområde (Grant X51409 (I.J.)), Tays Støttefond (I.J., M.P., T.J.), Tampere tuberkulose Foundation (I.J., M.P., T.J.), den finske Kulturfond (M.V.), Paulo Foundation (T.P.), Cancer Society of Finland (M.P.) og Emil Aaltonen Foundation (T.P.).
Materials
| 1000 ul RPT XL Graduated Filter Tip (Sterile), Refill | Starlab | S1182-1730-C | |
| 300 ul RTP Graduated Filter Tip (sterile), Refill | Starlab | S1180-9710-C | |
| 7,12-Dimethylbenz[a]anthracene (DMBA) | Sigma | D3254-100MG | Harmful if swallowed and may cause cancer. Store protected from light. |
| Acetone | Sigma | 1000141011 | Evaporates rapidly and is inflammable. |
| Attane vet 1000 mg/g | Piramal Critical Care Limited | Liquid isoflurane for inhalation | |
| Battery-Operated Clipper Isis | Albert Kerlb GmbH | GT421 | For shaving the fur |
| CONTRAfluran-Restgasfilter | ZeoSys GmbH | For anesthesia | |
| Linex Nature N1030 Ruler 30 cm | Staples Business Advantage | 60383 | For measuring papillomas |
| Medium CO2 Chamber 300 x 200 x 200mm – Red | VetTech Solutions Ltd | AN045AR | For sacrifice |
| Mekasoft | Mekalasi | 23008 | Table cover |
| Mice (Balb/c JRj) | Janvier labs | Other strains also possible | |
| Mice (C57BL/6JRj) | Janvier labs | Other strains also possible | |
| Panasonic Lumix DMC-FS5 Digital Camera | Panasonic | ||
| Paraformaldehyde | Merck | 30525-89-4 | For histology samples |
| Phorbol 12-myristate 13-acetate aka 12-Otetradecanoylphorbol-13-acetate (TPA) | Enzo | BML-PE160-0001 | |
| Precision balance PLJ-C/PLJ-G | KERN & SOHN GmbH | PLJ 600-3CM | |
| Pre-Set CO2 System-2 Chamber-S/S Housing | VetTech Solutions Ltd | AN044BX | For sacrifice |
| RNAlater | Qiagen | 76104 | For nucleic acid samples |
| Tacta pipette 100-1000 ul | Sartorius | LH-729070 | |
| Tacta pipette 20-200 ul | Sartorius | LH-729060 | |
| UNO Anaesthetic Key Filler | Scintica instrumentation inc. | For anesthesia | |
| UNO Face Mask for Mouse | Scintica instrumentation inc. | For anesthesia | |
| UNO FM2200 Flowmeter | Scintica instrumentation inc. | For anesthesia | |
| UNO Gas Exhaust Unit | Scintica instrumentation inc. | For anesthesia | |
| UNO Induction Box | Scintica instrumentation inc. | For anesthesia | |
| UNO200VAP Vaporizer | Scintica instrumentation inc. | For anesthesia |
References
- DiGiovanni, J. Multistage carcinogenesis in mouse skin. Pharmacology & Therapeutics. 54 (1), 63-128 (1992).
- Abel, E. L., Angel, J. M., Kiguchi, K., DiGiovanni, J. Multi-stage chemical carcinogenesis in mouse skin: fundamentals and applications. Nature Protocols. 4 (9), 1350-1362 (2009).
- Perez-Losada, J., Balmain, A. Stem-cell hierarchy in skin cancer. Nature Reviews. Cancer. 3 (6), 434-443 (2003).
- Bonham, K., et al. Activation of the cellular Harvey ras gene in mouse skin tumors initiated with urethane. Molecular Carcinogenesis. 2 (1), 34-39 (1989).
- Quintanilla, M., Brown, K., Ramsden, M., Balmain, A. Carcinogen-specific mutation and amplification of Ha-ras during mouse skin carcinogenesis. Nature. 322 (6074), 78-80 (1986).
- Nelson, M. A., Futscher, B. W., Kinsella, T., Wymer, J., Bowden, G. T. Detection of mutant Ha-ras genes in chemically initiated mouse skin epidermis before the development of benign tumors. Proceedings of the National Academy of Sciences of the United States of America. 89 (14), 6398-6402 (1992).
- Morris, R. J. A perspective on keratinocyte stem cells as targets for skin carcinogenesis. Differentiation. 72 (8), 381-386 (2004).
- Chung, Y. W., Kim, H. K., Kim, I. Y., Yim, M. B., Chock, P. B. Dual function of protein kinase C (PKC) in 12-O-tetradecanoylphorbol-13-acetate (TPA)-inducec manganese superoxide dismutase (MnSOD) expression: activation of CREB and FOXO3a by PKC-alpha phosphorylation and by PKC-mediated inactivation of Akt, respectively. The Journal of Biological Chemistry. 286 (34), 29681-29690 (2011).
- Su, Z., et al. Tumor promoter TPA activates Wnt/β-catenin signaling in a casein kinase 1-dependent manner. Proceedings of the National Academy of Sciences of the United States of America. 115 (32), 7522-7531 (2018).
- Swann, J. B., et al. Demonstration of inflammation-induced cancer and cancer immunoediting during primary tumorigenesis. Proceedings of the National Academy of Sciences of the United States of America. 105 (2), 652-656 (2008).
- Wang, L., Yi, T., Zhang, W., Pardoll, D. M., Yu, H. IL-17 enhances tumor development in carcinogen-induced skin cancer. Cancer Research. 70 (24), 10112-10120 (2010).
- He, D., et al. IL-17 mediated inflammation promotes tumor growth and progression in the skin. PLoS One. 7 (2), 32126 (2012).
- Roussel, L., et al. IL-17 promotes p38 MAPDK-dependent endothelial activation enhancing neutrophil recruitment to sites of inflammation. Journal of Immunology. 184 (8), 4531-4537 (2010).
- Wanqiu, H., Young-Hee, J., Hyun, S. K., Byung, S. K. Interleukin-6 (IL-6) and IL-17 synergistically promote viral persistence by inhibition cellular apoptosis and cytotoxic T cell function. Journal of Virology. 88 (15), 8479-8489 (2014).
- Yusuf, N., et al. Antagonistic roles of CD4+ and CD8+ T-cells in 7,12-dimethylbenz(a)anthracene cutaneous carcinogenesis. Cancer Research. 68 (10), 3924-3930 (2008).
- Gong, L., et al. Promoting effect of neutrophils on lung tumorigenesis is mediated by CXCR2 and neutrophil elastase. Molecular Cancer. 12 (1), 154 (2013).
- Vestweber, D., Wessel, F., Nottebaum, A. F. Similarities and differences in the regulation of leukocyte extravasation and vascular permeability. Seminars in Immunopathology. 36 (2), 177-192 (2014).
- Woodworth, C. D., et al. Strain-dependent differences in malignant conversion of mouse skin tumors is an inherent property of the epidermal keratinocyte. Carcinogenesis. 25 (9), 1771-1778 (2004).
- Tennenbaum, T., et al. The suprabasal expression of alpha 6 beta 4 integrin is associated with a high risk for malignant progression in mouse skin carcinogenesis. Cancer Research. 53 (20), 4803-4810 (1993).
- Hennings, H., Shores, R., Mitchell, P., Spangler, E. F., Yuspa, S. H. Induction of papillomas with a high probability of conversion to malignancy. Carcinogenesis. 6 (11), 1607-1610 (1985).
- Auto, Y., et al. Time-Series Analysis of Tumorigenesis in a Murine Skin Carcinogenesis Model. Scientific Reports. 8 (1), 12994 (2018).
- Park, H., et al. Bone marrow-derived epithelial cells and hair follicle stem cells contribute to development of chronic cutaneous neoplasms. Nature Communications. 9 (1), 5293 (2018).
- Reeves, M. Q., Kandyba, E., Harris, S., Del Rosario, R., Balmain, A. Multicolour lineage tracing reveals clonal dynamics of squamous carcinoma evolution from initiation to metastasis. Nature Cell Biology. 20 (6), 699-709 (2018).
- Dao, V., et al. Prevention of carcinogen and inflammation-induced dermal cancer by oral rapamycin includes reducing genetic damage. Cancer Prevention Research. 5, 400-409 (2015).
- Yeong, L. T., Abdul Hamid, R., Saiful Yazan, L., Khaza’ai, H., Mohtarrudin, N. Low dose triterpene-quinone fraction from Ardisia crispa root precludes chemical-induced mouse skin tumor promotion. BMC Complementary and Alternative Medicine. 15 (1), 431 (2015).
- Kong, Y. H., Xu, S. P. Salidroside prevents skin carcinogenesis induced by DMBA/TPA in a mouse model through suppression of inflammation and promotion of apoptosis. Oncology Reports. 39 (6), 2513-2526 (2018).
- Jung, M., Bu, S. Y., Tak, K. H., Park, J. E., Kim, E. Anticarcinogenic effect of quercetin by inhibition of insulin-like growth factor (IGF)-1 signaling in mouse skin cancer. Nutrition Research and Practice. 7 (6), 439-445 (2013).
- Hu, Y. Q., Wang, J., Wu, J. H. Administration of resveratrol enhances cell-cycle arrest followed by apoptosis in DMBA-induced skin carcinogenesis in male Wistar rats. European review for medical and pharmacological sciences. 13, 2935-2946 (2016).
- Schweizer, J., Loehrke, H., Hesse, B., Goerttler, K. 7,12-Dimethylbenz[a]anthracene/12-O-tetradecanoyl-phorbol-13-acetate-mediated skin tumor initiation and promotion in male Sprague-Dawley rats. Carcinogenesis. 3 (7), 785-789 (1982).
- Vähätupa, M., et al. T-cell-expressed proprotein convertase FURIN inhibits DMBA/TPA-induced skin cancer development. Oncoimmunology. 5 (12), 1245266 (2016).
- May, U., et al. Resistance of R-Ras knockout mice to skin tumour induction. Scientific Reports. 5, 11663 (2015).
- Krajewska, M., et al. Image analysis algorithms for immunohistochemical assessment of cell death events and fibrosis in tissue sections. The Journal of Histochemistry and Cytochemistry. 57 (7), 649-663 (2009).
- Järvinen, T. A., Ruoslahti, E. Target-seeking antifibrotic compound enhances wound healing and suppresses scar formation in mice. Proceedings of the National Academy of Sciences of the United States of America. 107 (50), 21671-21676 (2010).
- Schwarz, M., Münzel, P. A., Braeuning, A. Non-melanoma skin cancer in mouse and man. Archives of Toxicology. 87 (5), 783-798 (2013).
- Slaga, T. J. SENCAR mouse skin tumorigenesis model versus other strains and stocks of mice. Environmental Health Perspectives. 68, 27-32 (1986).
- Goerttler, K., Loehrke, H., Schweizer, J., Hesse, B. Systemic two-stage carcinogenesis in the epithelium of the forestomach of mice using 7,12-dimethylbenz(a)anthracene as initiator and the phorbol ester 12-O-tetradecanoylphorbol-13-acetate as promoter. Cancer Research. 39 (4), 1293-1297 (1979).
- Topping, D. C., Nettesheim, P. Promotion-like enhancement of tracheal carcinogenesis in rats by 12-O-tetradecanoylphorbol-13-acetate. Cancer Research. 40, 4352-4355 (1980).
- Wille, J. J. Circadian rhythm of tumor promotion in the two-stage model of mouse tumorigenesis. Cancer Letters. 190 (2), 143-149 (2003).
- Lee, Y. S., et al. Inhibition of skin carcinogenesis by suppression of NF-κB dependent ITGAV and TIMP-1 expression in IL32γ overexpressed condition. Journal of Experimental & Clinical Cancer Research. 37 (1), 293 (2018).
- Kiss, A., et al. Cell type-specific p38δ targeting reveals a context-, stage-, and sex-dependent regulation of skin carcinogenesis. International Journal of Molecular Sciences. 20 (7), 1532 (2019).
- Tomo-o, I., et al. Positron emission tomography imaging of DMBA/TPA mouse skin multi-step tumorigenesis. Molecular Oncology. 4 (2), 119-125 (2010).
- Mantovani, A., Allavena, P., Sica, A., Balkwill, F. Cancer-related inflammation. Nature. 454 (7203), 436-444 (2008).
- Crusz, S. M., Balkwill, F. R. Inflammation and cancer: advances and new agents. Nature Reviews. Clinical Oncology. 12 (10), 584-596 (2015).
- Hennings, L., et al. Malignant conversion and metastasis of mouse skin tumors: a comparison of SENCAR and CD-1 mice. Environmental Health Perspectives. 68, 69-74 (1986).
- Gómez-Cuadrado, L., Tracey, N., Ma, R., Qian, B., Brunton, V. G. Mouse models of metastasis: progress and prospects. Disease Models & Mechanisms. 10 (9), 1061-1074 (2017).
- Ouhtit, A., Ananthaswamy, H. N. A model for UV-induction of skin cancer. Journal of Biomedicine and Biotechnology. 1 (1), 5-6 (2001).
- Day, C. -. P., Marchalik, R., Merlino, G., Michael, H. T. Mouse models of UV-induced melanoma: genetics, pathology, and clinical relevance. Laboratory Investigation. 97 (6), 698-705 (2017).

