Dimethylbenz[a]Anthracene ve 12-O-Tetradecanoyl Phorbol-13-Asetat (DMBA-TPA) Kullanarak Kimyasal Kaynaklı Cilt Karsinogenez Modeli
Summary
İki aşamalı deri karsinogenezi topikal olarak uygulanan iki kimyasal tarafından indüklenir. Bir mutajen 7,12-dimethylbenz[a]anthracene) epidermal hücrelerde mutasyonlara neden olur ve genel büyüme uyarıcı sürekli bir uygulama 12-O-tetradecanoyl phorbol-13-asetat cilt papilloma oluşumunu hızlandırır.
Abstract
Kanser en yıkıcı insan hastalıklarından biridir. Deneysel kanser modelleri tümör ilerlemesini teşvik farklı hücre tipleri ve genlerin karmaşık etkileşim ilerler ve farklı terapötik yaklaşımların etkinliğini test etmek için bir platform sağlamak için önemlidir. En sık kullanılan deneysel inflamatuar kanser modellerinden biri DMBA-TPA iki aşamalı cilt karsinogenez modelidir. Tümör oluşumu bu modelde iki farklı kimyasalın topikal uygulaması ile indüklenir, 7,12-dimethylbenz[a]antracen (DMBA) ve 12-O-tetradecanoyl phorbol-13-asetat (TPA), birlikte deride papilloma oluşumuna neden. Birincil sonuç deride papilloma oluşumu olduğu gibi, model hem tümör inisiyasyonu (tümörsüz sağkalım) ve tümör ilerlemesi (görünür tümörlerin sayısı ve boyutu) ele almak için ideal, güvenilir ve tekrarlanabilir bir yoldur. DMBA-TPA tedavisinin etkileri inflamatuar bir mekanizma ile iletilir, bu da bu modeli özellikle tümör oluşumunda bağışıklık sisteminin rolünü incelemek için uygun hale getirir. Ancak, bu model cilt ve kimyasallar üzerinde uygulanabilir diğer yüzeyler ile sınırlıdır. Modeli başarıyla kullanmak için bu makalede ayrıntılı bir protokol sağlanmıştır.
Introduction
Kanser dünyada önde gelen ölüm nedenlerinden biridir. Bu nedenle, hastalığın daha iyi anlaşılması ve potansiyel tedavi yaklaşımlarının araştırılması için güvenilir deneysel hastalık modelleri geliştirilmesi talebi vardır. Cilt kanseri gelişimini incelemek için en sık kullanılan deneysel in vivo modellerinden biri kimyasal olarak indüklenen iki aşamalı cilt karsinogenez modeli1,2. Model, bağışıklık hücresi infiltrasyonu ve anjiyogenez gibi belirli olaylara ek olarak tümör inisiyasyonu, promosyon ve ilerleme yi incelemek için bir araç sağlar.
İki aşamalı deri karsinogenez modelini kullanmak için, farelerin arka deri birlikte tümör oluşumunu neden iki farklı kimyasallar ile tedavi edilir. Model düşük dozda mutajen ile başlanır, DMBA, tümör organizatörü uzun süreli maruz kalma takip, TPA3 (Şekil 1). DMBA epidermal hücrelerin DNA’sı ve primer keratinosit kök hücrelerininDNA’sıile kovalent adducts oluşturarak DNA’yı rastgele mutasyona uğratır 4,5,6,7. Bu rasgele mutasyonların bazıları Hras1 (Kras ve Nras mutasyonları da tespit edilir) gibi bir proto-onkogen yer alır ve onkogenler için proto-onkogenlerin dönüşüm uygun uyaranlar altında tümör oluşumunu sürücüler. TPA, sırayla, en sık kullanılan tümör büyüme teşvik ajandır. Moleküler hedefi protein kiaz C (PKC)8’dir. TPA ayrıca model9’datümör oluşumu için çok önemli olan Wnt/β-catenin sinyalini aktive eder. Teşvik edici ajan tekrarlanan ve uzun süreli maruz kalma gelişmiş hücre sinyalizasyonu yol açar, büyüme faktörlerinin artan üretim, ve lokal bir inflamatuar reaksiyon, hangi artan DNA sentezi ve tedavi deride inflamatuar hücre infiltrasyonu nedeniyle belirgindir.
DMBA-TPA modelinde anahtar inflamatuar mediatörler tespit edilmiştir10. Interlökin-17A (IL-17A) DMBA-TPA modelinde özellikle tümörijenik olduğu bilinmektedir11,12. Bu interlökin 6 (IL-6) ile sinerji çalışır ve makrofaj ve nötrofil işe katılır13,14. Ayrıca DMBA-TPA modelinde CD4+ T hücreleri ve nötrofillerin tümörijenik olduğu gösterilmiştir. Son olarak, makrofajlar da model15tumorigenesis teşvik edebilir,16,17.
Promosyon aşamasında mutasyona uğramış hücrelerin hücre çoğalması artar ve epidermisin sürekli hiperplazisi1. Bu durum 10-20 hafta içinde deride papilloma gelişimine yol açar, daha sonra papillomlar malign tümörlere, skuamöz hücreli karsinomlara (SCC) dönüşmeyebaşlar. Ancak, papillomların %10’dan azı maligniteye doğru ilerler, ancak bu oran farelerin genetik geçmişine de bağlıdır2,18. Bazı çalışmalar benign papillomas19ile karşılaştırıldığında malign tümörlerde açıkça belirgin özellikler bildirmiş olsa da, on yıllar boyunca ne tür hücrelerin başlangıçta malignliğe yol açan tümörlerde mutasyona uğramış olduğu bilinmiyordu,20. Ancak, son çalışmalar büyük ölçüde DMBA-TPA modelinde tümör oluşumunun klonal kökeni anlayışımızı artırmıştır21. 22. yıl. 23. Hem kemik iliği kaynaklı epitel hücreleri hem de saç folikülü kök hücrelerinin tümör oluşumuna katkıda bulunduğu gösterilmiştir22. Evreye özgü soy izleme çalışmaları benign papillomların monoklonal kökenli olduğunu ortaya çıkarmış, ancak yeni epitel hücre popülasyonları21,23. Ancak, hücre klonlarından sadece biri karsinogenez için bir sürücü olarak işlev görür; hras mutasyonu23içerir. Karsinom oluşumuna ilerleme bir klonal süpürme ile ilişkilidir23.
Kanserojen DMBA papilloma oluşumunu başlatır ve TPA tümör büyümesini destekler. Bu nedenle, tümör inisiyasyonu TPA tedavi döneminden önce deney keserek promosyon ayrı ayrı çalışılabilir. Tümör progresyonu haftalık olarak incelenir gibi çalışma boyunca ayrıntılı tümör büyüme analizi için büyük bir fırsat sunuyor. Tümörler dış kimyasallar tarafından üretildiği için mikroptaki onkojenik mutasyongereksizdir. Bu nedenle, genetik arka planın (örn. nakavt/transgen vs. yabani tip) tümörigenez üzerindeki etkilerini incelemek basittir2. Özetle, DMBA / TPA cilt kanseri modeli tümör ilerlemesinde bağışıklık sisteminin rolünü n yanı sıra tümör başlatma ve promosyon adımları bağımsız veya birbirine bağlı değerlendirilmesi için özellikle yararlı bir yaklaşımdır.
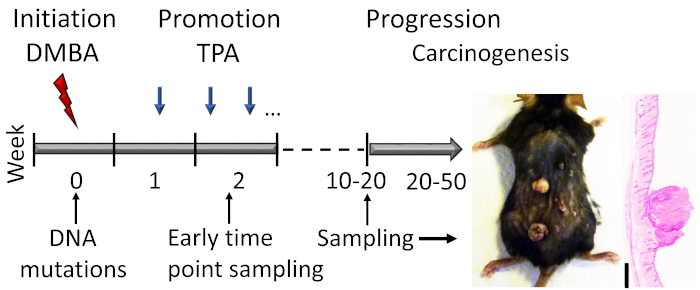
Şekil 1: DMBA-TPA’ya bağlı deri karsinogenez modeli anahat. Karsinojen DMBA, modelin başlangıç aşamasında DNA mutasyonlarını tetiklemek için topikal olarak uygulanır. Büyüme teşvik ajan TPA promosyon aşamasında hücre çoğalmasını artırmak için haftada 2x uygulanır, deride papillomgelişimine yol açan. Papilloma yanıtı bir platoya ulaştıktan sonra hayvanlar kurban edilir, genellikle 15-20 hafta içinde, farelerin genetik arka planına bağlı olarak. Papillomların küçük bir kısmı 20-50 hafta içinde SCC’lere daha da gelişebilir. Başlangıç ve erken terfi aşamasındaki erken olayları incelemek için numuneler toplanabilir (örneğin, ikinci TPA uygulamasından kısa bir süre sonra). 19 haftalık tedaviden sonra C57BL/6 fare derisinde papillomların temsili bir fotoğrafı ve hematoksilin ve eozin lekeli kesiti gösterilmiştir. Ölçek çubuğu = 0,1 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Protocol
Representative Results
Discussion
DMBA-TPA’ya bağlı cilt kanseri, son derece tekrarlanabilir olduğu ve inisiyasyondan maligniteye kadar tümör ilerlemesi hakkında bilgi verdiği için en sık kullanılan kanser modellerinden biridir. Anahtar sonuç ölçüsü, papilloma oluşumu, kolay ve güvenilir nicel. Model hem tümör inisiyasyonu (tümörsüz sağkalım) hem de progresyon (tümör sayıları ve boyutları) ile eş zamanlı olarak ele alılır. Model farklı bileşiklerin incelenmesi için uygundur, potansiyel terapötik gibi, ve genetik olara…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Bu çalışma Finlandiya Akademisi (25013080481 ve 25013142041 (I.J.), 286377 ve 295814 (M.P.), 287907 (T.J.),Päivikki ve Sakari Sohlberg Vakfı (M.P., T.J.), Finlandiya Tıp Vakfı (T.P.), Rekabetçi Devlet Araştırması Tampere Üniversitesi Hastanesi Uzman Sorumluluk Alanının Finansmanı (hibe 9V049 ve 9X044 (M.P.), 9X011 ve 9V010 (T.J.)), Fimlab Laboratuvarları Uzman Sorumluluk Alanının Rekabetçi Devlet Araştırma Finansmanı (grant X51409 (I.J.)), Tays Destek Vakfı (I.J., M.P., T.J.), Tampere Tüberküloz Vakfı (I.J., M.P., T.J.), Finlandiya Kültür Vakfı (M.V.), Paulo Vakfı (T.P.), Finlandiya Kanser Derneği (M.P.) ve Emil Aaltonen Vakfı (T.P.).
Materials
| 1000 ul RPT XL Graduated Filter Tip (Sterile), Refill | Starlab | S1182-1730-C | |
| 300 ul RTP Graduated Filter Tip (sterile), Refill | Starlab | S1180-9710-C | |
| 7,12-Dimethylbenz[a]anthracene (DMBA) | Sigma | D3254-100MG | Harmful if swallowed and may cause cancer. Store protected from light. |
| Acetone | Sigma | 1000141011 | Evaporates rapidly and is inflammable. |
| Attane vet 1000 mg/g | Piramal Critical Care Limited | Liquid isoflurane for inhalation | |
| Battery-Operated Clipper Isis | Albert Kerlb GmbH | GT421 | For shaving the fur |
| CONTRAfluran-Restgasfilter | ZeoSys GmbH | For anesthesia | |
| Linex Nature N1030 Ruler 30 cm | Staples Business Advantage | 60383 | For measuring papillomas |
| Medium CO2 Chamber 300 x 200 x 200mm – Red | VetTech Solutions Ltd | AN045AR | For sacrifice |
| Mekasoft | Mekalasi | 23008 | Table cover |
| Mice (Balb/c JRj) | Janvier labs | Other strains also possible | |
| Mice (C57BL/6JRj) | Janvier labs | Other strains also possible | |
| Panasonic Lumix DMC-FS5 Digital Camera | Panasonic | ||
| Paraformaldehyde | Merck | 30525-89-4 | For histology samples |
| Phorbol 12-myristate 13-acetate aka 12-Otetradecanoylphorbol-13-acetate (TPA) | Enzo | BML-PE160-0001 | |
| Precision balance PLJ-C/PLJ-G | KERN & SOHN GmbH | PLJ 600-3CM | |
| Pre-Set CO2 System-2 Chamber-S/S Housing | VetTech Solutions Ltd | AN044BX | For sacrifice |
| RNAlater | Qiagen | 76104 | For nucleic acid samples |
| Tacta pipette 100-1000 ul | Sartorius | LH-729070 | |
| Tacta pipette 20-200 ul | Sartorius | LH-729060 | |
| UNO Anaesthetic Key Filler | Scintica instrumentation inc. | For anesthesia | |
| UNO Face Mask for Mouse | Scintica instrumentation inc. | For anesthesia | |
| UNO FM2200 Flowmeter | Scintica instrumentation inc. | For anesthesia | |
| UNO Gas Exhaust Unit | Scintica instrumentation inc. | For anesthesia | |
| UNO Induction Box | Scintica instrumentation inc. | For anesthesia | |
| UNO200VAP Vaporizer | Scintica instrumentation inc. | For anesthesia |
References
- DiGiovanni, J. Multistage carcinogenesis in mouse skin. Pharmacology & Therapeutics. 54 (1), 63-128 (1992).
- Abel, E. L., Angel, J. M., Kiguchi, K., DiGiovanni, J. Multi-stage chemical carcinogenesis in mouse skin: fundamentals and applications. Nature Protocols. 4 (9), 1350-1362 (2009).
- Perez-Losada, J., Balmain, A. Stem-cell hierarchy in skin cancer. Nature Reviews. Cancer. 3 (6), 434-443 (2003).
- Bonham, K., et al. Activation of the cellular Harvey ras gene in mouse skin tumors initiated with urethane. Molecular Carcinogenesis. 2 (1), 34-39 (1989).
- Quintanilla, M., Brown, K., Ramsden, M., Balmain, A. Carcinogen-specific mutation and amplification of Ha-ras during mouse skin carcinogenesis. Nature. 322 (6074), 78-80 (1986).
- Nelson, M. A., Futscher, B. W., Kinsella, T., Wymer, J., Bowden, G. T. Detection of mutant Ha-ras genes in chemically initiated mouse skin epidermis before the development of benign tumors. Proceedings of the National Academy of Sciences of the United States of America. 89 (14), 6398-6402 (1992).
- Morris, R. J. A perspective on keratinocyte stem cells as targets for skin carcinogenesis. Differentiation. 72 (8), 381-386 (2004).
- Chung, Y. W., Kim, H. K., Kim, I. Y., Yim, M. B., Chock, P. B. Dual function of protein kinase C (PKC) in 12-O-tetradecanoylphorbol-13-acetate (TPA)-inducec manganese superoxide dismutase (MnSOD) expression: activation of CREB and FOXO3a by PKC-alpha phosphorylation and by PKC-mediated inactivation of Akt, respectively. The Journal of Biological Chemistry. 286 (34), 29681-29690 (2011).
- Su, Z., et al. Tumor promoter TPA activates Wnt/β-catenin signaling in a casein kinase 1-dependent manner. Proceedings of the National Academy of Sciences of the United States of America. 115 (32), 7522-7531 (2018).
- Swann, J. B., et al. Demonstration of inflammation-induced cancer and cancer immunoediting during primary tumorigenesis. Proceedings of the National Academy of Sciences of the United States of America. 105 (2), 652-656 (2008).
- Wang, L., Yi, T., Zhang, W., Pardoll, D. M., Yu, H. IL-17 enhances tumor development in carcinogen-induced skin cancer. Cancer Research. 70 (24), 10112-10120 (2010).
- He, D., et al. IL-17 mediated inflammation promotes tumor growth and progression in the skin. PLoS One. 7 (2), 32126 (2012).
- Roussel, L., et al. IL-17 promotes p38 MAPDK-dependent endothelial activation enhancing neutrophil recruitment to sites of inflammation. Journal of Immunology. 184 (8), 4531-4537 (2010).
- Wanqiu, H., Young-Hee, J., Hyun, S. K., Byung, S. K. Interleukin-6 (IL-6) and IL-17 synergistically promote viral persistence by inhibition cellular apoptosis and cytotoxic T cell function. Journal of Virology. 88 (15), 8479-8489 (2014).
- Yusuf, N., et al. Antagonistic roles of CD4+ and CD8+ T-cells in 7,12-dimethylbenz(a)anthracene cutaneous carcinogenesis. Cancer Research. 68 (10), 3924-3930 (2008).
- Gong, L., et al. Promoting effect of neutrophils on lung tumorigenesis is mediated by CXCR2 and neutrophil elastase. Molecular Cancer. 12 (1), 154 (2013).
- Vestweber, D., Wessel, F., Nottebaum, A. F. Similarities and differences in the regulation of leukocyte extravasation and vascular permeability. Seminars in Immunopathology. 36 (2), 177-192 (2014).
- Woodworth, C. D., et al. Strain-dependent differences in malignant conversion of mouse skin tumors is an inherent property of the epidermal keratinocyte. Carcinogenesis. 25 (9), 1771-1778 (2004).
- Tennenbaum, T., et al. The suprabasal expression of alpha 6 beta 4 integrin is associated with a high risk for malignant progression in mouse skin carcinogenesis. Cancer Research. 53 (20), 4803-4810 (1993).
- Hennings, H., Shores, R., Mitchell, P., Spangler, E. F., Yuspa, S. H. Induction of papillomas with a high probability of conversion to malignancy. Carcinogenesis. 6 (11), 1607-1610 (1985).
- Auto, Y., et al. Time-Series Analysis of Tumorigenesis in a Murine Skin Carcinogenesis Model. Scientific Reports. 8 (1), 12994 (2018).
- Park, H., et al. Bone marrow-derived epithelial cells and hair follicle stem cells contribute to development of chronic cutaneous neoplasms. Nature Communications. 9 (1), 5293 (2018).
- Reeves, M. Q., Kandyba, E., Harris, S., Del Rosario, R., Balmain, A. Multicolour lineage tracing reveals clonal dynamics of squamous carcinoma evolution from initiation to metastasis. Nature Cell Biology. 20 (6), 699-709 (2018).
- Dao, V., et al. Prevention of carcinogen and inflammation-induced dermal cancer by oral rapamycin includes reducing genetic damage. Cancer Prevention Research. 5, 400-409 (2015).
- Yeong, L. T., Abdul Hamid, R., Saiful Yazan, L., Khaza’ai, H., Mohtarrudin, N. Low dose triterpene-quinone fraction from Ardisia crispa root precludes chemical-induced mouse skin tumor promotion. BMC Complementary and Alternative Medicine. 15 (1), 431 (2015).
- Kong, Y. H., Xu, S. P. Salidroside prevents skin carcinogenesis induced by DMBA/TPA in a mouse model through suppression of inflammation and promotion of apoptosis. Oncology Reports. 39 (6), 2513-2526 (2018).
- Jung, M., Bu, S. Y., Tak, K. H., Park, J. E., Kim, E. Anticarcinogenic effect of quercetin by inhibition of insulin-like growth factor (IGF)-1 signaling in mouse skin cancer. Nutrition Research and Practice. 7 (6), 439-445 (2013).
- Hu, Y. Q., Wang, J., Wu, J. H. Administration of resveratrol enhances cell-cycle arrest followed by apoptosis in DMBA-induced skin carcinogenesis in male Wistar rats. European review for medical and pharmacological sciences. 13, 2935-2946 (2016).
- Schweizer, J., Loehrke, H., Hesse, B., Goerttler, K. 7,12-Dimethylbenz[a]anthracene/12-O-tetradecanoyl-phorbol-13-acetate-mediated skin tumor initiation and promotion in male Sprague-Dawley rats. Carcinogenesis. 3 (7), 785-789 (1982).
- Vähätupa, M., et al. T-cell-expressed proprotein convertase FURIN inhibits DMBA/TPA-induced skin cancer development. Oncoimmunology. 5 (12), 1245266 (2016).
- May, U., et al. Resistance of R-Ras knockout mice to skin tumour induction. Scientific Reports. 5, 11663 (2015).
- Krajewska, M., et al. Image analysis algorithms for immunohistochemical assessment of cell death events and fibrosis in tissue sections. The Journal of Histochemistry and Cytochemistry. 57 (7), 649-663 (2009).
- Järvinen, T. A., Ruoslahti, E. Target-seeking antifibrotic compound enhances wound healing and suppresses scar formation in mice. Proceedings of the National Academy of Sciences of the United States of America. 107 (50), 21671-21676 (2010).
- Schwarz, M., Münzel, P. A., Braeuning, A. Non-melanoma skin cancer in mouse and man. Archives of Toxicology. 87 (5), 783-798 (2013).
- Slaga, T. J. SENCAR mouse skin tumorigenesis model versus other strains and stocks of mice. Environmental Health Perspectives. 68, 27-32 (1986).
- Goerttler, K., Loehrke, H., Schweizer, J., Hesse, B. Systemic two-stage carcinogenesis in the epithelium of the forestomach of mice using 7,12-dimethylbenz(a)anthracene as initiator and the phorbol ester 12-O-tetradecanoylphorbol-13-acetate as promoter. Cancer Research. 39 (4), 1293-1297 (1979).
- Topping, D. C., Nettesheim, P. Promotion-like enhancement of tracheal carcinogenesis in rats by 12-O-tetradecanoylphorbol-13-acetate. Cancer Research. 40, 4352-4355 (1980).
- Wille, J. J. Circadian rhythm of tumor promotion in the two-stage model of mouse tumorigenesis. Cancer Letters. 190 (2), 143-149 (2003).
- Lee, Y. S., et al. Inhibition of skin carcinogenesis by suppression of NF-κB dependent ITGAV and TIMP-1 expression in IL32γ overexpressed condition. Journal of Experimental & Clinical Cancer Research. 37 (1), 293 (2018).
- Kiss, A., et al. Cell type-specific p38δ targeting reveals a context-, stage-, and sex-dependent regulation of skin carcinogenesis. International Journal of Molecular Sciences. 20 (7), 1532 (2019).
- Tomo-o, I., et al. Positron emission tomography imaging of DMBA/TPA mouse skin multi-step tumorigenesis. Molecular Oncology. 4 (2), 119-125 (2010).
- Mantovani, A., Allavena, P., Sica, A., Balkwill, F. Cancer-related inflammation. Nature. 454 (7203), 436-444 (2008).
- Crusz, S. M., Balkwill, F. R. Inflammation and cancer: advances and new agents. Nature Reviews. Clinical Oncology. 12 (10), 584-596 (2015).
- Hennings, L., et al. Malignant conversion and metastasis of mouse skin tumors: a comparison of SENCAR and CD-1 mice. Environmental Health Perspectives. 68, 69-74 (1986).
- Gómez-Cuadrado, L., Tracey, N., Ma, R., Qian, B., Brunton, V. G. Mouse models of metastasis: progress and prospects. Disease Models & Mechanisms. 10 (9), 1061-1074 (2017).
- Ouhtit, A., Ananthaswamy, H. N. A model for UV-induction of skin cancer. Journal of Biomedicine and Biotechnology. 1 (1), 5-6 (2001).
- Day, C. -. P., Marchalik, R., Merlino, G., Michael, H. T. Mouse models of UV-induced melanoma: genetics, pathology, and clinical relevance. Laboratory Investigation. 97 (6), 698-705 (2017).

