Cromatografía de Gases-Espectrometría de Masas Emparejada con La Vaporización Total De Microextracción En Fase Sólida Como Una Herramienta Forense
Summary
La microextracción en fase sólida de vaporización total (TV-SPME) vaporiza completamente una muestra líquida mientras que los analitos se absorben en una fibra SPME. Esto permite la partición del analito entre sólo el vapor del disolvente y el recubrimiento de fibra SPME.
Abstract
Cromatografía de gases – Espectrometría de masas (GC-MS) es una técnica de uso frecuente para el análisis de numerosos analitos de interés forense, incluyendo sustancias controladas, líquidos inflamables y explosivos. GC-MS se puede acoplar con microextracción en fase sólida (SPME), en la que una fibra con un recubrimiento sorptivo se coloca en el espacio de la cabeza por encima de una muestra o se sumerge en una muestra líquida. Los analitos se absorben sobre la fibra que luego se coloca dentro de la entrada de GC calentada para la desorción. Total Vaporization Solid-Phase Microextraction (TV-SPME) utiliza la misma técnica que la inmersión SPME pero sumerge la fibra en un extracto de muestra completamente vaporizado. Esta vaporización completa da como resultado una partición entre solo la fase de vapor y la fibra SPME sin interferencias de una fase líquida o de cualquier material insoluble. Dependiendo del punto de ebullición del disolvente utilizado, TV-SPME permite grandes volúmenes de muestra (por ejemplo, hasta cientos de microlitros). La derivatización en fibra también se puede realizar usando TV-SPME. TV-SPME se ha utilizado para analizar fármacos y sus metabolitos en el cabello, la orina y la saliva. Esta técnica simple también se ha aplicado a drogas callejeras, lípidos, muestras de combustible, residuos explosivos post-explosión y contaminantes en el agua. Este trabajo destaca el uso de TV-SPME para identificar adulterantes ilegales en muestras muy pequeñas (cantidades de microlitro) de bebidas alcohólicas. El gamma-hydroxybutyrate (GHB) y la gamma-butyrolactone (GBL) fueron identificados en los niveles que serían encontrados en bebidas puntiagudas. La derivatización por un agente trimetilsililo permitió la conversión de la matriz acuosa y el GHB en sus derivados de TMS. En general, TV-SPME es rápido, fácil y no requiere preparación de la muestra aparte de colocar la muestra en un vial de espacio para la cabeza.
Introduction
La microextracción en fase sólida (SPME) es una técnica de muestreo en la que se coloca una muestra líquida o sólida en un vial de espacio de cabeza y una fibra SPME, recubierta con un material polimérico, se introduce en el espacio de cabeza de la muestra (o se sumerge en una muestra líquida). El analito sesorbe sobre la fibra y luego la fibra se coloca dentro de la entrada GC para la desorción1,2. La microextracción en fase sólida de vaporización total (TV-SPME) es una técnica similar a la SPME de inmersión, pero vaporiza completamente una muestra líquida antes de que los analitos se adsorban en la fibra. Esto permite la partición del analito entre sólo el vapor del disolvente y el recubrimiento de la fibra, lo que permite que más del analito sea adsorbido sobre la fibra y resultando en una buena sensibilidad3. Hay varias fibras SPME disponibles y la fibra debe elegirse en función del analito de interés, el disolvente /matriz y el agente de derivatización. Véase el Cuadro 1 para los analitos establecidos de TV-SPME.
| muestra | Analito(s) | Fibra SPME recomendada | Referencia(s) |
| Cabello humano | Nicotina, cotinina | Polidimetilsiloxano/divinilbenceno (PDMS/DVB), poliacrilato (PA) | 3 |
| Polvo sin humo | Nitroglicerina, difenilamina | Polidimetilsiloxano (PDMS), polietilenglicol (PEG) | 7, 8 |
| Combustible de carreras | Metanol, nitrometano | clavija | 9 |
| Agua | Hidrocarburos aromáticos policíclicos | PDMS | 10 |
| bebestibles | ɣ-Ácido hidroxibutírico, ɣ-butirolactona | PDMS | Esta Obra |
| Polvo sólido | Metanfetamina, anfetamina | PDMS/DVB | inédito |
Tabla 1. Fibras SPME recomendadas con analitos TV-SPME establecidos.
Para realizar TV-SPME, los analitos se disuelven en un disolvente y una alícuota de esta mezcla se coloca en un vial de espacio para la cabeza. Las muestras no necesitan ser filtradas porque solo el solvente y los analitos volátiles se vaporizarán. Se deben utilizar volúmenes específicos de muestras líquidas para garantizar la vaporización total de la muestra. Estos volúmenes se determinan utilizando la Ley del Gas Ideal para calcular el número de moles de un disolvente multiplicado por el volumen molar del líquido (Ecuación 1).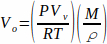 Ecuación 1
Ecuación 1
donde Vo es el volumen de la muestra (mL), P es la presión de vapor del disolvente (bar), Vv es el volumen del vial (L), R es la constante de gas ideal (0.083145 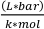 ), M es la masa molar del disolvente (g/mol), T es la temperatura (K), y
), M es la masa molar del disolvente (g/mol), T es la temperatura (K), y 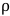 es la densidad del disolvente (g/mL). 3.
es la densidad del disolvente (g/mL). 3.
Para utilizar la presión de vapor correcta, se utiliza la ecuación de Antoine (Ecuación 2) para explicar la influencia de la temperatura:4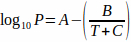 Ecuación 2
Ecuación 2
donde T es la temperatura y A, B y C son las constantes de Antoine para el disolvente. La ecuación 2 puede ser sustituida por la ecuación 1, produciendo: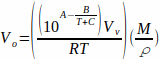 Ecuación 3
Ecuación 3
La ecuación 3 da el volumen de la muestra (Vo) que puede ser completamente vaporizado en función de la temperatura y el disolvente utilizado.
Para realizar la derivatización con TV-SPME, la fibra SPME se expone primero a un vial que contiene el agente de derivatización durante un período de tiempo predeterminado dependiendo del analito. La fibra SPME se expone entonces a un nuevo vial que contiene el analito de interés. Este vial se calienta dentro de un agitador calentado. El analito se adsorbe entonces sobre la fibra con el agente de derivatización. La derivatización del analito y/o la matriz tiene lugar en la fibra antes de ser insertada en la entrada gc para la desorción. La Figura 1 muestra una representación del proceso TV-SPME con derivatización.
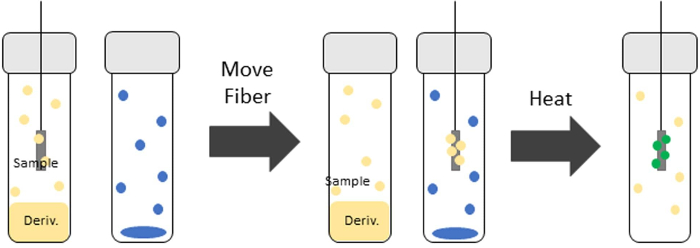
Figura 1: Representación del proceso TV-SPME con derivatización. La fibra SPME entra primero en el vial de derivatización donde el agente de derivatización (círculos amarillos) sesorbe sobre la fibra. La fibra se introduce en la muestra (círculos azules) y se calienta. La formación del derivado (círculos verdes) tiene lugar en la fibra durante el tiempo de extracción. Haga clic aquí para ver una versión más amplia de esta figura.
TV-SPME es beneficioso porque permite que el analito se derivetized durante el proceso de extracción que reduce el tiempo de análisis. Otros métodos, como la inyección de líquido, requieren que el analito reaccione con el agente derivatizante en solución antes de ser inyectado en el GC. TV-SPME también requiere poca o ninguna preparación de la muestra. Una matriz que contiene un analito se puede colocar directamente en el vial del espacio de la cabeza y analizarse. Muchos compuestos de interés son compatibles con TV-SPME. Los compuestos deben ser solubles en un disolvente y lo suficientemente volátiles como para permitir la vaporización. Además, los compuestos deben ser térmicamente estables para ser analizados por GC-MS. TV-SPME se ha utilizado para analizar fármacos y metabolitos de fármacos, combustibles de carreras, hidrocarburos aromáticos policíclicos y materiales explosivos3,5,6,7,8,9,10.
Protocol
Representative Results
Discussion
TV-SPME tiene algunos beneficios sobre la inyección de líquido GC en que los tamaños de muestra grandes (por ejemplo, 100 μL) se pueden utilizar sin modificaciones del instrumento. TV-SPME también tiene algunos de los mismos beneficios que el espacio de cabeza SPME. Headspace SPME no requiere ninguna extracción o filtración porque cualquier compuesto no volátil permanecerá en el vial de headspace y no se adsorberá en la fibra, produciendo una muestra limpia. Este método también ayuda a eliminar los efectos de…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Esta investigación fue apoyada por el Instituto Nacional de Justicia (Premio No. 2015-DN-BX-K058 & 2018-75-CX-0035). Las opiniones, hallazgos y conclusiones expresados aquí son los del autor y no reflejan necesariamente los de las organizaciones de financiación.
Materials
| 10 µL Syringe | Gerstel | 100111-014-00 | |
| BSTFA + 1% TMCS (10 x 1 GM) | Regis Technologies Inc. | 50442882 | |
| eVol XR Sample Dispensing System Kit | ThermoFisher Scientific | 66002-024 | |
 -Butyrolactone (GBL) -Butyrolactone (GBL) |
Sigma-Aldrich | B103608-26G | |
 -Hydroxy Butyric Acid (GHB) -Hydroxy Butyric Acid (GHB) |
Cayman Chemicals | 9002506 | |
| Headspace Screw-Thread Vials, 18 mm | Restek | 23083 | |
| Magnetic Screw-Thread Caps, 18 mm | Restek | 23091 | |
| Optima water for HPLC | Fisher Chemical | W71 | |
| SPME Fiber Assembly Polydimethylsiloxane (PDMS) | Supelco | 57341-U | |
| SPME Fiber Assembly Polydimethylsiloxane/Divinylbenzene (PDMS/DVB) | Supelco | 57293-U | |
| Topaz 2.0 mm ID Straight Inlet Liner | Restek | 23313 |
References
- Pawliszyn, J. B. Method and Device for Solid Phase Microextraction and Desorption. United States patent. , (2005).
- Pawliszyn, J. . Solid phase microextraction: theory and practice. , (1997).
- Rainey, C. L., Bors, D. E., Goodpaster, J. V. Design and optimization of a total vaporization technique coupled to solid-phase microextraction. Analytical Chemistry. 86 (22), 11319-11325 (2014).
- Sinnott, R. . Chemical Engineering Design: Chemical Engineering. 6, (2005).
- Davis, K. . Detection of Illicit Drugs in Various Matrices Via Total Vaporization Solid-Phase Microextraction (TV-SPME). , (2019).
- Ash, J., Hickey, L., Goodpaster, J. Formation and identification of novel derivatives of primary amine and zwitterionic drugs. Forensic Chemistry. 10, 37-47 (2018).
- Sauzier, G., Bors, D., Ash, J., Goodpaster, J. V., Lewis, S. W. Optimisation of recovery protocols for double-base smokeless powder residues analysed by total vaporisation (TV) SPME/GC-MS. Talanta. 158, 368-374 (2016).
- Bors, D., Goodpaster, J. Mapping smokeless powder residue on PVC pipe bomb fragments using total vaporization solid phase microextraction. Forensic science international. 276, 71-76 (2017).
- Bors, D., Goodpaster, J. Chemical analysis of racing fuels using total vaporization and gas chromatography mass spectrometry (GC/MS). Analytical Methods. 8 (19), 3899-3902 (2016).
- Beiranvand, M., Ghiasvand, A. Design and optimization of the VA-TV-SPME method for ultrasensitive determination of the PAHs in polluted water. Talanta. 212, 120809 (2020).

