Inductie van microstreaming door niet-bolvormige bubbeloscillaties in een akoestisch levitatiesysteem
Summary
Een snelle en betrouwbare techniek wordt voorgesteld om de vormoscillaties van een enkele, gevangen akoestische bel te regelen die is gebaseerd op coalescentietechniek tussen twee bellen. De steady-state, symmetrie-gecontroleerde bubbelvormoscillaties maken analyse mogelijk van de vloeistofstroom die wordt gegenereerd in de buurt van de belinterface.
Abstract
Wanneer ze zich in de buurt van biologische barrières bevinden, kunnen oscillerende microbubbels de permeabiliteit van het celmembraan verhogen, waardoor de internalisatie van geneesmiddelen en genen mogelijk wordt. Experimentele waarnemingen suggereren dat de tijdelijke permeabilisatie van deze barrières te wijten kan zijn aan schuifspanning die wordt uitgeoefend op celweefsels door cavitatiemicrostreaming. Cavitatie microstreaming is het genereren van vortexstromen die ontstaan rond oscillerende ultrasone microbubbels. Om dergelijke vloeistofstromen te produceren, moeten bellenoscillaties afwijken van zuiver bolvormige oscillaties en een translationele instabiliteit of vormmodi bevatten. Experimentele studies van door bellen geïnduceerde stromingen en schuifspanning op nabijgelegen oppervlakken zijn vaak beperkt in hun reikwijdte vanwege de moeilijkheid om vormvervormingen van microbubbels op een stabiele en controleerbare manier vast te leggen. We beschrijven het ontwerp van een akoestische levitatiekamer voor de studie van symmetrie-gecontroleerde niet-bolvormige oscillaties. Een dergelijke controle wordt uitgevoerd door gebruik te maken van een coalescentietechniek tussen twee naderende bellen in een voldoende intens ultrasoon veld. De controle van niet-bolvormige oscillaties opent de weg naar een gecontroleerde cavitatie-microstreaming van een vrije oppervlakte-oscillerende microbubbel. Camera’s met een hoge framesnelheid maken het mogelijk om quasi-gelijktijdig de niet-bolvormige bubbeldynamiek op de akoestische tijdschaal en de vloeistofstroom op een lagere tijdschaal te onderzoeken. Er wordt aangetoond dat een grote verscheidenheid aan vloeistofpatronen kan worden verkregen en dat deze gecorreleerd zijn aan de modale inhoud van de bubbelinterface. We tonen aan dat zelfs de hoge-orde vormmodi vloeistofpatronen over grote afstand kunnen creëren als de interfacedynamiek verschillende modi bevat, wat het potentieel van niet-bolvormige oscillaties voor gerichte en gelokaliseerde medicijnafgifte benadrukt.
Introduction
In de geneeskunde moet een toegediend medicijn veel obstakels in het levende systeem doordringen voordat het de gewenste doelen bereikt. De meeste medicijnen worden echter snel uit de bloedbaan verwijderd. De targeting-efficiëntie is laag en ze kunnen niet gemakkelijk celmembranen passeren, wat leidt tot ineffectieve medicijnafgifte. Momenteel is het gebruik van microbubbels in combinatie met echografie voorgesteld als een innovatieve methode voor niet-invasieve, nauwkeurige en gerichte toediening van geneesmiddelen en genen aan pathologische weefsels en cellen1. In deze benadering kunnen microbubbels een rol spelen als dragers waarbij vrije geneesmiddelen ofwel samen met een gasbelsuspensie worden geïnjecteerd of op het oppervlak worden geladen. Microbubbels kunnen ook fungeren als een lokale vector voor het heroriënteren van de ultrasone energie om te interageren met de cellen. Kortom, onder ultrasone blootstelling comprimeren en zetten bellen stabiel uit, een regime dat stabiele cavitatie wordt genoemd en dat vloeistofstromen genereert en dus schuifspanning op nabijgelegen objecten. Microbubbels kunnen ook niet-lineair oscilleren en uitzetten tot instorting, in het regime van inertiële cavitatie, waarbij schokgolven worden geproduceerd die zich radiaal voortplanten vanaf de instortingsplaats2. Het is aangetoond dat cavitatie, stabiel of inertiaal, de permeabilisatie van celmembranen verbetert en zo de internalisatie van geneesmiddelen in de cel3 verbetert.
In therapeutische toepassingen is het begrijpen van het mechanisme van de bubbel-cel interactie erg belangrijk, maar er zijn verschillende barrières, zowel van wetenschappelijke als technische kanten, die voorkomen dat onze kennis vooruitgaat. Ten eerste is het vastleggen van de dynamiek van cellen als reactie op door bellen geïnduceerde mechanische stimuli erg moeilijk4. Op de akoestische tijdschaal kunnen de eerste-orde microbubbeloscillaties leiden tot activering van membraankanalen, waardoor moleculaire passage over biologische interfaces wordt vergemakkelijkt. Dit gebeurt door de directe oscillatie van het celmembraan, ook wel “cellulaire massage” genoemd5. Kanaalactivering na directe mechanische stress werd aangetoond met behulp van patch-clamp-technieken die elektrofysiologische eigenschappen van celmembranen maten tijdens en na ultrasone blootstelling6. Het meten van bel-geïnduceerde celdynamica (d.w.z. het volledige veld van vervorming van het celmembraan) op de akoestische tijdschaal, zou ook inzicht geven in de drempel van membraangebiedexpansie Δ A/ A die nodig is om poriën in het celmembraan te induceren7. De tweede barrière is het beheersen van het instortende bubbelregime om microbubbel-geïnduceerde cellyse te voorkomen. Bubbelinstortingen en geïnduceerde microjets zijn geïdentificeerd als een mechanisme waardoor membraanperforatie optreedt 8,9. Eenmaal gepermeabiliseerd, herstelt het celmembraan door calciumzelfafdichting van de lipide bilayers en fusie van intracellulaire blaasjes9. Het optreden van bubbelinstortingen kan ook dodelijke schade aan de cel veroorzaken en onnodige bijwerkingen in de omliggende veroorzaken. In gevoelige toepassingen zoals ultrasoon gemedieerde bloed-hersenbarrièreopening, is het algemeen aanvaard dat inwaaiende bubbelinstortingen moeten worden vermeden10.
Daarom worden momenteel enorme inspanningen geleverd aan het ontwerp van ultrasone emissiesequenties, in combinatie met passieve cavitatiemonitoring en -controle, om stabiele oscillaties van microbubbels te garanderen11. In dit stabiele regime is verondersteld dat stabiel oscillerende bellen een sterke rol spelen bij het activeren van membraanpermeabilisatie door ruimtelijk gerichte schuifspanning op het celmembraante bevorderen 7. De schuifspanning is het gevolg van de vloeistofstromen die ontstaan in de buurt van de oscillerende bellen. Deze vloeistofstromen worden cavitatie-microstreaming genoemd en, zoals hierboven vermeld, zijn ze een van de verschillende mogelijke mechanismen die verantwoordelijk zijn voor een verbeterde opname van extracellulaire moleculen. Bij het omgaan met suspensie van bellen of cellen zoals in-vitro biologische transfecties assays12, kan permeabilisatie door microstreaming veel efficiënter zijn dan permeabilisatie door bubbelinstorting. Dit kan worden aangetoond door een eenvoudige geometrische overweging. In celsuspensies zal sonoporatie efficiënt zijn als de meerderheid van de gesuspendeerde cellen wordt onderworpen aan voldoende grote mechanische effecten (wat leidt tot membraanpermeabilisatie). Het is bekend dat instortingen van bellen worden gericht langs de richting van het breken van isotrope symmetrie, zoals de bellenwandas13 of de bellenbel- en belcellijn die hun massamiddelpunt14 verbinden. De geproduceerde microjet is daarom een ruimtelijk gelokaliseerd fenomeen langs een eindig aantal lijnen die de cel- en bubbelcentra verbinden. Afhankelijk van de cel- en bubbelconcentratie, evenals de bubbel-celafstand, is dit effect mogelijk niet het meest efficiënt om het hele aantal gesuspendeerde cellen te permeabiliseren. Cavitatiemicrostreaming daarentegen is een fenomeen dat zich voordoet op een langzame tijdschaal, met een grote ruimtelijke expansie in vergelijking met de bubbelstraal. Ook wordt de vloeistofstroom rondom de bel verdeeld en kan daarom een groter aantal cellen beïnvloeden, op een zeer groot bereik. Daarom is het begrijpen van de gegenereerde cavitatie-microstreaming rond een oscillerende bel een voorwaarde voor het beheersen en kwantificeren van de door de bel geïnduceerde schuifspanning die op cellen wordt toegepast.
Om dit te doen, bestaat een voorbereidende stap uit het beheersen van de bolvormige en niet-bolvormige oscillaties van een ultrasoon aangedreven bel, omdat de gegenereerde vloeistofstromen worden geïnduceerd door de beweging van de belinterface15,16. Met name vormschommelingen van microbubbels moeten worden geactiveerd en stabiel worden gehouden. Bovendien moet de oriëntatie van de oscillaties van de belvorm worden gecontroleerd om de correlatie tussen de dynamiek van de bubbelinterface en het geïnduceerde microstreamingpatroon goed te analyseren. Bij het samenvatten van de bestaande literatuur is het duidelijk dat gedetailleerde experimentele resultaten van cavitatie-geïnduceerde microstreaming alleen beschikbaar zijn voor bellen die aan een oppervlak zijn bevestigd. Aan de muur bevestigde microbubbels worden vaak gebruikt voor het beoordelen van nauwkeurige interfacedynamiek en celinteracties op micrometerschaal onder een ultrasnel microscopiesysteem. Deze configuratie is therapeutisch relevant bij het overwegen van trillende microbubbels op het celmembraan17,18,19. De studie van aan het substraat bevestigde bubbels kan de analyse van de bellendynamiek echter ingewikkelder maken, deels vanwege de complexe aard van de contactlijndynamiek20 en het activeren van asymmetrische vormmodi21. In medische en biologische toepassingen worden bellen die niet aan een muur zijn bevestigd vaak aangetroffen in besloten geometrieën zoals kleine vaten. Dit heeft een aanzienlijke invloed op de dynamiek van bubbels en vorminstabiliteiten. Met name de aanwezigheid van een nabijgelegen muur verschuift de drukdrempel voor de vormmodus, waardoor de drukwaarden worden verlaagd, afhankelijk van het nummer van de vormmodus en de bubbelgrootte22. De wand beïnvloedt ook de door bubbels geïnduceerde microstreaming met mogelijk een hogere intensiteit voor de geproduceerde stroom23.
Van alle mogelijke scenario’s die microbubbels kunnen ervaren (vrij of bevestigd, dicht bij een muur, instortend of stabiel oscillerend), stellen we voor om de niet-bolvormige dynamiek van een enkele bel ver van elke grens te onderzoeken. De experimentele opstelling is gebaseerd op een akoestisch levitatiesysteem24 waarbij een staande ultrasone golf wordt gebruikt om de bel op te vangen. Dit scenario komt overeen met medische toepassingen waarbij een verzameling zwevende bellen en cellen naast elkaar bestaan in bijvoorbeeld een sonotransfectiekamer. Voor zover bubbels en cellen niet te dicht bij elkaar staan, wordt aangenomen dat de aanwezigheid van een cel geen invloed heeft op de dynamiek van de belleninterface. Wanneer cellen de lusachtige trajecten van de cavitatie-geïnduceerde microstreaming volgen, naderen en stoten ze cyclisch af van de bellocatie en kunnen we aannemen dat de aanwezigheid van de cel noch het stroompatroon noch de gemiddelde snelheid beïnvloedt. Bovendien zijn niet-bolvormige dynamica en geïnduceerde microstreaming van enkele bubbels ver van de grens bekend vanuit een theoretisch oogpunt. Om de door de bel geïnduceerde vloeistofstroom te koppelen aan de dynamiek van de bubbelcontour, is het nodig om de dynamiek van de bubbelinterface nauwkeurig te karakteriseren. Om dit te doen, verdient het de voorkeur om de spatiotemporele schaal in experimentele studies aan te passen aan die welke in therapieën worden gebruikt, zodat acquisitie met gemeenschappelijke hogesnelheidscamera’s (minder dan 1 miljoen frame / seconde) mogelijk is door grote bellen te gebruiken die op lagere frequenties worden geëxciteerd. Bij het beschouwen van ongecoate bubbels is de eigenfrequentie ω n van een gegeven modus n gerelateerd aan de bubbelgrootte als 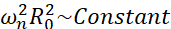 25. Deze radius-eigenfrequentierelatie is enigszins gewijzigd bij het beschouwen van gepelde bellen26, maar de orde van grootte van de eigenfrequentie ωn blijft hetzelfde. Het onderzoeken van bellen met evenwichtsstralen ~50μm in een 30 kHz ultrasoon veld is dus vergelijkbaar met het bestuderen van gecoate bellen van radii ~3μm in een 1,7 MHz-veld, zoals voorgesteld door Dollet et al.27. Vergelijkbare vormmodusnummers en dus microstreamingpatronen worden daarom verwacht.
25. Deze radius-eigenfrequentierelatie is enigszins gewijzigd bij het beschouwen van gepelde bellen26, maar de orde van grootte van de eigenfrequentie ωn blijft hetzelfde. Het onderzoeken van bellen met evenwichtsstralen ~50μm in een 30 kHz ultrasoon veld is dus vergelijkbaar met het bestuderen van gecoate bellen van radii ~3μm in een 1,7 MHz-veld, zoals voorgesteld door Dollet et al.27. Vergelijkbare vormmodusnummers en dus microstreamingpatronen worden daarom verwacht.
Om niet-bolvormige oscillaties van de belinterface te activeren, is het noodzakelijk om een bepaalde drukdrempel te overschrijden die straalafhankelijk is, zoals weergegeven in figuur 1. Bestaande experimentele technieken zijn gebaseerd op de toename van de akoestische druk om oppervlaktemodi te activeren (geïllustreerd door pad (1) in figuur 1), hetzij door stapsgewijze drukverhoging28 , hetzij door gemoduleerde amplitude-excitatie die verantwoordelijk is voor het periodiek begin en het uitsterven van oppervlaktemodi29. De belangrijkste nadelen van deze technieken zijn (i) een willekeurige oriëntatie van de symmetrie-as van de oppervlakte-oscillaties die niet kunnen worden gecontroleerd om zich in het beeldvormingsvlak te bevinden, (ii) een korte levensduur van de belvormoscillaties die de analyse van de geïnduceerde vloeistofstromen moeilijk maken op grotere tijdschalen, en (iii) de frequente activering van onstabiele vormmodi. We stellen een alternatieve techniek voor om de drukdrempel te overschrijden bij een constante akoestische druk in de radius/drukkaart, zoals geïllustreerd door het pad (2) in figuur 1. Om dit te doen, is het vereist om de bubbelgrootte zodanig te vergroten dat deze zich in de instabiliteitszone bevindt. Een dergelijke toename wordt uitgevoerd door een bubble coalescence-techniek. De coalescentie van twee, aanvankelijk bolvormig oscillerende, microbubbels wordt uitgebuit om één enkele vervormde bel te creëren. Als de akoestische druk en de belgrootte van de samengesmolten bel zich in de instabiliteitszone bevinden, worden oppervlaktemodi geactiveerd. We hebben ook aangetoond dat de coalescentietechniek stabiele vormoscillaties induceert in een steady-state regime, evenals een gecontroleerde symmetrie-as gedefinieerd door de rechtlijnige beweging van de twee naderende bellen. Omdat een stabiele vormoscillatie gedurende enkele minuten wordt gegarandeerd, is de analyse van door bellen geïnduceerde vloeistofstroom mogelijk door het vloeibare medium te bezaaien met fluorescerende microdeeltjes, verlicht door een dunne laserplaat. Het registreren van de beweging van de vaste microdeeltjes in de buurt van de belleninterface maakt het mogelijk om het patroon van de geïnduceerde vloeistofstroom30 te identificeren. Het algemene principe van het triggeren van belvormoscillaties, wat leidt tot een tijdstabiele vloeistofstroom, wordt geïllustreerd in figuur 2.
In het volgende protocol schetsen we de stappen die nodig zijn om stabiele belvormoscillaties te creëren via de coalescentietechniek en beschrijven we de metingen van vloeistofstroming. Dit omvat het ontwerp van het akoestische levitatiesysteem, de akoestische kalibratie, bellenkernvorming en de coalescentietechniek, de meting van de dynamiek van de bubbelinterface en de omringende vloeistofstroom en de beeldverwerking.
Protocol
Representative Results
Discussion
De gepresenteerde procedure bestaat uit het gebruik van bubbelcoalescentie om steady-state, symmetrie-gecontroleerde belvormoscillaties te activeren, waardoor de vloeistofstroom op lange termijn die door deze oscillaties wordt geïnduceerd, kan worden bestudeerd. De belangrijkste uitdaging in de techniek is de controle van niet-bolvormige oscillaties voor een bel die gevangen zit, ver van grenzen.
De meeste bestaande technieken die in de literatuur worden voorgesteld, waren gericht op aan het …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dit werk werd ondersteund door de LabEx CeLyA van de Universiteit van Lyon (ANR-10-LABX-0060 / ANR-11-IDEX-0007).
Materials
| Aspherical lens | Thorlabs | AL4050 | Lens of focus 40 mm |
| Continuous wave laser source | CNI | MLL6FN | DPSS laser of wavelength 532nm, energy 400 mW |
| Cylindrical plano-concave lens | Thorlabs | LJ1277L1-A | lens of focus -25?4mm |
| Cylindrical plano-concave lens | Thorlabs | LK1900L1 | lens of focus 250 mm |
| Fluorescent particles | Duke Scientific | R700 | Red polymer fluorescent microspheres |
| Function generator | Agilent | HP33120 | Generator of function feeding the ultrasound transducer |
| High-speed camera | Vision Research | Phantom v12.0 | High-speed recording up to 1 Mfps |
| Liquid medium | Carlo Erba | Water for analysis | Demineralized, undegassed water |
| Multiphysics software | Comsol | None | Softwate for simulating the acoustic field of the levitation chamber |
| Nd:Yag pulsed laser | New Wave Research | Solo III-15 | 5 ns pulse duration, λ=532 nm, 3.5 mm beam diameter, up to 50 mJ |
| Plano-concave lens | Thorlabs | N-BK7 | lens of focus 125 mm |
| Spherical concave lens | Thorlabs | N-SF11 | Bi-concave lens of focus -25mm |
| Ultrasound transducer | SinapTec | Custom-made | Nominal frequency 31kHz, active area 35mm diameter |
| Visualization software | NIH | ImageJ | Software for image processing and analysis in Java |
| XY Linear stage | Newport | M-406 | Displacement stage with micrometric screw |
| Z-axis linear stage | Edmund Optics | 62-299 | Vertical displacement stage with micrometric screw |
References
- Roovers, S., et al. The role of ultrasound-driven microbubble dynamics in drug delivery: from microbubble fundamentals to clinical translation. Langmuir. 35 (31), 10173-10191 (2019).
- Liu, H. L., Fan, C. H., Ting, C. Y., Yeh, C. K. Combining microbubbles and ultrasound for drug delivery to brain tumors: current progress and overview. Theranostics. 4 (4), 432-444 (2014).
- Lammertink, B. H. A., et al. Sonochemotherapy: from bench to bedside. Frontiers in Pharmacology. 6, 138 (2015).
- Lajoinie, G., et al. In vitro methods to study bubble-cell interactions: fundamentals and therapeutic applications. Biomicrofluidics. 10, 011501 (2016).
- Van Wamel, A., Bouakaz, A., Versluis, M., de Jong, N. Micromanipulation of endothelial cells: ultrasound-microbubble-cell interaction. Ultrasound in Medicine and Biology. 30, 1255-1258 (2004).
- Tran, T. A., Roger, S., Le Guennec, J. Y., Tranquart, F., Bouakaz, A. Effect of ultrasound-activated microbubbles on the cell electrophysiological properties. Ultrasound in Medicine and Biology. 33, 158-163 (2007).
- Marmottant, P., Hilgenfeldt, S. Controlled vesicle deformation and lysis by single oscillating bubbles. Nature. 423 (6936), 153-156 (2003).
- Prentice, P. A., Cuschieri, K., Dholakia, K., Prausnitz, M., Campbell, P. Membrane disruption by optically controlled microbubble cavitation. Nature Physics. 1, 107-110 (2005).
- Kudo, N., Okada, K., Yamamoto, K. Sonoporation by single-shot pulsed ultrasound with microbubbles adjacent to cells. Biophysical Journal. 96, 4866-4876 (2009).
- Novell, A., et al. A new safety index based on intrapulse monitoring of ultra-harmonic cavitation during ultrasound-induced blood-brain barrier opening procedures. Scientific Reports. 10, 10088 (2020).
- Cornu, C., et al. Ultrafast monitoring and control of subharmonic emissions of an unseeded bubble cloud during pulsed sonication. Ultrasonics Sonochemistry. 42, 697-703 (2018).
- Reslan, L., Mestas, J. L., Herveau, S., Béra, J. C., Dumontet, C. Transfection of cells in suspension by ultrasound cavitation. Journal of Controlled Release. 142 (2), 251-258 (2010).
- Reuter, F., Gonzalez-Avila, S. R., Mettin, R., Ohl, C. D. Flow fields and vortex dynamics of bubbles collapsing near a solid boundary. Physical Review Fluids. 2, 064202 (2017).
- Chew, L. W., Klaseboer, E., Ohl, S. W., Khoo, B. C. Interaction of two differently sized oscillating bubbles in a free field. Physical Review E. 84, 066307 (2011).
- Doinikov, A. A., Bouakaz, A. Acoustic microstreaming around a gas bubble. The Journal of the Acoustical Society of America. 127 (2), 703-709 (2010).
- Tho, P., Manasseh, R., Ooi, A. Cavitation microstreaming patterns in single and multiple bubble systems. Journal of Fluid Mechanics. 576, 191-233 (2007).
- Van Wamel, A., et al. Vibrating microbubbles poking individual cells: Drug transfer into cells via sonoporation. Journal of Controlled Release. 112, 149-155 (2006).
- Helfield, B., Chen, X., Watkins, S. C., Villanueva, F. S. Biophysical insight into mechanisms of sonoporation. PNAS. 113 (36), 9983-9988 (2016).
- Pereno, V., et al. Layered acoustofluidic resonators for the simultaneous optical and acoustic characterization of cavitation dynamics, microstreaming, and biological effects. Biomicrofluidics. 12, 034109 (2018).
- Shklyaev, S., Straube, A. V. Linear oscillations of a compressible hemispherical bubble on a solid substrate. Physics of Fluids. 20, 052102 (2008).
- Fauconnier, M., Bera, J. C., Inserra, C. Nonspherical modes non-degeneracy of a tethered bubble. Physical Review E. 102, 033108 (2020).
- Xi, X., Cegla, F., Mettin, R., Holsteyns, F., Lippert, A. Study of non-spherical bubble oscillations near a surface in a weak acoustic standing wave field. The Journal of the Acoustical Society of America. 135, 1731 (2014).
- Doinikov, A. A., Bouakaz, A. Effect of a distant rigid wall on microstreaming generated by an acoustically driven gas bubble. Journal of Fluid Mechanics. 742, 425-445 (2014).
- Cleve, S., Guédra, M., Inserra, C., Mauger, C., Blanc-Benon, P. Surface modes with controlled axisymmetry triggered by bubble coalescence in a high-amplitude acoustic field. Physical Review E. 98, 033115 (2018).
- Lamb, H. . Hydrodynamics. 6th ed. , (1932).
- Liu, Y., Wang, Q. Stability and natural frequency of nonspherical mode of an encapsulated microbubble in a viscous liquid. Physics of Fluids. 28, 062102 (2016).
- Dollet, B., et al. Nonspherical oscillations of ultrasound contrast agent microbubbles. Ultrasound in Medicine and Biology. 34 (9), 1465-1473 (2008).
- Versluis, M., et al. Microbubble shape oscillations excited through ultrasonic parametric driving. Physical Review E. 82, 026321 (2010).
- Guédra, M., Cleve, S., Mauger, C., Blanc-Benon, P., Inserra, C. Dynamics of nonspherical microbubble oscillations above instability threshold. Physical Review E. 96, 063104 (2017).
- Cleve, S., Guédra, M., Mauger, C., Inserra, C., Blanc-Benon, P. Microstreaming induced by acoustically trapped, non-spherically oscillating microbubbles. Journal of Fluid Mechanics. 875, 597-621 (2019).
- Doinikov, A. A., Cleve, S., Regnault, G., Mauger, C., Inserra, C. Acoustic microstreaming produced by nonspherical oscillations of a gas bubble. I. Case of modes 0 and m. Physical Review E. 100, 033104 (2019).
- Inserra, C., Regnault, G., Cleve, S., Mauger, C., Doinikov, A. A. Acoustic microstreaming produced by nonspherical oscillations of a gas bubble. III. Case of self-interacting modes n-n. Physical Review E. 101, 013111 (2020).
- Prabowo, F., Ohl, C. D. Surface oscillations and jetting from surface attached acoustic driven bubbles. Ultrasonics Sonochemistry. 18 (1), 431-435 (2011).
- Garbin, V., et al. Changes in microbubble dynamics near a boundary revealed by combined; optical micromanipulation and high-speed imaging. Applied Physics Letters. 90, 114103 (2007).
- Collis, J., et al. Cavitation microstreaming and stress fields created by microbubbles. Ultrasonics. 50, 273-279 (2010).
- Loughran, J., Eckersley, R. J., Tang, M. X. Modeling non-spherical oscillations and stability of acoustically driven shelled microbubbles. The Journal of the Acoustical Society of America. 131 (6), 4349-4357 (2012).
- Vos, H. J., Dollet, B., Bosch, J. G., Versluis, M., de Jong, N. Nonspherical vibrations of microbubbles in contact with a wall – a pilot study at low mechanical index. Ultrasound in Medicine and Biology. 34 (4), 685-688 (2008).
- Regnault, G., Mauger, C., Blanc-Benon, P., Inserra, C. Secondary radiation force between two closely spaced acoustic bubbles. Physical Review E. 102, 031101 (2020).

