Använda GAL4-UAS-systemet för funktionell genetik i Anopheles gambiae
Summary
Tvåpartssystemet GAL4-UAS är ett mångsidigt verktyg för modifiering av genuttryck på ett kontrollerat spatiotemporalt sätt som tillåter funktionell genetisk analys i Anopheles gambiae. De förfaranden som beskrivs för att använda detta system är en halvstandardiserad kloningsstrategi, sexning och screening av puppar för fluorescerande proteinmarkörer och embryofixering.
Abstract
Tvåpartssystemet GAL4-UAS är ett mångsidigt och kraftfullt verktyg för funktionell genetisk analys. Kärnan i systemet är att korsa transgena “förarlinjer” som uttrycker jäst transkriptionsfaktorn GAL4 på ett vävnadsspecifikt sätt, med transgena “responder” linjer som bär en kandidat gen / RNA interferens konstruktion vars uttryck styrs av Uppströms aktiveringssekvenser (UAS) som binder GAL4. I den efterföljande avkomman uttrycks genen eller ljuddävarekonstruktionen således på ett föreskrivet spatiotemporalt sätt, vilket gör det möjligt att analysera de resulterande fenotyperna och genfunktionen härledas. Det binära systemet möjliggör flexibilitet i experimentella metoder för att screen fenotyper genereras av transgene uttryck i flera vävnad-specifika mönster, även om allvarliga fitness kostnader induceras. Vi har anpassat detta system för Anopheles gambiae, den viktigaste malariavektorn i Afrika.
I den här artikeln tillhandahåller vi några av de vanliga procedurer som används under GAL4-UAS-analysen. Vi beskriver An. gambiae GAL4-UAS linjer som redan genereras, liksom kloning av nya responder konstruktioner för upregulation och RNAi knockdown. Vi anger en steg för steg guide för sexing av myggpuppar för att upprätta genetiska kors, som också inkluderar screening avkomma för att följa arv av fluorescerande genmarkörer som taggar föraren och responder insättningar. Vi presenterar också ett protokoll för att rensa An. gambiae embryon för att studera embryonal utveckling. Slutligen introducerar vi potentiella anpassningar av metoden för att generera förarlinjer genom CRISPR/Cas9 införande av GAL4 nedströms målgener.
Introduction
Bipartite GAL4-UAS-systemet är arbetshästen för funktionell karakterisering av gener i insektsmodellorganismen Drosophila melanogaster1,2,3. För att använda GAL4-UAS-systemet korsas transgena förarlinjer, som uttrycker jäst transkriptionsfaktorn GAL4 under kontroll av en reglerande sekvens, med responderlinjer som bär en gen av intresse eller RNA-interferens (RNAi) konstruktion som styrs av en uppströms aktiveringssekvens (UAS) som erkänns av GAL4. Avkomman till detta kors uttrycker det transgene av intresse i ett spatiotemporal mönster dikteras av promotorn som kontrollerar GAL4 uttryck (figur 1). Fenotyper som visas av avkomman av förar-responder kors kan bedömas för att klargöra funktionen av kandidat gener. Även om D. melanogaster har använts för att undersöka gener från andra organismer4,5,6,7, har GAL4-UAS-systemet nu anpassats för användning i insekter av medicinsk och jordbruks betydelse för att ge direkt analys av arten av intresse 8,9,10,11,12,13,14.
I den afrikanska malariamyggan, Anopheles gambiae, testades GAL4-UAS-systemet först av cellinjen co-transfection9. Flera konstruktioner analyserades för effektivitet i olika parvisa kombinationer och fann att 14 tandem upprepade UAS kompletteras med en liten konstgjord intron (UAS-14i) visade det bredaste utbudet av aktiveringspotential när den används med en panel av GAL4 förare. För att demonstrera in vivo-funktionalitet användes dessa konstruktioner sedan för att skapa två separata transgena An. gambiae-linjer genom PiggyBac transformation8: en förarlinje som bär GAL4 som drivs av en midgutspecifik promotor och en responderlinje som innehåller både luciferas och förbättrade gula fluorescerande proteingener (eYFP) under reglering av UAS-sekvenser. Gut specifika luciferas aktivitet och fluorescens i avkomman anges att systemet var effektivt i Anopheles. Sedan dess har förarlinjer skapats som uttrycker transgener i andra vävnader som är viktiga för vektorkapacitet och insekticidbeständighet, inklusive äggocyter15 och hemocyter16, och i ett nära allestädes närvarande mönster10. Många UAS linjer har också genererats för att analysera gener som tros vara inblandade i metabolism och bindning medierad insekticid resistens, cuticular kolväte syntes och att fluorescerande märka olika cell- och vävnadstyper (tabell 1). För responderlinjerna utförs platsstyrd integration av transgenen nu av ΦC31 katalyserad rekombinationskassettutbyte17,18 för att fixa det genomiska sammanhanget för de UAS-reglerade generna. På detta sätt normaliseras transgene uttryck när det gäller genomisk insättning plats, vilket möjliggör mer exakt jämförelse av de fenotypiska effekterna av olika kandidat gener.
De svarande linjer som skapats hittills är utformade för att antingen uttrycka transgen antingen på förhöjda nivåer eller för att minska genuttrycket genom RNA-interferens (RNAi). Vanligtvis cDNA kloner smälts till UAS sekvensen för att generera lämpliga uttryck plasmider, men full genomiska sekvenser är också genomförbara förutsatt att de inte är för stora för kloning. För att generera ljuddämpningskonstruktioner har vi använt tre olika metoder för att få lämpliga tandem inverterade sekvenser som bildar hårnålsdsRNA som stimulerar RNAi. Dessa har inkluderat fusion PCR, asymmetrisk PCR och kommersiell syntes av hårnål konstruktioner. Gemensamt för varje metod är införandet av en intronsekvens mellan de inverterade sekvenserna för att ge kloningsstabilitet. Responderplasmider i vilka en gen av intresse/RNAi konstruktion kan sättas in har utvecklats15. Dessa plasmider bär också de nödvändiga ΦC31 attB-platserna för RMCE (beskrivs i Adolfi medföljande JoVE-papper som beskriver RCME-tekniken i detalj). Protokoll som täcker de viktiga steg som krävs vid val av sekvens för införande i en av dessa plasmider för överuttryck ingår i detta manuskript. Dessutom beskrivs och illustreras två protokoll för RNAi hårnål konstruktion skapande.
När man skapar nya linjer är identifiering av sällsynta transgena individer avgörande att odla från för att etablera och upprätthålla transgena kolonier. Viktigast av allt för GAL4-UAS-systemet är det nödvändigt att skilja responder- och förarlinjerna för att upprätta kors och identifiera enskilda avkomlingar som bär båda transgenerna. Detta uppnås genom att använda olika dominerande valbara markörgener kopplade till drivrutins- och svarande kassetter. Oftast är dessa fluorescerande markörgener som är tydligt urskiljbara med optiska filter (t.ex. eYFP, eCFP, dsRed). Det är viktigt att markörer uttrycks i ett känt och tillförlitligt spatiotemporal mönster eftersom detta gör identifiering av avvikelser och förorening lättare. Fluorescerande markör genuttryck regleras rutinmässigt av den syntetiska 3xP3 promotorn, vilket orsakar öga och ventrala ganglier specifika uttryck i alla stadier av An. gambiae utveckling19. Fluorescerande markörer som styrs av 3xP3 ingår i alla omvandlingsplasmider som beskrivs i denna artikel. Ett protokoll som beskriver de vanliga metoderna som används för att screena fluorescerande An. gambiae pupae GAL4-UAS linjer ingår här.
En av de viktigaste delarna i GAL4-UAS-systemet är behovet av att korsa de differentiellt markerade förar- och svarandelinjerna. För att göra detta måste hane och kvinnor från varje linje separeras före parning. Vuxna kan dock lätt urskiljas genom syn, men för att upprätta genetiska kors är det klokt att separera könen före vuxenuppkomsten för att säkerställa att parning inte har skett. Den allmänna storleksskillnaden mellan manligt och kvinnligt An. gambiae pupae är för varierande för att vara en effektiv och pålitlig metod för könsbestämning20. Istället ger tydliga morfologiska skillnader i de yttre könsorganen en tillförlitlig grund för sexing i An. gambiae. I den här artikeln beskriver vi en pålitlig metod för sexing An. gambiae pupae för att ställa in lämpliga kors.
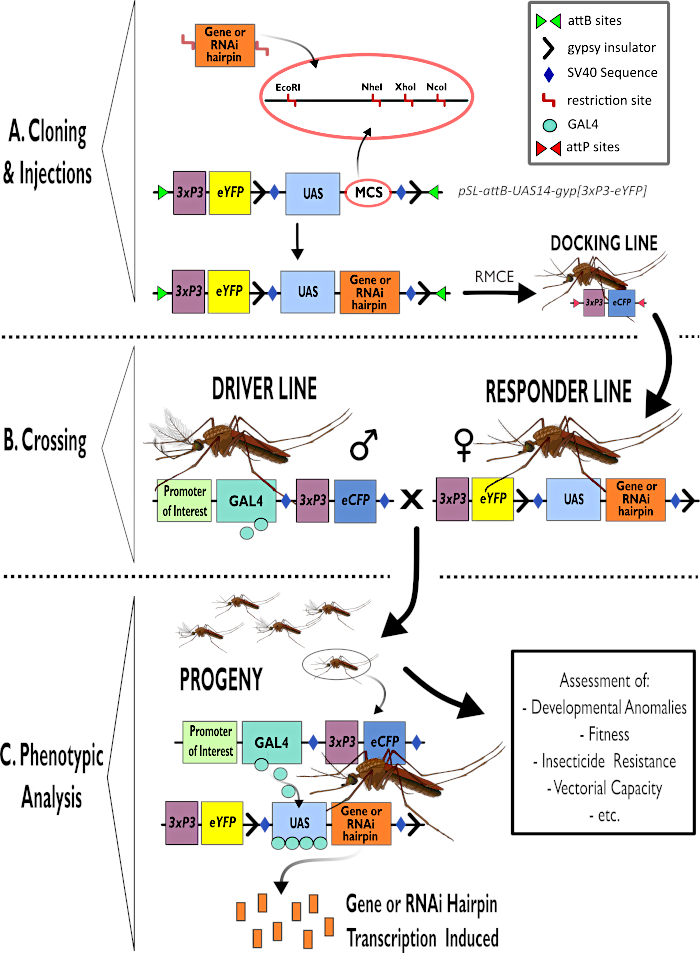
Figur 1 – Diagrammatisk framställning av processen för användning av tvåparts-GAL4-UAS-systemet i Anopheles gambiae. (A) Huvudkomponenterna i en exempelvektor (pSL-attB-UAS14-gyp[3xp3-eYFP]) avbildas och beskriver tillgängliga begränsningsplatser (EcoRI, NheI, XhoI och NcoI) inom de flera kloningsplatser som är lämpliga för användning för att sätta in hårnålskonstruktionen eller kodningssekvensen för den av intressegenen. Dockningslinjens struktur avbildas också. (B) Gränssteget illustreras som anger användningen av hanar från förarlinjen (som transporterar GAL4-föraren av en initiativtagare av intresse och eCFP som drivs av 3xP3-promotorn) och kvinnor från den svarande linjen (som bär den gen av intresse eller hårnålskonstruktion som kontrolleras av en UAS-promotor och en eYFP-markör som kontrolleras av 3xP3-promotorn). C) En diagrammatisk framställning av GAL4 drivande uttryck av genen av intresse för avkomman av korset i B och en lista över några av de typiska fenotyper som bedöms. Förkortningar: Multiple Cloning Site (MCS), Recombinase medierat kassettutbyte (RMCE), Upstream Activator Sequence (UAS), förbättrat gult fluorescerande protein (eYFP), förbättrat cyan fluorescerande protein (eCFP). Klicka här för att se en större version av den här figuren.
Det är användningen av kors som ger GAL4-UAS-systemets tvåpartskaraktär, som har tydliga fördelar jämfört med mer linjära metoder. Till exempel kan många fler kombinationer av förar- och svarande linjer bedömas än vad som skulle vara möjligt om en ny transgen linje måste genereras och bibehållas för varje promotor/genkombination. Ännu viktigare är att det tillåter analys av gener som producerar dödliga eller sterila fenotyper när deras uttryck är stört som är svåra att skapa /underhålla i ett linjärt system. Sådana dödliga fenotyper kan manifestera sig i alla utvecklingsstadier, beroende på genfunktionen och spatiotemporal uttryck, men observeras oftast under embryonal utveckling. Visualisering av myggembryonutveckling kräver att man rensar den ogenomskinliga chorion som täcker äggen. Efter metoder som beskrivs i Trpiš (1970)21 och Kaiser et al. (2014)22 beskriver vi de protokoll vi använder för att fixa embryon, samtidigt som den strukturella integriteten upprätthålls och blekning för att rensa endochorion som möjliggör mikroskopisk visualisering och avbildning.
Protocol
Representative Results
Discussion
Att förstå mygggenfunktionen är avgörande för att utveckla nya metoder för att kontrollera Anopheles och påverka malariaöverföringen. GAL4-UAS-systemet som beskrivs är ett mångsidigt och kraftfullt system för funktionell analys av kandidatgener och hittills har vi använt systemet för att undersöka den genetiska grunden för insekticidresistens17 och cuticular kolväteproduktion15,23, samt för att fluorescerande märka olika myggcellspopulationer8<sup class="xref…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Vi erkänner tacksamt finansiering från LSTM och IVCC (Adriana Adolfi), BBSRC (New Investigator Award (AL), MRC (doktorandtjänst till BCP:MR/P016197/1), Wellcome (Sir Henry Wellcome Postdoktoral gemenskap till LG: 215894/Z/19/Z) som har införlivat Gal4UAS-analysen i förslagen.
Materials
| 100 x 15 mm plastic Petri dish | SLS | 2175546 | Pack of 10 |
| 1000 µL Gilson Pipette | Gilson | F144059P | |
| 20/25 mL Universal Tubes | Starlab | E1412-3020 | Pack of 400 |
| 3 mL Pasteur Pipettes | SLS | G612398 | Greiner Pasteur pipette 3 mL sterile individually wrapped |
| 50 mL Falcon Tubes | Fisher Scientific | 11512303 | |
| Absolute Ethanol | Fisher Scientific | BP2818-500 | 500 mL |
| Acetic Acid | SLS | 45726-1L-F | 1 L |
| Cages | SLS | E6099 | 30x30x30 with screen port |
| Fine Paint Brushes | Amazon | UKDPB66 | KOLAMOON 9 Pieces Detail Painting Brush Set Miniture Brushes for Watercolor, Acrylic Painting, Oil Painting (Wine Red) |
| Fish food | Amazon | Tetra Min Fish Food, Complete Food for All Tropical Fish for Health, Colour and Vitality, 10 L | |
| Formaldehyde Solution | Sigma Aldrich | F8775 | |
| Mouth Aspirator | John Hock | 612 | |
| Pond Salt | Amazon | Blagdon Guardian Pond Tonic Salt, for Fish Health, Water Quality, General Tonic, pH Buffer, 9.08 kg, treats 9,092 L | |
| Pupae Pots | Cater4you | SP8OZ | 250 pots with lids |
| Small Plastic Buckets | Amazon | 2.5 L White Plastic Pail Complete with White Lid (Pack of 10) | |
| Sodium Hypochlorite | Fisher Scientific | S25552 |
References
- Brand, A. H., Perimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Duffy, J. B. GAL4 system in drosophila: A fly geneticist’s swiss army knife. Journal of Genetics and Development. 34 (1-2), 1-15 (2002).
- Dow, J. A. . ELS. , (2012).
- Edi, C. V., et al. CYP6 P450 Enzymes and ACE-1 Duplication Produce Extreme and Multiple Insecticide Resistance in the Malaria Mosquito Anopheles gambiae. PLoS Genetics. 10 (3), 1004236 (2014).
- Daborn, P. J., et al. Using Drosophila melanogaster to validate metabolism-based insecticide resistance from insect pests. Insect Biochemistry and Molecular Biology. 42 (12), 918-924 (2012).
- Riveron, J. M., et al. Genome-wide transcription and functional analyses reveal heterogeneous molecular mechanisms driving pyrethroids resistance in the major malaria vector Anopheles funestus across Africa. Genes Genomes Genetics. 7 (6), 1819-1832 (2017).
- Riveron, J. M., et al. A single mutation in the GSTe2 gene allows tracking of metabolically based insecticide resistance in a major malaria vector. Genome Biology. 15 (2), (2014).
- Lynd, A., Lycett, G. J. Development of the Bi-Partite Gal4-UAS System in the African Malaria Mosquito, Anopheles gambiae. PLoS ONE. 7 (2), 31552 (2012).
- Lynd, A., Lycett, G. J. Optimization of the Gal4-UAS system in an Anopheles gambiae cell line. Insect Molecular Biology. 20 (5), 599-608 (2011).
- Adolfi, A., Pondeville, E., Lynd, A., Bourgouin, C., Lycett, G. J. Multi-tissue GAL4-mediated gene expression in all Anopheles gambiae life stages using an endogenous polyubiquitin promoter. Insect Biochemistry and Molecular Biology. 96, 1-9 (2018).
- Kokoza, V. A., Raikhel, A. A. Targeted gene expression in the transgenic Aedes aegypti using the binary Gal4-UAS system. Insect Biochemistry and Molecular Biology. 41, 637-644 (2011).
- O’Brochta, D. A., Pilitt, K. L., Harrell, R. A., Aluvihare, C., Alford, R. T. Gal4-based Enhancer-Trapping in the Malaria Mosquito Anopheles stephensi. Genes Genomes Genetics. 2, 21305-21315 (2012).
- Zhao, B., et al. Regulation of the Gut-Specific Carboxypeptidase: A Study Using the Binary Gal4/UAS System in the Mosquito Aedes Aegypti. Insect Biochemistry and Molecular Biology. 54, 1-10 (2014).
- Imamura, M., et al. Targeted Gene Expression Using the GAL4/UAS System in the Silkworm Bombyx mori. Genetics. 165 (3), 1329-1340 (2003).
- Lynd, A., et al. Development of a functional genetic tool for Anopheles gambiae oenocyte characterisation: application to cuticular hydrocarbon synthesis. bioRxiv. , (2019).
- Pondeville, E., et al. Hemocyte-targeted gene expression in the female malaria mosquito using the hemolectin promoter from Drosophila. Insect Biochemistry and Molecular Biology. 120, 103339 (2020).
- Adolfi, A., et al. Functional genetic validation of key genes conferring insecticide resistance in the major African malaria vector, Anopheles gambiae. Proceedings of the National Academy of Sciences of the United States of America. 116 (51), 25764-25772 (2019).
- Pondeville, E., et al. Efficient integrase-mediated site-specific germline transformation of Anopheles gambiae. Nature Protocols. 9 (7), 1698-1712 (2014).
- Horn, C., Schmid, B. G. M., Pogoda, F. S., Wimmer, E. A. Fluorescent transformation markers for insect transgenesis. Insect Biochemistry and Molecular Biology. 32, 1221-1235 (2002).
- Clements, A. . A. Biology of Mosquitoes, Volume 1: Development, Nutrition and Reproduction. 1, (1992).
- Trpiš, M. A new bleaching and decalcifying method for general use in zoology. Canadian Journal of Zoology. 48, 892-893 (1970).
- Kaiser, M. L., Duncan, F. D., Brooke, B. D. Embryonic Development and Rates of Metabolic Activity in Early and Late Hatching Eggs of the Major Malaria Vector Anopheles gambiae. PLoS ONE. 9 (12), 114381 (2014).
- Grigoraki, L., Grau-Bové, X., Yates, H. C., Lycett, G. J., Ranson, H. Isolation and transcriptomic analysis of Anopheles gambiae oenocytes enables the delineation of hydrocarbon biosynthesis. eLife. 9, 58019 (2020).
- Xiao, Y. -. H., Yin, M. -. H., Hou, L., Pei, Y. Direct amplification of intron-containing hairpin RNA construct from genomic DNA. BioTechniques. 41 (5), 548-552 (2006).
- Livak, K. J. Organization and Mapping of a Sequence on the Drosophila melanogaster X and Y Chromosomes That Is Transcribed during Spermatogenesis. Genetics. 107 (4), 611-634 (1984).
- MR4, CDC, NEI & beiResources. . The MR4 Methods in Anopheles Research Laboratory Manual. 5th Edition. , (2015).
- Sik Lee, Y., Carthew, R. W. Making a better RNAi vector for Drosophila: use of intron spacers. Methods. 30 (4), 322-329 (2003).
- Cha-aim, K., Hoshida, H., Fukunaga, T., Akada, R., Peccoud, J. . Gene Synthesis: Methods and Protocols. , 97-110 (2012).
- Cavener, D. R. Comparison of the consensus sequence flanking translational start sites in Drosophila and vertebrates. Nucleic Acids Research. 15 (4), 1353-1361 (1987).
- Wang, Y., Wang, F., Wang, R., Zhao, P., Xia, Q. 2A self-cleaving peptide-based multi-gene expression system in the silkworm Bombyx mori. Scientific Reports. 5, (2015).
- Galizi, R., et al. A synthetic sex ratio distortion system for the control of the human malaria mosquito. Nature Communications. 5, 3977 (2014).
- Kondo, S., et al. Neurochemical organisation of the Drosophila Brain Visualised by Endogenously Tagged Neurotransmitter Receptors. Cell Reports. 30 (1), 284-297 (2020).
- Lee, P. -. T., et al. A gene-specific T2A-GAL4 library for Drosophila. eLife. 7, 35574 (2018).
- Marois, E., et al. High-throughput sorting of mosquito larvae for laboratory studies and for future vector control interventions. Malaria Journal. 11, 302 (2012).
- Crawford, J. E., et al. Efficient production of male Wolbachia-infected Aedes aegypti mosquitoes enables large-scale suppression of wild populations. Nature Biotechnology. 38 (4), 482-492 (2020).
- Goltsev, Y., et al. Developmental and evolutionary basis for drought tolerance of the Anopheles gambiae embryo. Developmental Biology. 330 (2), 462-470 (2009).
- Rezende, G. L., et al. Embryonic desiccation resistance in Aedes aegypti: presumptive role of the chitinized Serosal Cuticle. BMC Developmental Biology. 8 (1), 82 (2008).
- Vargas, H. C. M., Farnesi, L. C., Martins, A. J., Valle, D., Rezende, G. L. Serosal cuticle formation and distinct degrees of desiccation resistance in embryos of the mosquito vectors Aedes aegypti, Anopheles aquasalis and Culex quinquefasciatus. Journal of Insect Physiology. 62, 54-60 (2014).
- Chang, C. -. H., et al. The non-canonical Notch signaling is essential for the control of fertility in Aedes aegypti. PLOS Neglected Tropical Diseases. 12 (3), 0006307 (2018).
- Clemons, A., Flannery, E., Kast, K., Severson, D., Duman-Scheel, M. Immunohistochemical Analysis of Protein Expression during Aedes aegypti Development. Spring Harbor Protocols. 10, 1-4 (2010).
- Juhn, J., James, A. A. Hybridization in situ of Salivary Glands, Ovaries and Embryos of Vector Mosquitoes. Journal of Visualized Experiments. , e3709 (2012).

