ROS Live Cell Imaging tijdens neuronale ontwikkeling
Summary
Dit protocol beschrijft het gebruik van een genetisch gecodeerd waterstofperoxide (H2O2)-biosensor in gekweekte zebravisneuronen en larven voor het beoordelen van de fysiologische signaleringsrollen van H2O2 tijdens de ontwikkeling van het zenuwstelsel. Het kan worden toegepast op verschillende celtypen en worden aangepast met experimentele behandelingen om reactieve zuurstofsoorten (ROS) in de algemene ontwikkeling te bestuderen.
Abstract
Reactieve zuurstofsoorten (ROS) zijn gevestigde signaalmoleculen, die belangrijk zijn in de normale ontwikkeling, homeostase en fysiologie. Onder de verschillende ROS wordt waterstofperoxide (H2O2) het best gekarakteriseerd met betrekking tot rollen in cellulaire signalering. H2O2 is betrokken geweest bij de ontwikkeling van verschillende soorten. Zo is in de eerste dagen na de bevruchting een voorbijgaande toename vanH2 O2 waargenomen bij zebravisembryo’s. Bovendien, het uitputten van een belangrijke cellulaire H2O2 bron, NADPH oxidase (NOX), vermindert de ontwikkeling van het zenuwstelsel, zoals de differentiatie, axonale groei, en begeleiding van retinale ganglioncellen (RGCs) zowel in vivo als in vitro. Hier beschrijven we een methode voor beeldvorming van intracellulaire H2O2-niveaus in gekweekte zebravisneuronen en hele larven tijdens de ontwikkeling met behulp van de genetisch gecodeerde H2O2-specifiekebiosensor, roGFP2-Orp1. Deze sonde kan tijdelijk of stabiel worden uitgedrukt in zebravislarven. Bovendien vermindert de ratiometrische uitlezing de kans op het detecteren van artefacten als gevolg van differentiële genexpressie of volume-effecten. Ten eerste laten we zien hoe we RGC’s kunnen isoleren en kweeken die zijn afgeleid van zebravisembryo’s die roGFP2-Orp1 tijdelijk uitdrukken. Vervolgens gebruiken we hele larven om H 2O 2-niveausop weefselniveau te controleren. De sensor is gevalideerd door de toevoeging van H2O2. Bovendien zou deze methode kunnen worden gebruikt om H 2 O2-niveausin specifieke celtypen en weefsels te meten door transgene dieren te genereren met weefselspecifieke biosensorexpressie. Aangezien zebravissen genetische en ontwikkelingsmanipulaties vergemakkelijken, zou de hier aangetoonde aanpak kunnen dienen als een pijplijn om de rol van H2O2 tijdens neuronale en algemene embryonale ontwikkeling bij gewervelde dieren te testen.
Introduction
Reactive oxygen species (ROS) signalering reguleert de ontwikkeling en werking van het zenuwstelsel1. Een belangrijke cellulaire ROS-bron zijn NADPH-oxidasen (NOX), transmembrane-eiwitten die superoxide en waterstofperoxide genereren (H2O2)2. NOX-enzymen worden gevonden in het centrale zenuwstelsel (CZS) en NOX-afgeleide ROS dragen bij aan neuronale ontwikkeling3,4,5,6. Onderhoud en differentiatie van neurale stamcellen, het vaststellen van neuronale polariteit, neurietuitgroei en synaptische plasticiteit hebben voldoende ros7,8,9,10,11nodig . Aan de andere kant draagt ongecontroleerde productie van ROS door NOXen bij aan neurodegeneratieve aandoeningen, waaronder de ziekte van Alzheimer, multiple sclerose en traumatisch hersenletsel12,13,14. Daarom is de productie van fysiologisch relevante ROS van cruciaal belang voor het behoud van gezonde omstandigheden.
De ontwikkeling van genetisch gecodeerde biosensoren vergemakkelijkte de detectie van cellulaire ROS aanzienlijk. Een belangrijk voordeel van genetisch gecodeerde biosensoren is de verhoogde temporele en ruimtelijke resolutie van het ROS-signaal, omdat deze sensoren specifiek op verschillende locaties kunnen worden gericht. Redox-gevoelige GFP (roGFP) is een type van dergelijke ROS-biosensoren. De roGFP2-Orp1-variant detecteert specifiek H2O2 via zijn Orp1-domein, een glutathion peroxiredoxinefamilie-eiwit uit gist15,16. De oxidatie van het Orp1-eiwit wordt overgebracht naar roGFP2 om de conformatie ervan te wijzigen (figuur 1A). De sonde vertoont twee excitatiepieken in de buurt van 405 nm en 480 nm en een enkele emissiepiek bij 515 nm. Bij oxidatie verandert de fluorescentie-intensiteit rond excitatiepieken: terwijl 405 nm excitatie toeneemt, neemt 480 nm excitatie af. RoGFP2-Orp1 is dus een ratiometrische biosensor en H2O2-niveaus worden gedetecteerd door de verhouding van fluorescentieintensiteiten opgewekt op twee verschillende golflengten (Figuur 1B). Over het algemeen is roGFP2-Orp1 een veelzijdig hulpmiddel voor ROS-beeldvorming dat efficiënt in vivokan worden gebruikt.
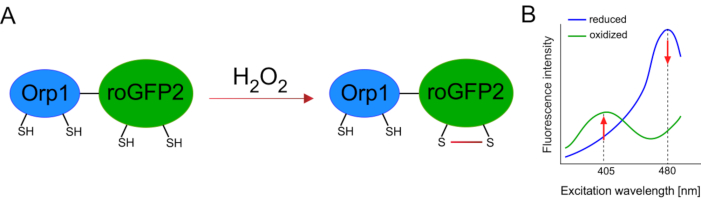
Figuur 1: Schematische representatie en excitatiespectra van roGFP2-Orp1. (A) Oxidant transfer vindt plaats tussen Orp1 en roGFP2 als reactie op H2O2, wat leidt tot conformationele veranderingen in roGFP2. (B) De excitatiespectra van de roGFP2-Orp1 vertoont twee excitatiepieken bij 405 nm en 480 nm en enkele emissiepiek bij 515 nm. Bij oxidatie door H2O2neemt de excitatie van 405 nm toe terwijl de excitatie van 480 nm afneemt. Dit resulteert in een ratiometrische uitlezing voor H2O2 aanwezigheid. Het cijfer is gewijzigd van Bilan en Belousov (2017)16 en Morgan et al. (2011)25. Klik hier om een grotere versie van deze afbeelding te bekijken.
Het Danio rerio (zebravis) modelsysteem heeft verschillende voordelen voor het toepassen van genetisch gecodeerde biosensoren. De optische transparantie van de embryo’s en larven maakt niet-invasieve in vivo beeldvorming mogelijk. Er worden nieuwe beeldvormingstools ontwikkeld om een hogere resolutie en diepere penetratie te bereiken17. Verder zijn er gevestigde instrumenten voor genetische manipulatie (ectopische mRNA-expressie, Tol2-transgenese, enz.) en genoombewerking (TALEN’s, CRISPR/Cas9, enz.), die de generatie van transgene dierenbevordert 18. Naarmate de zebravisembryo’s zich buiten de moeder ontwikkelen, maakt dit systeem verder gemakkelijkere toegang tot en manipulatie van de embryo’s mogelijk. Bijvoorbeeld, eencellige stadium injecties en medicamenteuze behandelingen kunnen gemakkelijk worden gedaan.
Hier gebruikten we zebravissen om de H 2O2-specifiekebiosensor roGFP2-Orp1 tijdelijk uit te drukken door in vitro getranscribeerd mRNA te injecteren. Deze embryo’s kunnen worden gebruikt voor zowel in vitro beeldvorming van gekweekte neuronen als in vivo beeldvorming (figuur 2). We beschrijven een protocol voor het ontleden en plateren van retinale ganglioncellen (RGCs) uit zebravisembryo’s, gevolgd door het beoordelen van H2O2-niveaus in gekweekte neuronen. Vervolgens presenteren we een methode voor in vivo beeldvorming van roGFP2-Orp1-uitdrukkende embryo’s en larven met behulp van confocale microscopie. Deze aanpak maakt het niet alleen mogelijk om fysiologische H2O2-niveauste bepalen, maar ook potentiële veranderingen die optreden in verschillende ontwikkelingsstadia of omstandigheden. Over het algemeen biedt dit systeem een betrouwbare methode voor het detecteren van H2O2 in levende cellen en dieren om de rol van H2O2 in ontwikkeling, gezondheid en ziekte te bestuderen.
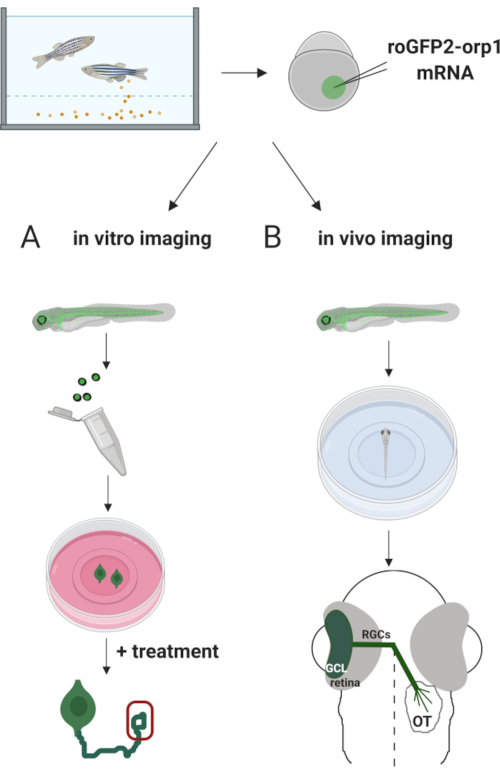
Figuur 2. Schets van de experimentele aanpak. Kort na het verzamelen van embryo’s wordt roGFP2-Orp1 mRNA geïnjecteerd in de dooier van zebravisembryo’s in één celstadium. Het ontwikkelen van embryo’s kan worden gebruikt voor zowel (A) in vitro als (B) in vivo beeldvorming. (A) GFP-positieve embryo’s worden gebruikt om netvlies te ontleden voor RGC-verzameling bij 34 hpf. Gedissocieerde RGCs worden geplateerd op PDL/laminine-gecoate coverslips in ZFCM (+) media. Groeikegelbeeldvorming kan worden uitgevoerd terwijl RGC’s hun axonen verlengen na 6-24 uur plateren. Cellen kunnen worden onderworpen aan verschillende behandelingen om de potentiële veranderingen in H 2 O2-niveauste meten. Hier hebben we H 2 O2-niveausgemeten in de groeikegels van RGCs (rood). (B) GFP-positieve embryo’s worden gebruikt voor in vivo beeldvorming. Op de gewenste leeftijd kunnen embryo’s worden verdoofd en gemonteerd op glazen bodemschalen van 35 mm voor confocale beeldvorming. Hier worden embryo’s ventrally gemonteerd voor retinale beeldvorming. Schematisch toont retinale ontwikkeling bij zebravissen. RGCs vormen ganglioncellaag (GCL), de binnenste laag in het netvlies. RGC axonen ontwikkelen zich tot oogzenuw om de middellijn te kruisen en vormen optisch chiasme. Vervolgens groeien RGC axonen dorsaal om synapsen te maken in het optische tectum in de middenhersenen. Klik hier om een grotere versie van deze afbeelding te bekijken.
Protocol
Representative Results
Discussion
Er zijn verschillende kritieke stappen die aandacht nodig hebben in dit protocol. Wij zijn van mening dat het overwegen van deze punten de experimentele stroom zal verbeteren. Voor primaire RGC-cultuur is de steriliteit van de ZFCM(-) erg belangrijk, omdat dit kweekmedium geen antibiotica bevat en besmetting voor of tijdens beeldvorming kan optreden. Om dit te voorkomen, adviseren wij om ZFCM(-) alleen in een bioveiligheidskast te bereiden en te gebruiken en regelmatig verse ZFCM(-) media te maken (stap 1.5). Bovendien m…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dit werk werd ondersteund door de National Institutes of Health (Grant R01NS117701), National Science Foundation (Grant 1146944-IOS), het Indiana Traumatic Spinal Cord and Brain Injury Research Fund (Grant 20000289), de Purdue Research Foundation (Grant 209911) en het Office of the Executive Vice President for Research and Partnerships aan purdue University (Grant 210362). We danken Dr. Cory J. Weaver en Haley Roeder voor het opstellen van het zebravis RGC cultuurprotocol. We danken Haley Roeder bovendien voor het verstrekken van de gegevens van figuur 4. We danken Leah Biasi en Kenny Nguyen voor de hulp bij de RGC-cultuur. We danken Gentry Lee voor het bewerken van de tekst. We danken Dr. Tobias Dick voor het leveren van roGFP2-Orp1 en Dr. Qing Deng voor pCS2+ vector met roGFP2-Orp1. Figuur 2 is gemaakt met Biorender.com.
Materials
| 35-mm culture dish | Sarstedt | 83-3900 | |
| 35-mm glass bottom dish | MatTek | P35G-1.5-10-C | |
| Agarose | Fisher Scientific | BP160-500 | |
| Borosilicate Glass Capillary Tubes | Sutter/Fisher Scientific | NC9029378 | |
| Calcium Chloride Dihydrate | Fisher Scientific | C79-500 | |
| Cover glass | Corning | 2850-22 | |
| Disposable Petri Dishes (100 x 15 mm) | VWR | 25384-094 | |
| Fetal Bovine Serum | ThermoFisher Scientific | 26140087 | |
| Glucose | Sigma Aldich | G7528 | |
| HEPES | Sigma Aldich | H4034 | |
| Injection Mold | Adaptive Science Tools | TU-1 | |
| Inverted Microscope | Nikon | TE2000 | |
| Laminin | ThermoFisher Scientific | 23017-015 | |
| Laser Scanning Confocal Microscopy | Zeiss | 710 | |
| Leibovitz's L-15 Medium with phenol red | Gibco/Fisher Scientific | 11-415-064 | |
| Leibovitz's L-15 Medium without phenol red | Gibco/Fisher Scientific | 21-083-027 | |
| Low melting agarose | Promega | V2111 | |
| mMessage mMachine SP6 Transcription Kit | Invitrogen | AM1340 | |
| NotI | New England Biolabs | R0189S | |
| PBS | Hyclone/Fisher Scientific | SH3025601 | |
| Penicillin/streptomycin | ThermoFisher Scientific | 15140122 | |
| Phenol Red | Sigma Aldich | P0290 | |
| Phenylthiourea (PTU) | Sigma Aldich | P7629 | |
| Pneumatic PicoPump | World Precision Instruments | PV820 | |
| Poly-D-Lysine (PDL) | Sigma Aldich | P7280 | |
| QiaQUICK PCR Purification Kit | QIAGEN | 28104 | |
| Recombinant mouse slit2 | R&D Systems | 5444-SL-050 | |
| Sodium Pyruvate | Sigma Aldich | P5280 | |
| Steritop 0.22 µm filter | Millipore | S2GPT05RE | |
| TE Buffer | Ambion | AM9860 | |
| Tricaine Methanesulfonate | Sigma Aldich | E10521 | |
| Vertical Pipette Puller | David Kopf Instruments | 700C |
References
- Bórquez, D. A., et al. Dissecting the role of redox signaling in neuronal development. Journal of Neurochemistry. 137 (4), 506-517 (2016).
- Bedard, K., Krause, K. -. H. The NOX family of ROS-generating NADPH oxidases: Physiology and pathophysiology. Physiological Reviews. 87 (1), 245-313 (2007).
- Weaver, C. J., Leung, Y. F., Suter, D. M. Expression dynamics of NADPH oxidases during early zebrafish development. Journal of Comparative Neurology. 524 (10), 2130-2141 (2016).
- Terzi, A., Suter, D. M. The role of NADPH oxidases in neuronal development. Free Radical Biology and Medicine. 154, 33-47 (2020).
- Infanger, D. W., Sharma, R. V., Davisson, R. L. NADPH oxidases of the brain: Distribution, regulation, and function. Antioxidants & Redox Signaling. 8 (9-10), 1583-1596 (2006).
- Coyoy, A., Olguin-Albuerne, M., Martinez-Briseno, P., Moran, J. Role of reactive oxygen species and NADPH-oxidase in the development of rat cerebellum. Neurochemistry International. 62 (7), 998-1011 (2013).
- Le Belle, J. E., et al. Proliferative neural stem cells have high endogenous ROS levels that regulate self-renewal and neurogenesis in a PI3K/Akt-dependant manner. Cell Stem Cell. 8 (1), 59-71 (2011).
- Nayernia, Z., et al. Decreased neural precursor cell pool in NADPH oxidase 2-deficiency: from mouse brain to neural differentiation of patient derived iPSC. Redox Biology. 13, 82-93 (2017).
- Wilson, C., Nunez, M. T., González-Billault, C. Contribution of NADPH oxidase to the establishment of hippocampal neuronal polarity in culture. Journal of Cell Science. 128 (16), 2989-2995 (2015).
- Munnamalai, V., et al. Bidirectional interactions between Nox2-type NADPH oxidase and the F-actin cytoskeleton in neuronal growth cones. Journal of Neurochemistry. 130 (4), 526-540 (2014).
- Kishida, K. T., et al. Synaptic plasticity deficits and mild memory impairments in mouse models of chronic granulomatous disease. Molecular and Cellular Biology. 26 (15), 5908-5920 (2006).
- Ravelli, K. G., et al. Nox2-dependent neuroinflammation in an EAE model of multiple sclerosis. Translational Neuroscience. 10 (1), 1-9 (2019).
- Park, L., et al. Nox2-derived radicals contribute to neurovascular and behavioral dysfunction in mice overexpressing the amyloid precursor protein. Proceedings of the National Academy of Sciences. 105 (4), 1347-1352 (2008).
- Schiavone, S., Neri, M., Trabace, L., Turillazzi, E. The NADPH oxidase NOX2 mediates loss of parvalbumin interneurons in traumatic brain injury: Human autoptic immunohistochemical evidence. Scientific Reports. 7 (1), 8752 (2017).
- Gutscher, M., et al. Proximity-based protein thiol oxidation by H2O2-scavenging peroxidases. Journal of Biological Chemistry. 284 (46), 31532-31540 (2009).
- Bilan, D. S., Belousov, V. V. New tools for redox biology: from imaging to manipulation. Free Radical Biology and Medicine. 109, 167-188 (2016).
- Abu-Siniyeh, A., Al-Zyoud, W. Highlights on selected microscopy techniques to study zebrafish developmental biology. Laboratory Animal Research. 36 (1), 12 (2020).
- Sassen, W. A., Koster, R. W. A molecular toolbox for genetic manipulation of zebrafish. Advances in Genomics and Genetics. 5, 151-163 (2015).
- Rosen, J. N., Sweeney, M. F., Mably, J. D. Microinjection of zebrafish embryos to analyze gene function. Journal of Visualized Experiments. (25), e1115 (2009).
- Avdesh, A., et al. Regular care and maintenance of a Zebrafish (Danio rerio) laboratory: An introduction. Journal of Visualized Experiments. (69), e4196 (2012).
- Chen, Z., et al. Primary neuron culture for nerve growth and axon guidance studies in Zebrafish (Danio rerio). PLoS One. 8 (3), 57539 (2013).
- Zhang, L., Leung, Y. F. Microdissection of zebrafish embryonic eye tissues. Journal of Visualized Experiments. (40), e2028 (2010).
- Suter, D. M. Live cell imaging of neuronal growth cone motility and duidance in vitro. Cell Migration: Methods in Molecular Biology. , 65-86 (2011).
- Weaver, C. J., et al. nox2/cybb deficiency affects zebrafish retinotectal connectivity. Journal of Neuroscience. 38 (26), 5854-5871 (2018).
- Morgan, B., Sobotta, M. C., Dick, T. P. Measuring EGSH and H2O2 with roGFP2-based redox probes. Free Radical Biology and Medicine. 51, 1943-1951 (2011).
- Li, Z., et al. Phenylthiourea specifically reduces zebrafish eye size. PLoS One. 7 (6), 40132 (2012).
- Ermakova, Y. G., et al. Red fluorescent genetically encoded indicator for intracellular hydrogen peroxide. Nature Communications. 5, 5222 (2014).
- Oparka, M., et al. Quantifying ROS levels using CM-H2DCFDA and HyPer. Methods. 109, 3-11 (2016).
- Dickinson, B. C., Peltier, J., Stone, D., Schaffer, D. V., Chang, C. J. Nox2 redox signaling maintains essential cell populations in the brain. Nature Chemical Biology. 7 (2), 106-112 (2011).
- Cannon, M. B., Remington, S. J. Redox-sensitive green fluorescent protein: Probes for dynamic intracellular redox responses. A review. Methods in Molecular Biology. 476, 51-65 (2009).
- Meyer, A. J., Dick, T. P. Fluorescent protein-based redox probes. Antioxidants & Redox Signaling. 13 (5), 621-650 (2010).
- Panieri, E., Millia, C., Santoro, M. M. Real-time quantification of subcellular H2O2 and glutathione redox potential in living cardiovascular tissues. Free Radical Biology and Medicine. 109, 189-200 (2017).
- Breus, O., Dickmeis, T. Genetically encoded thiol redox-sensors in the zebrafish model: Lessons for embryonic development and regeneration. Biological Chemistry. , (2020).
- Morgan, B., et al. Real-time monitoring of basal H2O2 levels with peroxiredoxin-based probes. Nature Chemical Biology. 12 (6), 437-443 (2016).
- Terzi, A., Roeder, H., Weaver, C. J., Suter, D. M. Neuronal NADPH oxidase 2 regulates growth cone guidance downstream of slit2/robo2. Developmental Neurobiology. , (2020).
- Bilan, D. S., Belousov, V. V. HyPer family probes: State of the art. Antioxidants & Redox Signaling. 24 (13), 731-751 (2016).
- Ermankova, Y. G., et al. SypHer3s: a genetically encoded fluorescent ratiometric probe with enhanced brightness and an improved dynamic range. Chemistry Communications. 54 (23), 2898-2901 (2018).
- Pak, V. V., et al. Ultrasensitive genetically encoded indicator for hydrogen peroxide identifies roles for the oxidant in cell migration and mitochondrial function. Cell Metabolism. 31 (3), 642-653 (2020).
- Kwan, K. M., et al. The Tol2kit: A multisite gateway-based construction Kit for Tol2 transposon transgenesis constructs. Developmental Dynamics. 236 (11), 3088-3099 (2007).

