시간 해결 된 극저온 전자 현미경 검사법을 위한 빠른 그리드 준비
Summary
여기에서는 빠른 그리드 제작과 시간 해결 실험을 수행하기 위해 빠른 혼합 및 동결을 위한 신속한 그리드 제작 장치를 사용하기 위한 자세한 프로토콜을 제공합니다.
Abstract
저온 전자 현미경 검사법(cryo-EM) 분야는 새로운 하드웨어 및 처리 알고리즘으로 빠르게 발전하여 더 까다로운 시스템에 대한 고해상도 구조와 정보를 생성하고 있습니다. 저온-EM에 대한 샘플 준비는 기존의 블로팅 시스템을 대체하기 위해 새로운 접근 방식이 개발되면서 유사한 혁명을 겪고 있습니다. 여기에는 압전 전기 디스펜서, 핀 인쇄 및 직접 살포의 사용이 포함됩니다. 이러한 발전의 결과로 그리드 준비 속도는 초에서 밀리초로 이동하여 특히 단백질과 기판이 급락하기 전에 빠르게 혼합될 수 있는 시간 해결 된 냉동 고극 EM 분야에서 짧은 수명 중간 상태를 트래핑하는 새로운 기회를 제공합니다. 여기에서는 표준 빠른 그리드 준비와 시간 해결 실험을 위해 사내 시간 해결 EM 장치에서 그리드를 만들기 위한 표준 프로토콜을 자세히 설명합니다. 이 프로토콜은 4개의 그리드의 제조를 위해 ≥ 2 mg/mL의 농도에서 약 50 μL 샘플을 요구합니다. 샘플 응용 프로그램과 동결 사이의 지연은 10 ms만큼 낮을 수 있습니다. 한 가지 제한은 더 빠른 속도로 얼음 두께가 증가하고 블로팅 방법에 비해 증가한다는 것입니다. 이 프로토콜이 다른 사람들이 자신의 그리드 제작 장치와 시간 해결 된 실험을 설계하는 데 도움이되기를 바랍니다.
Introduction
배경
냉동 전자 현미경 검사법 (극저온-EM)의 최근 개발은 고해상도에서 점점 더 복잡해지는 시스템의 구조 연구를 가능하게했습니다. 몇 가지 예외를 제외하고, 이러한 연구는 평형1 또는 상대적으로 느린 반응2에서생물학적 거대 분자로 제한되었습니다. 생체 내 많은 프로세스는 더 빠른 시간 척도(밀리초)에서 발생하며 이러한 기간3에서시간 해결 된 저온 EM (TrEM)에 대한 관심이 증가하고 있습니다. 그러나, 블로팅 방법에 의한 종래의 극저온-EM 샘플 제제는 밀리초 TrEM에 비해 너무 느립니다.
블로팅 방법은 가난한 시간 해결 외에 다른 제한이 있습니다. 단백질 및 단백질 복합체는 그리드4에서데우레이션 또는 선호하는 방향으로 고통받을 수 있다. 시료 준비 중 공기-물 인터페이스에 대한 노출 시간을 줄이는 것은 바람직한 방향 및 단백질 탈약5,6을완화하는 것으로 나타났다. 따라서 빠른 그리드 준비는 밀리초 TrEM을 가능하게 할 뿐만 아니라 그리드 품질을 향상시킬 수 있습니다.
현재 자동화된 그리드 준비에는 세 가지 접근 방식이 있습니다. 첫 번째 방법은 소량의 샘플을 보유하는 핀 또는 모세관을 사용합니다. 액체와 그리드 표면 사이의 접촉을 설정한 후 샘플은 그리드7,8에‘기록’된다. 샘플 응용 프로그램 프로세스는 비교적 느리고 몇 초 정도 걸립니다. 대체 접근법은 압전 디스펜서와 자기 위킹 그리드9에의해 제어 된 액적 생성을 사용합니다. 이렇게 하면 더 빠른 디스펜스가 시간을 동결할 수 있지만 여전히 액적 및 속지 속도(현재 54ms에 도달)에 의해 제한됩니다. 지금까지 가장 빠른 접근법은 시료가 분무 노즐로 분무되고 작은 (~ 10 – 20 μm) 및 크저온-EM 그리드와 접촉할 때 빠른 (> 5m/s) 방울이 퍼지는 직접 스프레이 접근법입니다. 시료 분무는 에어블라스트 분무기, 표면 음향파 또는 초음파가습기(10,11,12,13)와같은 다양한 방법으로 생성될 수 있다. 우리의 경험에서, 직접 살포 접근 방식과 얼음 두께는 더 크지만 직접 살포는 분배가 10 ms< 시간을 동결 할 수 있습니다.
이 프로토콜은 미세 유체 스프레이 노즐을 장착한 시간 해결 된 EM 장치 (TED)가 빠른 시간 척도14,15에서그리드를 준비하는 데 어떻게 사용될 수 있는지 단계별로 설명합니다. 이 장치는 샘플 응용 프로그램과 동결 사이에 최소 6ms의 지연 시간으로 그리드를 준비하고 두 개의 샘플을 빠르게 혼합하고 동결하는 데 사용되었습니다. TED의 디자인은 이전버전(16)을 기반으로 하며 다른 스프레이 기반 시간 해결 극저온-EM장치(17)와유사하다.
첫째, TED 설정의 네 가지 주요 부분이 설명된다. TED의 핵심은 샘플 포부 및 분배를 담당하는 액체 처리 장치입니다. 공압 플런저는 스프레이를 통해 그리드를 액체 에탄으로 이동합니다. 스프레이의 생성은 미세 유체 스프레이 노즐로 달성되고 동결은 액체 에탄 용기에서 수행되며, 이는 간략하게 설명된다. 마지막으로 그리드 환경, 특히 습도를 제어하는 추가 기능이 강조 표시됩니다. 그 다음에는 장치 작동 및 TrEM 실험을 수행하기 위한 자세한 프로토콜이 뒤따릅니다. 빠른 그리드 준비와 간단한 TrEM 실험을 위한 대표적인 결과가 제공됩니다.
실험 설정
액체 처리 장치
TED의 액체 처리 시스템은 3개의 주사기 구동 펌프(‘펌프 1 – 3’)에 의해 형성되며, 각각 로터리밸브(그림 1)가장착되어 있습니다. 전원 공급 장치는 펌프 1 – 3, 24 V DC를 제공합니다. 제어 소프트웨어와의 통신(비주얼 베이직 및 C++로 작성)은 RS232 인터페이스를 통해 펌프 1을 제공합니다. 명령은 펌프 1에서 펌프 2-3까지 직렬 I/O 확장 포트를 통해 배포됩니다. 펌프 1-3에는 유리 주사기(주사기 1-3′, 250 μL/제로 데드 볼륨 주사기를 사용)가 장착되어 있습니다. 각 밸브에는 ‘로드’와 ‘디스펜스’의 두 위치가 있습니다. ‘부하’ 위치는 샘플을 주사기에 흡인하는 데 사용됩니다. 1/16의 짧은 조각 (~ 3 – 4cm) O.D., 0.01′′ I.D. FEP 튜브는 ETFE /ETFE flangeless 피팅을 통해 밸브 1-3의 ‘로드’ 위치에 연결됩니다. 이 짧은 튜브 조각은 샘플 저장소(일반적으로 1.5mL 또는 0.5mL 플라스틱 튜브)에 도달합니다. ‘디스펜스’ 위치는 스프레이 노즐로 이어집니다. ‘디스펜스’ 콘센트와 스프레이 노즐 의 연결은 PE 튜빙(~ 20-30cm 길이, 0.043″ O.D., 0.015″ I.D.), 소매 튜브(~0.5cm) 및 ETFE/ETFE 플랑지 피팅으로 만들어집니다.
공압 플런저
TED는 공압 플런저를 사용하여 그리드를 가속화하고 샘플 스프레이를 통해 액체 에탄 용기로 이동합니다. 음압 핀셋은 그리드를 잡고, 듀얼 로드 공압 실린더(그림2A)에장착된 홈 내장 홀더에 나사로 고정됩니다.
압력은 다단계 레귤레이터 (0 – 10 bar, ‘주요 압력’)가 장착 된 대형 질소 가스 실린더 (크기 W)에서 공급됩니다. 유연한 강화 PVC 튜브(12mm O.D.)는 레귤레이터를 12포트 매니폴드에 연결하여 가압 질소를 노즐과 공압 플런저로 전달합니다. 노즐을 통과하는 가스 흐름은 일정하며 질소 실린더(main pressure)에서 직접 조절됩니다. 노즐과의 연결은 PU 튜빙(4mm O.D., 2.5mm I.D.), PE 튜빙(~ 8cm 길이, 0.043″ O.D., 0.015″ I.D.) 및 적절한 커넥터로 만들어집니다. 공압 플런저에 대한 압력은 솔레노이드 밸브를 통해 제어됩니다. PU 튜빙(4mm O.D., 2.5mm I.D.)은 솔레노이드 밸브를 레귤레이터 및 공압 플런저와 연결하여 급락 압력(≤ 주 압력)을 줄입니다. 솔레노이드 밸브는 컴퓨터 제어됩니다. 설정에 대한 회로도 개요는 그림 2B에제공됩니다.
이 설정을 사용하면 급락 압력은 항상 분무 가스 압력(주 압력)보다 동일하거나 작습니다. 그러나, 낮은 스프레이 가스 압력에서 더 높은 플런지 속도를 허용하기 위해 스프레이 노즐의 두 번째 레귤레이터 상류를 통합하여 설정을 쉽게 변경할 수 있습니다. 고압(>> 2bar)은 PDMS 스프레이 노즐을 손상시킬 수 있습니다.
주의: 이것은 가압 시스템이며 ‘주요 압력’은 항상 7 bar<되어야합니다.
압력0.5와 2 바 사이의 압력은 일반적으로 공압 플런저에 사용되며 압력과 속도 사이의 대략 선형 관계를 표시합니다(스프레이의 수직 위치에서). 플런지 속도는 오실로스코프로 측정되며, 슬라이드 전위도(10kΩ)에 따라 2kΩ 저항기(그림2C)와병행하여 연결됩니다. 전원 공급 장치는 9 V DC와 함께 전위요계를 제공합니다. 대략적인 플런지 속도는 플런지 압력을 설정하여 실험 전에 설정되지만, 전위전도계는 실험 후 속도를 정확하게 판독합니다.
스프레이 노즐과 액체 에탄 용기
스프레이 기반 시료 전달을 위한 가스 동적 가상 노즐의 제조 및 작동은 다른 곳에서 자세히설명되어 있다(15). 전술한 바와 같이, 밸브 1-3의 ‘디스펜싱’ 출구는 노즐(도3A)의액체 입구에 연결된다. 가압 된 스프레이 가스는 노즐의 가스 입구에 연결되어 있습니다. PDMS 스프레이 노즐의 입구는 0.043″ O.D. PE 튜빙이 피팅 없이 직접 사용할 수 있도록 합니다. 당사의 노즐 설계에는 심판18에설명된 장치와 유사한 두 개의 샘플을 혼합하기 위한 ‘제트 인 제트’ 지오메트리가 포함되어 있습니다. 설계의 회로도는 도 3B에도시되며, 노즐의 현미경 이미지는 도 3C에도시된다. 미세 유체 장치의 레이아웃은 두 개의 샘플을 혼합하기 위해 세 개의 주사기를 사용해야합니다. 스프레이 노즐은 일반적으로 그리드에서 1-1.5cm 거리(샘플 응용 프로그램 중)에 배치됩니다.
우리는 표준 블로팅 방법에 사용되는 액체 에탄 /질소 용기에서 극저온으로 액체 에탄을 사용합니다. 실험실 리프팅 플랫폼으로 액체 에탄 컵의 수직 위치 지정이 달성됩니다.
스프레이 및 그리드 환경 제어
플런저 및 스프레이 노즐은 이중도어(그림 4A)가있는 맞춤형 내장 PMMA(아크릴 유리) 상자에 포함되어 있습니다. 상자 내부의 높은 상대 습도는TED(도 4B)의뒷면의 공기 가습 시스템에 의해 달성된다. 공기는 펌프에 의해 공급되고 처음 10″캐니스터로 공급됩니다 (일반적으로 싱크대 수정화에 사용됨). 캐니스터는 낮은 (~ 5-10cm) 수준의 물로 채워지며 가습기 유닛도 있습니다. 가습기에 대한 주전원은 디지털 습도/온도 컨트롤러와 아크릴 유리 상자 내부에 있는 습도/온도 센서에 의해 제어됩니다. 상대 습도가 90%≥ 도달하면 컨트롤러가 펌프를 끄도록 설정됩니다. 첫 번째 캐니스터에서 가습 된 공기는 디퓨저를 통해 펌핑되어 10 인치 캐니스터에 물에 담근 다음 아크릴 유리 상자에 들어갑니다.
주의: 시료가 분무 노즐에서 에어로졸화되기 때문에 유해 생물학적 또는 화학 적 시편은 시료로 적합하지 않습니다.
실행 시퀀스
제어 소프트웨어의 실행 스크립트 버튼은 실행 시퀀스를 시작합니다. 이 명령 시퀀스는 스크립트 파일에서 미리 정의되고 소프트웨어를 통해 변경할 수 있습니다. 가장 중요한 변수는 다음과 같습니다.
스프레이 속도: 스프레이 속도는 주사기 펌프에서 사용하는 액체 유동량을 결정합니다. 유량은 다음과 같이 계산할 수 있습니다: 여기에 사용되는 주사기 펌프 모터는 고정 된 단계 크기를 가지고 있습니다. 펌프의 전체 범위는 48,000 단계로 나뉩니다. 두 번째 중요한 요소는 주사기 볼륨입니다. 우리는 일반적으로 250 μL 주사기를 사용합니다. 제어 소프트웨어의 스프레이 속도는 단계/초 수로 설정됩니다. 1000 걸음/초의 스프레이 속도는 다음에 해당합니다.
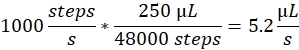
스프레이 볼륨: 스프레이 볼륨은 분사할 총 부피를 결정합니다. 따라서, 또한 스프레이의 지속 시간을 결정한다. 제어 소프트웨어의 분무 볼륨은 여러 단계로 설정됩니다. 1000걸음/초의 스프레이 속도로 2,000단계의 스프레이 볼륨은 2s의 스프레이 지속 시간과 총 10.4 μL의 부피를 이끕킵니다.
사전 분무 시간: 이 변수는 스프레이와 플런지의 개시 시간을 정의합니다. 그리드를 급락하기 전에 스프레이가 안정화할 충분한 시간이 있도록 지연 시간을 선택하는 것이 중요합니다. 일반적으로, 스프레이는 그리드가 급락하기 전에 안정화하기 위해 1.5 – 4 s가 주어집니다. 그리드가 통과될 때까지 스프레이가 유지됩니다. 일반적으로, 액체 흐름(및 따라서 스프레이)은 그리드가 급락한 후 0.5~1s로 정지된다. 1000 걸음/s의 스프레이 속도와 2000단계의 스프레이 볼륨을 사용하여 일반적인 사전 스프레이 시간은 1.5초입니다.
명령의 예시적인 시퀀스는 도 5A에도시되고, 시간이 지남에 따라 그리드 위치는 도 5B에도시된다.
Protocol
Representative Results
Discussion
이 작업의 프로토콜은 직접 분무 및 TrEM 실험을 통해 빠른 그리드 준비에 사용할 수 있습니다. 빠른 그리드 준비는 공기 물 인터페이스5와의입자 상호 작용을 줄이기 위해 사용될 수 있다. 주요 제한 사항은 그리드에서 사용 가능한 샘플 농도 및 얼음 두께입니다. 이러한 제한 내에서 샘플 품질이 양호하다면 프로토콜은 고해상도 저온-EM에 적합한 그리드를 생성합니다.
<p class=…Disclosures
The authors have nothing to disclose.
Acknowledgements
몰리 S.C. 그레이브트에게 유용한 토론과 ABSL 시설 직원에게 cryo-EM 데이터 수집에 도움을 주신 것에 감사드립니다. 데이비드 P. 클레블은 리즈 대학에 의해 투자 애스트베리 센터에서 웰컴 트러스트 4 년 박사 과정 프로그램에 박사 과정 학생입니다. FEI 티탄 크리오스 현미경은 리즈 대학 (UoL ABSL 상)과 웰컴 트러스트 (108466/ Z / 15 / Z)에 의해 투자되었다. 이 작품은 스티븐 P. Muench (BB / P026397/1)에 BBSRC 보조금에 의해 지원되었으며 미국 심장 협회 (AMR21-236078)와 하워드 D. 화이트와 미국 국립 보건 원 (171261)의 하워드 D. 화이트에 대한 연구 보조금에 의해 지원되었다.
Materials
| Time resolved device | |||
| acrylic glass box | USA scientific | ||
| digital humidity/temperature controller | THE20 digital humidity/temperature controller | ||
| dual rod pneumatic cylinder | dual rod pneumatic cylinder TN 10×70 | ||
| FEP tubing | Upchurch Scientific 1/16” O.D., 0.01'' I.D. FEP tubing | ||
| flangeless fittings | Upchurch Scientific ETFE/ETFE flangeless fittings | ||
| flexible reinforced PVC tubing | 12 mm OD. flexible reinforced PVC tubing | ||
| glass syringes | Kloehn 250 µL zero-dead volume | ||
| humidifier pump | Interpret Aqua Air AP3 | ||
| liquid ethane container | from Thermo/FEI VitrobotTM Mark IV | ||
| multistage regulator | GASARC class 3 multistage regulator | ||
| negative pressure tweezers | Dumont N5 Inox B negative pressure tweezers | ||
| oscilloscope | Hantek 6022BE oscilloscope | ||
| PE tubing | Scientific Commodities Inc. 0.043” O.D., 0.015” I.D. PE tubing | ||
| power supply | Mean Well GSM160A24-R7B | ||
| power supply | Wanptek KPS305D power supply | ||
| PU tubing | SMC TU0425 4 mm O.D., 2.5 mm I.D. PU tubing | ||
| regulator | Norgren R72G-2GK-RMN | ||
| slide potentiometer | PS100 slide potentiometer | ||
| solenoid valve | SMC NVJ314M solenoid valve | ||
| syringe drive pumps | Kloehn V6 48K model | ||
| Reagents & Materials | |||
| apoferritin from equine spleen | Sigma-Aldrich, A3660 | ||
| ATP | Sigma-Aldrich, A2383 | ||
| cryo-EM grids | Quantifoil 300 mesh Cu, R 1.2/1.3 | ||
| EGTA | Sigma Aldrich E3889 | ||
| F-actin | Provided by H.D. White (for preparation procedure, see ref. 1) | ||
| glow-discharger | Cressington 208 carbon coater with a glow-discharge unit | ||
| HEPES | Sigma-Aldrich, H7006 | ||
| KAc | Sigma-Aldrich, P1190 | ||
| MgCl2 | Sigma-Aldrich, M8266 | ||
| MOPS | Sigma-Aldrich, M1254 | ||
| NaCl | Sigma-Aldrich, S9888 | ||
| Skeletal muscle myosin S1 | Provided by H.D. White (for preparation procedure, see ref. 2) | ||
| Ref 1 | Spudich, J. A. & Watt, S. The regulation of rabbit skeletal muscle contraction I. Biochemical studies of the interaction of the tropomyosin-troponin complex with actin and the proteolytic fragments of myosin. Journal of biological chemistry 246, 4866-4871 (1971). | ||
| Ref 2 | White, H. & Taylor, E. Energetics and mechanism of actomyosin adenosine triphosphatase. Biochemistry 15, 5818-5826 (1976). |
References
- Murphy, B. J., et al. Rotary substates of mitochondrial ATP synthase reveal the basis of flexible F1-Fo coupling. Science. 364, (2019).
- Benton, D. J., Gamblin, S. J., Rosenthal, P. B., Skehel, J. J. Structural transitions in influenza haemagglutinin at membrane fusion pH. Nature. , 1-4 (2020).
- Dance, A. Molecular motion on ice. Nature Methods. , 1-5 (2020).
- D’Imprima, E., et al. Protein denaturation at the air-water interface and how to prevent it. Elife. 8, 42747 (2019).
- Noble, A. J., et al. Reducing effects of particle adsorption to the air-water interface in cryo-EM. Nature Methods. 15, 793-795 (2018).
- Klebl, D. P., et al. Need for speed: Examining protein behaviour during cryoEM grid preparation at different timescales. BioRxiv. , (2020).
- Ravelli, R. B., et al. Cryo-EM structures from sub-nl volumes using pin-printing and jet vitrification. Nature Communications. 11, 1-9 (2020).
- Arnold, S. A., et al. Blotting-free and lossless cryo-electron microscopy grid preparation from nanoliter-sized protein samples and single-cell extracts. Journal of Structural Biology. 197, 220-226 (2017).
- Razinkov, I., et al. A new method for vitrifying samples for cryoEM. Journal of Structural Biology. 195, 190-198 (2016).
- Feng, X., et al. A fast and effective microfluidic spraying-plunging method for high-resolution single-particle cryo-EM. Structure. 25, 663-670 (2017).
- Ashtiani, D., et al. Delivery of femtolitre droplets using surface acoustic wave based atomisation for cryo-EM grid preparation. Journal of Structural Biology. 203, 94-101 (2018).
- Rubinstein, J. L., et al. Shake-it-off: a simple ultrasonic cryo-EM specimen-preparation device. Acta Crystallographica Section D: Structural Biology. 75, (2019).
- Mäeots, M. -. E., et al. Modular microfluidics enables kinetic insight from time-resolved cryo-EM. Nature Communications. 11, 1-14 (2020).
- Kontziampasis, D., et al. A cryo-EM grid preparation device for time-resolved structural studies. IUCrJ. 6, (2019).
- Klebl, D. P., et al. Sample deposition onto cryo-EM grids: from sprays to jets and back. Acta Crystallographica Section D: Structural Biology. 76, (2020).
- White, H., Thirumurugan, K., Walker, M., Trinick, J. A second generation apparatus for time-resolved electron cryo-microscopy using stepper motors and electrospray. Journal of Structural Biology. 144, 246-252 (2003).
- Kaledhonkar, S., Fu, Z., White, H., Frank, J. . Protein Complex Assembly. , 59-71 (2018).
- Trebbin, M., et al. Microfluidic liquid jet system with compatibility for atmospheric and high-vacuum conditions. Lab on a Chip. 14, 1733-1745 (2014).
- Klebl, D. P., Sobott, F., White, H. D., Muench, S. P. On-grid and in-flow mixing for time-resolved Cryo-EM. Acta Crystallographica Section D: Structural Biology. , (2021).
- He, S., Scheres, S. H. Helical reconstruction in RELION. Journal of Structural Biology. 198, 163-176 (2017).
- Millar, N. C., Geeves, M. A. The limiting rate of the ATP-mediated dissociation of actin from rabbit skeletal muscle myosin subfragment 1. FEBS Letters. 160, 141-148 (1983).
- Kasas, S., Dumas, G., Dietler, G., Catsicas, S., Adrian, M. Vitrification of cryoelectron microscopy specimens revealed by high-speed photographic imaging. Journal of Microscopy. 211, 48-53 (2003).
- Glaeser, R. M., et al. Defocus-dependent Thon-ring fading. bioRxiv. , (2020).
- Bagshaw, C. A beginner’s guide to flow kinetics. The Biochemist. 42, (2020).

