إعداد الشبكة السريعة للمجهر Cryo-Electron الذي تم حله زمنيا
Summary
هنا، نقدم بروتوكول مفصل لاستخدام جهاز صنع الشبكة السريعة لكل من صنع الشبكة السريعة والاختلاط السريع والتجميد لإجراء تجارب حل الوقت.
Abstract
يتطور مجال المجهر الإلكتروني المبرد (cryo-EM) بسرعة باستخدام أجهزة جديدة وخوارزميات معالجة ، مما ينتج هياكل عالية الدقة ومعلومات عن الأنظمة الأكثر تحديا. ويخضع إعداد العينة للكريو-م لثورة مماثلة مع وضع نهج جديدة لتحل محل أنظمة النشاف التقليدية. وتشمل هذه استخدام موزعات بيزو الكهربائية، دبوس الطباعة والرش المباشر. ونتيجة لهذه التطورات، تسير سرعة إعداد الشبكة من ثوان إلى مللي ثانية، مما يوفر فرصا جديدة، لا سيما في مجال التبريد-EM الذي تم حله زمنيا حيث يمكن خلط البروتينات والركائز بسرعة قبل الهبوط في التجمد، مما يؤدي إلى محاصرة الدول المتوسطة قصيرة العمر. هنا نقوم بوصف، بالتفصيل، بروتوكول قياسي لصنع شبكات على جهاز EM الداخلي الذي تم حله زمنيا لإعداد الشبكة السريعة القياسية وكذلك للتجارب التي تم حلها زمنيا. يتطلب البروتوكول عينة لا تقل عن 50 ميكرولتر بتركيزات ≥ 2 ملغم/مل لإعداد 4 شبكات. يمكن أن يكون التأخير بين تطبيق العينة والتجميد منخفضا إلى 10 مللي ثانية. أحد القيود هو زيادة سمك الجليد بسرعات أسرع ومقارنتها بطريقة النشاف. نأمل أن يساعد هذا البروتوكول الآخرين في تصميم أجهزة صنع الشبكة الخاصة بهم والمهتمين بتصميم تجارب حلها الزمن.
Introduction
خلفية
وقد مكنت التطورات الأخيرة في المجهر الإلكتروني المبرد (cryo-EM) من إجراء دراسات هيكلية للأنظمة المتزايدة التعقيد بدقة عالية. مع استثناءات قليلة، اقتصرت هذه الدراسات على الجزيئات البيولوجية في التوازن1 أو ردود الفعل بطيئة نسبيا2. تحدث العديد من العمليات في الجسم الحي على مقياس زمني أسرع (مللي ثانية) وهناك اهتمام متزايد في cryo-EM (TrEM) الذي تم حله عبر الزمن على هذه الجداول الزمنية3. ومع ذلك، إعداد عينة cryo-EM التقليدية بواسطة أسلوب النشاف بطيئة جدا لTrEM ميلي ثانية.
أسلوب النشاف له قيود أخرى إلى جانب ضعف الوقت القرار. يمكن أن تعاني البروتينات ومجمعات البروتين من التشبع أو التوجه المفضل على الشبكات4. وقد تبين أن تقليل وقت التعرض لواجهة الهواء والماء أثناء إعداد العينة للتخفيف من التوجه المفضل وتشبع البروتين5،6. وبالتالي، فإن إعداد الشبكة بسرعة لا يتيح فقط TrEM ميلي ثانية ولكن يمكن أيضا تحسين جودة الشبكة.
حاليا، هناك ثلاثة نهج مختلفة لإعداد الشبكة الآلي. يستخدم النهج الأول دبوس أو الشعرية التي تحتوي على كمية صغيرة من العينة. بعد إقامة اتصال بين السائل وسطح الشبكة ، يتم “كتابة” العينة على الشبكة7،8. عملية تطبيق نموذج بطيء نسبيا ويستغرق بضع ثوان. نهج بديل يستخدم توليد القطيرات التي تسيطر عليها موزع بيزو وشبكات الفتل الذاتي9. وهذا يسمح أسرع الاستغناء عن تجميد مرات، ولكن لا يزال محدودا عن طريق سرعة القطيرات والفتل (تصل حاليا إلى 54 مللي ثانية). أسرع نهج حتى الآن هو نهج الرش المباشر ، حيث يتم تفتيت العينة في فوهة رذاذ وقطرات صغيرة (~ 10 – 20 ميكرومتر) وسريعة (> 5 م / ثانية) تنتشر عند ملامسة شبكة cryo-EM. يمكن توليد رذاذ العينة من خلال طرق مختلفة مثل رذاذ الأرومة الهوائية ، والموجات الصوتية السطحية أو المرطبات بالموجات فوق الصوتية10،11،12،13. في تجربتنا، سمك الجليد مع نهج الرش المباشر هو أكبر ولكن الرش المباشر تمكن الاستغناء عن تجميد مرات < 10 مللي ثانية.
يصف هذا البروتوكول خطوة بخطوة كيف يمكن استخدام جهاز EM (TED) الذي تم حله زمنيا والمجهز ب فوهة رذاذ microfluidic لإعداد الشبكات على مقياس زمني سريع14و15. وقد استخدم الجهاز لإعداد الشبكات مع الحد الأدنى من وقت التأخير من 6 مللي ثانية بين تطبيق العينة وتجميد وخلط وتجميد عينات اثنين بسرعة. ويستند تصميم تيد على الإصدار السابق16 ويشبه غيرها من الأجهزة القائمة على رذاذ الوقت حل cryo-EM17.
أولا، يتم وصف الأجزاء الأربعة الرئيسية من إعداد تيد. جوهر تيد هو وحدة المناولة السائلة، وهي المسؤولة عن عينة الطموح والاستغناء. المكبس الهوائي يحرك الشبكة من خلال الرذاذ إلى الإيثان السائل. يتم تحقيق توليد الرذاذ مع فوهات رذاذ microfluidic ويتم التجميد في حاوية الإيثان السائل ، والتي يتم وصفها لفترة وجيزة. وأخيرا، يتم تسليط الضوء على الميزات الإضافية للتحكم في بيئة الشبكة، وخاصة الرطوبة. ويتبع ذلك بروتوكولات مفصلة لتشغيل الجهاز وإجراء تجارب TrEM. يتم إعطاء نتائج تمثيلية لإعداد الشبكة بسرعة وتجربة TrEM بسيطة.
الإعداد التجريبي
وحدة المناولة السائلة
يتم تشكيل نظام المناولة السائلة في تيد من خلال ثلاث مضخات محرك حقنة (‘مضخات 1 – 3’)، كل مجهزة صمام دوار(الشكل 1). توفر إمدادات الطاقة مضخات 1-3 مع 24 فولت DC. الاتصال مع برنامج التحكم (مكتوب في Visual Basic و C ++) عبر واجهة RS232 لضخ 1. يتم توزيع الأوامر من خلال منافذ توسيع الإدخال/إخراج التسلسلية من المضخة 1 إلى المضخات 2-3. مضخات 1-3 مجهزة المحاقن الزجاجية (‘المحاقن 1-3’، ونحن نستخدم 250 ميكرولتر / صفر المحاقن حجم الميت هنا). كل صمام له موقفين، “تحميل” و “الاستغناء”. يتم استخدام موضع “الحمل” لتنشق العينة في الحقنة. قطعة قصيرة (~ 3 – 4 سم) من 1/16 “O.D., 0.01′′I.D. يتم توصيل أنابيب FEP عبر ETFE / ETFE التجهيزات مع ذلك إلى موقف ‘تحميل’ من الصمامات 1-3. تصل هذه القطعة القصيرة من الأنابيب إلى خزان العينة (عادة أنبوب بلاستيكي سعة 1.5 مل أو 0.5 مل). موقف “الاستغناء” يؤدي إلى فوهة رذاذ. يتم الاتصال بين منفذ “الاستغناء” وفوهة الرش عن طريق أنابيب PE (~ 20-30 سم طول، 0.043″O.D.، 0.015″I.D.)، مع قطعة قصيرة من أنابيب الأكمام (~ 0.5 سم) و ETFE / ETFE التجهيزات flangeless.
المكبس الهوائي
يستخدم TED المكبس الهوائي لتسريع الشبكة وتحريكها من خلال رذاذ العينة في حاوية الإيثان السائلة. ملاقط الضغط السلبي عقد الشبكة، مشدود في حامل المنزل الصنع الذي شنت على اسطوانة هوائية قضيب مزدوج(الشكل 2A).
يتم توفير الضغط من اسطوانة غاز النيتروجين الكبيرة (حجم W) ، ومجهزة منظم متعدد المراحل (0 – 10 بار ، “الضغط الرئيسي”). تربط أنابيب PVC المعززة المرنة (12 مم O.D. ) المنظم بمشعب مكون من 12 منفذا حيث يتم توصيل النيتروجين المضغوط إلى الفوهة والمغطاس الهوائي. تدفق الغاز من خلال فوهة ثابت، وينظم مباشرة في اسطوانة النيتروجين (الضغط الرئيسي). يتم إجراء الاتصال بالزهة مع أنابيب PU (4 مم O.D.، 2.5 مم I.D.)، قطعة قصيرة من أنابيب PE (طول ~ 8 سم، 0.043 بوصة، 0.015 بوصة) والموصلات المناسبة. يتم التحكم في الضغط على المكبس الهوائي من خلال صمام سولينويد. تربط أنابيب PU (4 مم O.D.، 2.5 مم I.D.) الصمام السولينويد بمنظم ومغطاس هوائي، للسماح بانخفاض ضغط الهبوط (≤ الضغط الرئيسي). صمام سولينويد هو الكمبيوتر التي تسيطر عليها. يتم إعطاء نظرة عامة تخطيطية الإعداد في الشكل 2B.
لاحظ أنه مع هذا الإعداد ضغط الهبوط هو دائما على قدم المساواة أو أصغر من ضغط الغاز رذاذ (الضغط الرئيسي). ومع ذلك ، يمكن بسهولة تغيير الإعداد من خلال دمج منظم ثان في المنبع من فوهة الرش للسماح بسرعات هبوط أعلى عند ضغط غاز الرش المنخفض. يمكن أن يؤدي الضغط العالي (>> 2 بار) إلى تلف فوهة رذاذ PDMS.
تنبيه: هذا هو نظام الضغط و “الضغط الرئيسي” يجب أن يكون دائما < 7 بار.
وعادة ما تستخدم الضغوط بين 0.5 و 2 شريط للمغطس الهوائية وتظهر علاقة خطية تقريبا بين الضغط والسرعة (في الموقف الرأسي للرذاذ). يتم قياس سرعات الهبوط مع منظار الذبذبات، متصلة تمشيا مع عداد ال وقوي الشريحة (10 kΩ) وبالتوازي مع مقاوم 2 كيلوΩ (الشكل 2C). توفر إمدادات الطاقة مقياس القوة مع 9 V DC. في حين يتم تعيين سرعة الهبوط التقريبية قبل التجربة عن طريق وضع ضغط الهبوط ، فإن مقياس القوة يعطي قراءات دقيقة للسرعة بعد التجربة.
فوهات الرش وحاوية الإيثان السائلة
وقد وصفت تصنيع وتشغيل فوهات افتراضية ديناميكية الغاز لتسليم العينة على أساس رذاذ في مكان آخر بالتفصيل15. كما هو موضح أعلاه، يتم توصيل منافذ “الاستغناء” من الصمامات 1-3 إلى مداخل السائل من فوهة (الشكل 3A). يتم توصيل غاز الرش المضغوط بمدخل الغاز في الفوهة. المداخل في فوهات رذاذ PDMS هي من هذا القبيل أن 0.043 “O.D. PE أنابيب يمكن استخدامها مباشرة دون الحاجة إلى التجهيزات. يحتوي تصميم الفوهة لدينا على هندسة “طائرة نفاثة” لخلط عينتين ، على غرار الجهاز الموصوف في المرجع18. يظهر مخطط للتصميم في الشكل 3B، وتظهر صورة مجهرية لل وفوهة في الشكل 3C. يتطلب تخطيط الجهاز microfluidic استخدام ثلاث حقن لخلط عينتين. يتم وضع فوهة الرش عادة على مسافة 1-1.5 سم من الشبكة (أثناء تطبيق العينة).
نحن نستخدم الإيثان السائل ككريوجين، في وعاء الإيثان السائل / النيتروجين كما هو مستخدم لطريقة النشاف القياسية. يتم تحديد المواقع الرأسية لكأس الإيثان السائل من خلال منصة رفع مختبرية.
التحكم في بيئة الرذاذ والشبكة
وترد فوهة المكبس ورذاذ داخل مخصص بنيت PMMA (زجاج الاكريليك) مربع مع باب مزدوج(الشكل 4A). يتم تحقيق الرطوبة النسبية العالية داخل الصندوق من خلال نظام ترطيب الهواء في الجزء الخلفي من تيد(الشكل 4B). يتم توفير الهواء بواسطة مضخة وتغذية في أول 10 “علبة (تستخدم عادة لتنقية المياه تحت بالوعة). تمتلئ العبوة بمستوى منخفض (~ 5-10 سم) من الماء وتضم أيضا وحدة مرطب. يتم التحكم في طاقة التيار الكهربائي للمرطب بواسطة وحدة تحكم رقمية في الرطوبة / درجة الحرارة ومستشعر الرطوبة / درجة الحرارة الموجود داخل صندوق زجاج الأكريليك. يتم تعيين وحدة التحكم لإيقاف تشغيل المضخة عندما تصل الرطوبة النسبية ≥ 90 ٪. يتم ضخ الهواء المرطب من العبوة الأولى من خلال الناشر ، مغمورة في الماء في عبوة 10 بوصة ثانية ثم تدخل مربع زجاج الأكريليك.
تنبيه: نظرا لأن العينة يتم هباءها في فوهة الرش ، فإن العينة البيولوجية أو الكيميائية الخطرة ليست مناسبة كعينات.
تسلسل التشغيل
يبدأ الزر تشغيل البرنامج النصي في برنامج التحكم تسلسل التشغيل. يمكن تعريف تسلسل الأوامر هذا مسبقا في ملف البرنامج النصي وتغييره من خلال البرنامج. يتم شرح أهم المتغيرات هنا:
سرعة الرش: تحدد سرعة الرش معدل التدفق السائل الذي تستخدمه مضخة الحقنة. يمكن حساب معدل التدفق على النحو التالي: محركات مضخة الحقن المستخدمة هنا لها حجم خطوة ثابتة. وتنقسم المجموعة الكاملة للمضخة إلى 48،000 خطوة. العامل الثاني المهم هو حجم الحقنة. نحن عادة ما نستخدم 250 حقنة ميكرولتر. يتم تعيين سرعة الرش في برنامج التحكم وعدد من الخطوات / الثانية. سرعة الرش من 1000 خطوات / ثانية يتوافق مع:
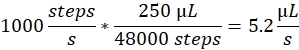
حجم الرش: يحدد حجم الرش إجمالي الحجم الذي سيتم رشه. وهكذا، فإنه يحدد أيضا مدة رذاذ. يتم تعيين حجم الرش في برنامج التحكم كعدد من الخطوات. حجم رذاذ من 2000 خطوات، بسرعة رذاذ من 1000 خطوة / ثانية، ويؤدي إلى مدة رذاذ من 2 ق وحجم إجمالي قدره 10.4 ميكرولتر.
وقت ما قبل الرش: يحدد هذا المتغير الوقت بين بدء الرش والغطس. من المهم اختيار وقت التأخير بحيث يكون للرذاذ الوقت الكافي لتحقيق الاستقرار قبل إغراق الشبكة. عادة، يتم إعطاء رذاذ 1.5 -4 ق لتحقيق الاستقرار قبل أن تغرق الشبكة. يتم الحفاظ على الرذاذ حتى تتحرك الشبكة من خلال. عادة، يتم إيقاف تدفق السائل (وبالتالي رذاذ) 0.5 إلى 1 s بعد أن تم هوت الشبكة. باستخدام سرعة رش 1000 خطوة / ثانية وحجم رذاذ من 2000 خطوة ، فإن وقت الرش النموذجي هو 1.5 ثانية ، على سبيل المثال.
يظهر تسلسل مثالي للأوامر في الشكل 5A، ويتم توضيح موضع الشبكة بمرور الوقت في الشكل 5B.
Protocol
Representative Results
Discussion
يمكن استخدام البروتوكولات في هذا العمل لإعداد الشبكة بسرعة عن طريق الرش المباشر وتجارب TrEM. يمكن استخدام إعداد الشبكة السريعة للحد من تفاعلات الجسيمات مع واجهة مياه الهواء5. القيود الرئيسية هي تركيز العينة المتاحة وسمك الجليد على الشبكة. ضمن هذه الحدود وشريطة أن تكون جودة الع?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
نود أن نشكر مولي س.C. غريفت على المناقشات المفيدة وموظفي مرفق ABSL للمساعدة في جمع البيانات cryo-EM. ديفيد ب. كليبل هو طالب دكتوراه في برنامج ويلكوم ترست للدكتوراه لمدة 4 سنوات في مركز أستبري بتمويل من جامعة ليدز. تم تمويل مجاهر FEI Titan Krios من قبل جامعة ليدز (جائزة UoL ABSL) و Wellcome Trust (108466/Z/15/Z). تم تمويل هذا العمل من خلال منحة BBSRC لستيفن ب. موينش (BB/P026397/1) ودعمت بمنح بحثية لهوارد د. وايت من جمعية القلب الأمريكية (AMR21-236078) وهوارد د. وايت وفيتولد غالكين من المعاهد القومية للصحة الأمريكية (171261).
Materials
| Time resolved device | |||
| acrylic glass box | USA scientific | ||
| digital humidity/temperature controller | THE20 digital humidity/temperature controller | ||
| dual rod pneumatic cylinder | dual rod pneumatic cylinder TN 10×70 | ||
| FEP tubing | Upchurch Scientific 1/16” O.D., 0.01'' I.D. FEP tubing | ||
| flangeless fittings | Upchurch Scientific ETFE/ETFE flangeless fittings | ||
| flexible reinforced PVC tubing | 12 mm OD. flexible reinforced PVC tubing | ||
| glass syringes | Kloehn 250 µL zero-dead volume | ||
| humidifier pump | Interpret Aqua Air AP3 | ||
| liquid ethane container | from Thermo/FEI VitrobotTM Mark IV | ||
| multistage regulator | GASARC class 3 multistage regulator | ||
| negative pressure tweezers | Dumont N5 Inox B negative pressure tweezers | ||
| oscilloscope | Hantek 6022BE oscilloscope | ||
| PE tubing | Scientific Commodities Inc. 0.043” O.D., 0.015” I.D. PE tubing | ||
| power supply | Mean Well GSM160A24-R7B | ||
| power supply | Wanptek KPS305D power supply | ||
| PU tubing | SMC TU0425 4 mm O.D., 2.5 mm I.D. PU tubing | ||
| regulator | Norgren R72G-2GK-RMN | ||
| slide potentiometer | PS100 slide potentiometer | ||
| solenoid valve | SMC NVJ314M solenoid valve | ||
| syringe drive pumps | Kloehn V6 48K model | ||
| Reagents & Materials | |||
| apoferritin from equine spleen | Sigma-Aldrich, A3660 | ||
| ATP | Sigma-Aldrich, A2383 | ||
| cryo-EM grids | Quantifoil 300 mesh Cu, R 1.2/1.3 | ||
| EGTA | Sigma Aldrich E3889 | ||
| F-actin | Provided by H.D. White (for preparation procedure, see ref. 1) | ||
| glow-discharger | Cressington 208 carbon coater with a glow-discharge unit | ||
| HEPES | Sigma-Aldrich, H7006 | ||
| KAc | Sigma-Aldrich, P1190 | ||
| MgCl2 | Sigma-Aldrich, M8266 | ||
| MOPS | Sigma-Aldrich, M1254 | ||
| NaCl | Sigma-Aldrich, S9888 | ||
| Skeletal muscle myosin S1 | Provided by H.D. White (for preparation procedure, see ref. 2) | ||
| Ref 1 | Spudich, J. A. & Watt, S. The regulation of rabbit skeletal muscle contraction I. Biochemical studies of the interaction of the tropomyosin-troponin complex with actin and the proteolytic fragments of myosin. Journal of biological chemistry 246, 4866-4871 (1971). | ||
| Ref 2 | White, H. & Taylor, E. Energetics and mechanism of actomyosin adenosine triphosphatase. Biochemistry 15, 5818-5826 (1976). |
References
- Murphy, B. J., et al. Rotary substates of mitochondrial ATP synthase reveal the basis of flexible F1-Fo coupling. Science. 364, (2019).
- Benton, D. J., Gamblin, S. J., Rosenthal, P. B., Skehel, J. J. Structural transitions in influenza haemagglutinin at membrane fusion pH. Nature. , 1-4 (2020).
- Dance, A. Molecular motion on ice. Nature Methods. , 1-5 (2020).
- D’Imprima, E., et al. Protein denaturation at the air-water interface and how to prevent it. Elife. 8, 42747 (2019).
- Noble, A. J., et al. Reducing effects of particle adsorption to the air-water interface in cryo-EM. Nature Methods. 15, 793-795 (2018).
- Klebl, D. P., et al. Need for speed: Examining protein behaviour during cryoEM grid preparation at different timescales. BioRxiv. , (2020).
- Ravelli, R. B., et al. Cryo-EM structures from sub-nl volumes using pin-printing and jet vitrification. Nature Communications. 11, 1-9 (2020).
- Arnold, S. A., et al. Blotting-free and lossless cryo-electron microscopy grid preparation from nanoliter-sized protein samples and single-cell extracts. Journal of Structural Biology. 197, 220-226 (2017).
- Razinkov, I., et al. A new method for vitrifying samples for cryoEM. Journal of Structural Biology. 195, 190-198 (2016).
- Feng, X., et al. A fast and effective microfluidic spraying-plunging method for high-resolution single-particle cryo-EM. Structure. 25, 663-670 (2017).
- Ashtiani, D., et al. Delivery of femtolitre droplets using surface acoustic wave based atomisation for cryo-EM grid preparation. Journal of Structural Biology. 203, 94-101 (2018).
- Rubinstein, J. L., et al. Shake-it-off: a simple ultrasonic cryo-EM specimen-preparation device. Acta Crystallographica Section D: Structural Biology. 75, (2019).
- Mäeots, M. -. E., et al. Modular microfluidics enables kinetic insight from time-resolved cryo-EM. Nature Communications. 11, 1-14 (2020).
- Kontziampasis, D., et al. A cryo-EM grid preparation device for time-resolved structural studies. IUCrJ. 6, (2019).
- Klebl, D. P., et al. Sample deposition onto cryo-EM grids: from sprays to jets and back. Acta Crystallographica Section D: Structural Biology. 76, (2020).
- White, H., Thirumurugan, K., Walker, M., Trinick, J. A second generation apparatus for time-resolved electron cryo-microscopy using stepper motors and electrospray. Journal of Structural Biology. 144, 246-252 (2003).
- Kaledhonkar, S., Fu, Z., White, H., Frank, J. . Protein Complex Assembly. , 59-71 (2018).
- Trebbin, M., et al. Microfluidic liquid jet system with compatibility for atmospheric and high-vacuum conditions. Lab on a Chip. 14, 1733-1745 (2014).
- Klebl, D. P., Sobott, F., White, H. D., Muench, S. P. On-grid and in-flow mixing for time-resolved Cryo-EM. Acta Crystallographica Section D: Structural Biology. , (2021).
- He, S., Scheres, S. H. Helical reconstruction in RELION. Journal of Structural Biology. 198, 163-176 (2017).
- Millar, N. C., Geeves, M. A. The limiting rate of the ATP-mediated dissociation of actin from rabbit skeletal muscle myosin subfragment 1. FEBS Letters. 160, 141-148 (1983).
- Kasas, S., Dumas, G., Dietler, G., Catsicas, S., Adrian, M. Vitrification of cryoelectron microscopy specimens revealed by high-speed photographic imaging. Journal of Microscopy. 211, 48-53 (2003).
- Glaeser, R. M., et al. Defocus-dependent Thon-ring fading. bioRxiv. , (2020).
- Bagshaw, C. A beginner’s guide to flow kinetics. The Biochemist. 42, (2020).

