في المختبر التصوير الكمي المقايسة لPhaagocytosis من خلايا الورم الأرومي العصبي الميت من قبل iPSC-الضامة
Summary
ترتبط الأمراض العصبية مع وظائف microglia dysregulated. توضح هذه المقالة المقايسة في المختبر لداء البلعوم من خلايا الورم الأرومي العصبي بواسطة الضامة iPSC. يتم وصف قراءات المجهر الكمي لكل من التصوير بالخلايا الحية والتصوير عالي المحتوى بالخلايا الثابتة.
Abstract
Microglia تنسيق الاستجابات العصبية في العديد من الأمراض العصبية، بما في ذلك مرض باركنسون ومرض الزهايمر. Microglia مسح الخلايا العصبية الميتة والموت من خلال عملية التصنت، وهو شكل متخصص من البلعومية. يمكن أن تتعطل وظيفة البلعومية بسبب عوامل الخطر البيئية أو الوراثية التي تؤثر على microglia. تقدم هذه الورقة بروتوكولا مجهريا سريعا وبسيطا في المختبر لدراسة التصاق الدمى المجهري في نموذج الخلايا الجذعية المستحثة متعددة القدرات (iPSC) للميكروجليا ، باستخدام خط خلايا الورم الأرومي العصبي البشري (SH-SY5Y) المسمى بصبغة حساسة ل درجة الحموضة للشحنة البلعومية. يؤدي الإجراء إلى زيادة غلة خلايا الورم الأرومي العصبي الميتة ، والتي تعرض فوسفاتيديلسيرين السطح ، المعترف بها كإشارة “أكل لي” من قبل الخلايا الفقارية. إن فحص اللوحة الذي يضم 96 بئرا مناسب للتصوير بالخلايا الحية الفاصل الزمني، أو يمكن إصلاح اللوحة بنجاح قبل إجراء المزيد من المعالجة وقياسها كميا عن طريق المجهر عالي المحتوى. يسمح الفحص المجهري عالي المحتوى ذو الخلايا الثابتة بزيادة المقايسة لفحص مثبطات الجزيئات الصغيرة أو تقييم الوظيفة البلعومية لخطوط iPSC الجينية المتغيرة. في حين تم تطوير هذا المقايسة لدراسة البلعوم من خلايا الورم الأرومي العصبي الميت كله بواسطة الضامة iPSC، يمكن تكييفها بسهولة للمقايسة للشحنات الأخرى ذات الصلة بالأمراض العصبية، مثل النايبوسومات والمايلين، وأنواع الخلايا البلعومية الأخرى.
Introduction
Microglia هي الضامة المقيمة في أنسجة الدماغ ، وتشمل وظائفها المراقبة المناعية ، وتنسيق الاستجابات الالتهابية للإصابة / العدوى ، وإعادة عرض متشابك ، وداء البلعوم من الخلايا الميتة ، المايلين ، مجاميع البروتين ، ومسببات الأمراض. الفوسفات هو العملية التي microglia التعرف على البضائع مع مستقبلات السطح وإعادة تنظيم الهيكل الخلوي لابتلاع الكائن في phagosome، الذي يندمج بعد ذلك مع الليسوسومات لتدهور البضائع. صحية microglia phagocytose خلايا الدماغ المبرمج لإزالتها قبل أن تصبحنخرية 1. ومن المعروف أيضا أن البلعوم من الخلايا المبرمج كما هو الحال في efferocytosis، ويتطلب عرض إشارة فوسفاتيديلسيرين “أكل لي” من قبل الخلية المحتضرة2. ترتبط العديد من مستقبلات microglia مباشرة بالفوسفاتيديلسيرين ، بما في ذلك TIM-4 و BAI1 و Stabilin-2 و TREM2. ترتبط مستقبلات TAM المجهرية (على سبيل المثال، MERTK) و integrins بشكل غير مباشر بالفوسفاتيديلسيرين، باستخدام البروتينات الملحقة GAS6 أو MFG-E8، على التوالي. إشارات أخرى “أكل لي” قد تكون ضرورية للتعرف على الخلايا المحتضرة, وتشمل هذه التغييرات على الجليكوزيليشن أو تهمة من البروتينات السطحية; التعبير عن البروتينات داخل الخلايا ICAM3, كالدريتولين, الملحقين-I على سطح الخلية; LDL المؤتأكسدة; أو طلاء الخلية المبرمج بواسطة microglia المنتجة تكملة C1q1،2.
ارتبطت الأمراض العصبية ، بما في ذلك مرض باركنسون ، ومرض الزهايمر ، والخرف الجبهي الصدغي ، والتصلب الجانبي الضموري بضعف وظيفة microglia ، بما في ذلك تراكم منتجات نفايات الدماغ مثل الخلايا الميتة ، وشظايا المايلين ، ومجاميع البروتين ، والاستجابات الالتهابية المبالغ فيها لهذه المحفزات3. قد يكون ضعف البلعوس في الأمراض العصبية ويساهم في علم الأمراض ، بسبب مزيج من الشيخوخة أو الالتهاب أو متغيرات الخطر الوراثيالمحددة 4،5. من ناحية أخرى، هناك أيضا أدلة من النماذج الحيوانية من الأمراض العصبية التنكسية التي microglia قد phagocytose بشكل غير ملائم الخلايا العصبية قابلة للحياة أو نقاط الاشتباك العصبي6،7،8. الآلية من المرجح أن يكون بتحريض من عرض فوسفاتيديلسيرين من neurites التالفة, الذي يشعر مباشرة من قبل مستقبلات البلعومية الدقيقة TREM2 أو GPR56, أو شعرت بشكل غير مباشر من قبل تكملة قابلة للذوبان C1q طلاء الغشاء المخصب فوسفاتيديلسيرين, مما يؤدي إلى cr3 بوساطة phagocytosis9,10,11.
في المختبر المقايسات من وظيفة البلعوم، على سبيل المثال، لتقييم تأثير phenotypic من متغير الخطر الوراثي في microglia، وغالبا ما يتم تنفيذها باستخدام الشحنات غير الفسيولوجية مثل حبات اللاتكس4. كما تستخدم البكتيريا ذات العلامات الفلورية والزيموسان ، وهي فسيولوجية ولكنها ليست ذات صلة بالأمراض العصبية. يمكن استخدام الشحنات البلعوية غير الفسيولوجية للكشف عن العيوب في الآلات الأساسية للابتلاع البلعوم ولكنها تفشل في نمذجة الخطوة الأولى “الاعتراف” بدقة في داء البلعوم من الخلايا العصبية المبرمج. حجم وشكل وتصلب ونوع البضائع تملي أيضا مسارات الإشارات داخل الخلايا التي يتم تنشيطها، مما يؤدي إلى نتائج مختلفة من حالة تنشيط microglia. على سبيل المثال ، بكتيريا الإشريكية القولونية صغيرة وقاسية ، على عكس الخلايا البشرية ، ويتم التعرف على السكريات الدهنية على سطحها من قبل مستقبلات تشبه تول 4 (TLR4) التي تنشط البلعوم ومسارات الإشارات المؤيدة للالتهابات2،12.
في سياق دراسات الأمراض العصبية التنكسية ، فإن الشحنة البلعومية الأكثر صلة سيكون لها عرض فوسفاتيديلسيرين على أغشية البلازما الثديية ، وستكون مثالية بشرية وخلايا عصبية ، لتشمل الإشارات التي من المرجح أن تواجهها microglia. لهذا البروتوكول البلعوم، تم اختيار خط الخلية الورم الأرومي العصبي البشري SH-SY5Y كنموذج الخلايا العصبية التي من السهل أن الثقافة. تم تحريض عرض الفوسفاتيديلسيرين السطحي الدائم بشكل مصطنع عن طريق البارافورمالديهايد ، والذي ثبت سابقا أنه يسبب عرض فوسفاتيديلسيرين للصفائح الدموية13. لنموذج الخلية microglia الإنسان iPSC-الضامة استخدمت, التي تحاكي علىالجنة والنسخ الشخصي من microglia الإنسان, وهي المختصة phagocytically14,15,16,17. iPSC-الضامة ليست نموذج microglia الأكثر أصالة المتاحة، على سبيل المثال، أنها لا تحاكي مورفولوجيا microglia. ومع ذلك، يمكن للمرء أن يحل محله لنموذج أكثر أصالة iPSC أحادية الثقافة من microglia إذا رغبت في ذلك، مثل هاينسلروآخرون. نماذج iPSC الإنسان هي أفضل من microglia القوارض الأولية لدراسة التنكس العصبي، وذلك بسبب المخاوف بشأن التداخل المحدود للوحدات النسخ microglia لوحظ في الإنسان مقابل الفئران أنسجة الأمراض العصبية18. الميت SH-SY5Ys ملطخة صبغة حساسة للحمض أن الفلورسيس ضعيفة في درجة الحموضة محايدة وأكثر قوة داخل phagolysosomes من الضامة iPSC بعد البلعوم. استخدام صبغة حساسة للحمض يحسن دقة الكشف عن الأحداث البلعوم، مع براعة لقراءات مختلفة من الضامة الحية والثابتة19. يحدد هذا البروتوكول كلا من التصوير بالخلايا الحية الفاصل الزمني لداء البلعوس ، ومقايس تصوير ثابت عالي المحتوى لداء البلعوس ، مع نفس خطوات إعداد الخلية قبل القراءة(الشكل 1).
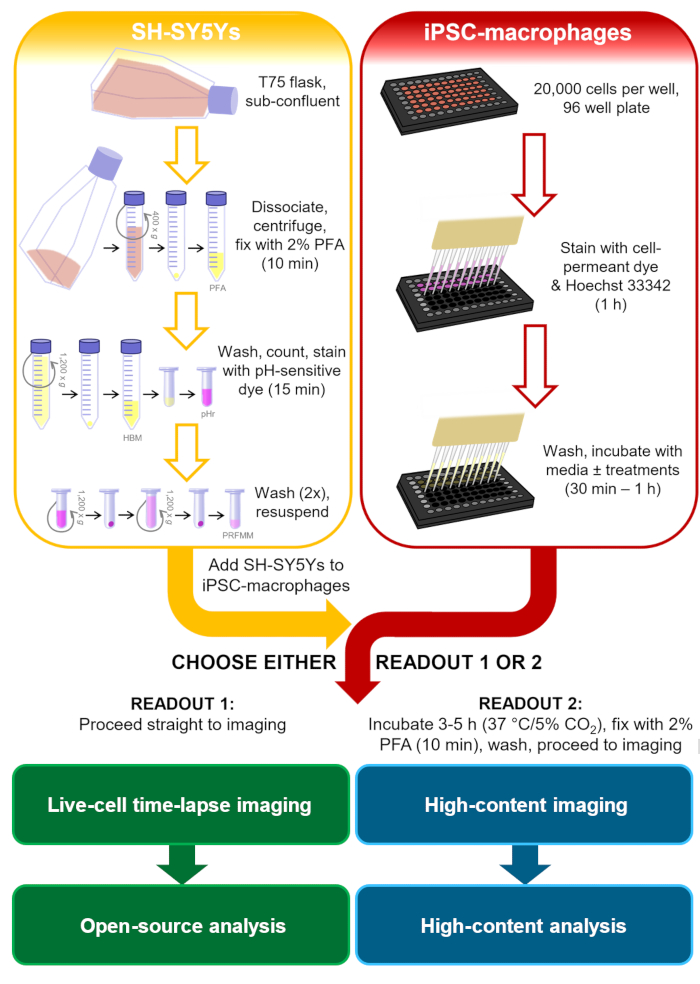
الشكل 1:مخطط تخطيطي للمنهجية. مخطط تفصيلي للتشنج البلعوم، حيث يتم تنفيذ إعداد SH-SY5Ys وتلطيخ الضامة iPSC في موازاة ذلك، ومن ثم يتم إخراج SH-SY5Ys على الضامة iPSC.- إما أن يتم إجراء التصوير بالخلايا الحية الفاصل الزمني على الفور، أو يتم احتضان الخلايا عند 37 درجة مئوية/5٪من ثاني أكسيد الكربون للمدة المطلوبة ويتم إصلاحها قبل إجراء الفحص المجهري عالي المحتوى. PFA: paraformaldehyde، HBM: فينول الأحمر خالية من HEPES العازلة وسائل الإعلام، pHr: درجة الحموضة الحساسة صبغة الفلورسنت الأحمر STP إستر الحل، PRFMM: فينول الوسائط الضامة الحمراء خالية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
Representative Results
Discussion
Microglia لها وظائف هامة تؤثر على بدء وتطور الأمراض العصبية التنكسية، بما في ذلك البلعوم من الخلايا العصبية المبرمج. وقد ارتبط ضعف البلعومية المجهرية وداء البلعومية غير المناسب من نقاط الاشتباك العصبي على حد سواء مع الأمراض العصبية التنكسية، علىالرغممن أن الآليات الأساسية والأسباب ليست مفهومة جيدا 4،23. تحدد هذه الورقة مقايسة البلعوم لقياس الداء البلعومي للخلايا المبرمج بواسطة الضامة iPSC ، إما مع قراءة تصوير بالخلايا الحية أو مجهرية عالية المحتوى ذات خلايا ثابتة ، أو مزيج من الاثنين على مقايسة واحدة. هذا التنوع يعني أنه يمكن استخدام المقايسة لدراسة الأحداث البلعوية الفردية مع مرور الوقت في عدد قليل من الآبار أو استخدامها لفحص المحتوى العالي مع حالات أو علاجات متعددة. وبما أن المقايسة عالية المحتوى ثابتة في نقطة زمنية واحدة، يمكن إعداد لوحات مقايسة متعددة في وقت واحد. الفحص عالي المحتوى له فائدة محتملة لوصف الضامة / microglia مع المتغيرات الوراثية المرتبطة بالأمراض أو فحص مثبطات جزيء صغير للتغيرات في البلعوم. يمكن أيضا التكيف بسهولة مع المقايسة لدراسة داء البلعوم من نماذج microglia الأخرى ، أو الخلايا الفلكية المحتملة. يمكن أن يكون فحص البلعوم متعدد المضاعفات مع بقع تصوير الخلايا الحية ، على سبيل المثال ، الميتوكوندريا أو الكالسيوم أو مؤشرات ROS ، ويمكن إجراء تلطيخ المناعة بعد التثبيت للبروتينات ذات الاهتمام. بالمقارنة مع المقايسات البلعوية الموجودة التي تستخدم خلايا الخلايا العصبية المبرمج ، فإن المزايا الرئيسية التي يمنحها هذا البروتوكول هي أن إعداد الشحنة البلعوية بسيط وسريع نسبيا ، وينتج عنه منتج موحد. المقايسات الأخرى تحفز موت الخلايا العصبية أو SH-SY5Ys مع S-نيتروسو-L-السيستين لمدة 2 ساعة25، حمض أوكادايك لمدة 3 ساعة22، staurospor ل 4-16 ح26,27,28,29 أو الأشعة فوق البنفسجية ل 24 ح30, ويمكن أن يؤدي إلى خلايا في مراحل مختلفة من موت الخلايا المبرمج. وعلاوة على ذلك، لم يسبق وصف التصوير بالخلايا الحية وقراءات التصوير عالية المحتوى، على حد علم المؤلفين. القيد الرئيسي لاستخدام تثبيت paraformaldehyde لإعداد البضائع البلعوم هو أنه لا يلخص تماما عملية موت الخلايا المبرمج ، لأن التثبيت يمنع الخلايا من الانقسام إلى أجسام أبوبيتية ، والتي من المرجح أن تكون فاجوسيتوسد بسرعة أكبر بسبب حجمها الأصغر. ومن غير المعروف ما تأثير التثبيت على إفراز النيوكليوتيدات “العثور على لي” إشارات (على سبيل المثال، ATP، UDP) من الخلية المستهدفة التي تجذب الخلايا الكواغائية. على غرار الخلايا المبرمج، وSY5Ys SH الثابتة تظهر بعض نفاذية الغشاء لبروبيديوم يوديد. ويرتبط نفاذية الغشاء مع الإفراج عن إشارات “العثور على لي”; ومع ذلك، لم تتم دراسة هذا في SH-SY5Ys الثابتة، وإذا تم تحرير النيوكليوتيدات بسرعة كبيرة جدا، سيتم غسلها قبل أن تتم إضافة SH-SY5Ys إلى الضامة iPSC.
الخطوة الحرجة الأولى في البروتوكول هو تلطيخ SH-SY5Ys الميت مع إستر STP من صبغة الفلورسنت الحمراء الحساسة لحاء. هذه الصبغة يتفاعل بسرعة وتساهم مع الأمينات الأولية الحرة على سطح SH-SY5Ys القتلى. مدة تلطيخ لا تحتاج إلى تحسين; ومع ذلك ، يجب توخي الحذر مع التعامل مع الصبغة قبل وضع العلامات. يجب عدم إجراء رد فعل وضع العلامات في المخازن المؤقتة التي تحتوي على أمينات مجانية. وعلاوة على ذلك، هناك خطر هطول الأمطار إذا تم تخفيف مخزون DMSO في عازل مائي بارد أو بتركيز نهائي مرتفع. سوف تظهر الرواسب كأجسام داكنة كثيفة تحت المجهر. بالإضافة إلى ذلك ، فإن محلول الصبغ الحساس ل درجة الحموضة يلتصق بأنابيب الطرد المركزي البلاستيكية العادية ويغسل ببطء ؛ لذلك، يوصى أنابيب منخفضة الربط لخطوة وضع العلامات. استخدام صبغة حساسة لhh، بدلا من صبغة الفلورسنت بشكل دائم، ويساعد على تحديد الجسيمات الغارقة، مقابل الجسيمات التي تتجاور غشاء البلازما. نظرا لوجود بعض الفلورسينس عند درجة الحموضة المحايدة ، فإن كثافة الشحنات البلعوية والكوابير iPSC تحتاج إلى أن تبقى منخفضة بما يكفي للتجزئة الدقيقة ، على الرغم من ارتفاعها بما يكفي لالتقاط العديد من الأحداث البلعوية. كان الفحص المجهري عالي المحتوى قادرا على تحديد الداء البلعومي بدقة مع كثافة متوسطة من البضائع في البئر (أكثر من 2 SH-SY5Ys لكل iPSC-macrophage). وعلى العكس من ذلك، وبسبب ضعف حساسية المجهر في الطيف الأحمر العميق، كان تجزئة الضامة iPSC في بيانات التصوير الفاصل الزمني للخلايا الحية أقل ثقة وكان من الضروري استخدام كثافة منخفضة جدا من البضائع للحد من احتمال حدوث إيجابيات كاذبة (1 SH-SY5Y لكل اثنين من الضامة iPSC). وينبغي التحقق من صحة التقسيم السليم وكثافة الشحن مع المقارنات بين الآبار المعالجة بالسيتوشالاسين D. في المقايسة الأمثل جيدا، يجب أن يقلل السيتوشالاسين D من متوسط عدد البقع لكل خلية بنسبة 90٪ مقارنة بالعينات غير المعالجة.
خطوة هامة أخرى في البروتوكول هي تلطيخ iPSC-macrophage ، والذي يسمح بتحديد الخلية وتقسيمها في تحليل الصورة بحيث يتم استبعاد أي SH-SY5Ys خارجية من العد. الصبغة الموصى بها هي الخلية permeant ، وتحويلها إلى منتج الفلورسنت غير قابل للذوبان داخل السيتوبلازم ، قابلة للإصلاح ، وغير سامة (انظر جدول المواد). تم تحسين خطوة تلطيخ لاستخدام الضامة iPSC مع التصوير عالية المحتوى فحص البلعوم، ونحن نقترح أنه ينبغي إعادة تحسين إذا تم استخدام أنواع الخلايا الأخرى. يمكن زيادة مدة تلطيخ الخلايا لتحسين ترسب المنتج الفلوري غير القابل للذوبان داخل الخلايا. إذا تم تحسين تركيز الصبغة ، فيجب توخي الحذر لتجنب المستويات السامة للمذيبات العضوية.
العامل الحاسم الثالث لنجاح الفحص هو تحليل البيانات. والمقصود من خطوط أنابيب التحليل المقدمة أن تكون إرشادية وليست إلزامية، حيث أن الاختلافات في كثافة التلطيخ أو مورفولوجيا الخلايا يمكن أن تقلل من فعالية تجزئة خطوط الأنابيب كما هو مكتوب. ولذلك، ستكون هناك حاجة إلى بعض التحسينات، مع اختبار خط الأنابيب على عناصر تحكم إيجابية وسلبية مناسبة، كما يتم الإشارة إلى المعلمات التي يجب تحسينها في نص البروتوكول. يجب أن تتضمن الضوابط السلبية حالة حيث يتم معالجة الضامة iPSC مسبقا بمثبط البلعوم القوي مثل cytochalasin D قبل إضافة SH-SY5Ys. وثمة عنصر تحكم سلبي محتمل آخر هو إضافة SH-SY5Ys إلى آبار لم تعالج من قبل من الضامة iPSC في نهاية المقايسة، 10 دقيقة قبل التثبيت، والذي يسمح لبعض تسوية البضائع ولكن قصيرة جدا لكمية كبيرة من البلعوم أن يحدث. يتم تعريف حدث الفوسفات بأنه كائن أحمر فلوري داخل حدود iPSC-macrophage ، الذي تحدده خوارزمية البرنامج باستخدام قناة الفلورسنت الحمراء العميقة. إذا تجزئة الخلايا فقيرة (الشكل 2)، قد يتم تضمين العديد من SH-SY5Ys غير phagocytosed على مقربة من iPSC-الضامة خطأ في التحليل، أي إيجابيات كاذبة. وأهم عامل في تحقيق التقسيم الجيد هو التحديد الصارم للوحدات الضامة iPSC. التقسيم لكلا التحليلين آلي، لذلك ليس من الممكن الحصول على تجزئة مثالية لكل خلية؛ ومع ذلك، يمكن ضبط بعض المعلمات لجعل التقسيم أكثر مثالية، وذلك باستخدام عدد قليل من صور الاختبار كمرجع. التحكم سيتشالاسين D مهم لتقييم تجزئة الأمثل لأن عددا كبيرا من الأحداث البلعوية الكشف عنها في هذه الحالة يشير إلى أن تجزئة دون المستوى الأمثل. وينبغي أن الأمثل لخط أنابيب تحليل البيانات تتكرر بشكل مثالي حتى عدد الأحداث البلعوية لكل خلية هو 80٪ -90٪ أقل في حالة دي cytochalasin مقابل أي مثبط.
المشاكل مع المقايسة البلعوم التي من المرجح أن تحدث هي: (1) ضعف الفلورة الحساسة ل درجة الحموضة في الضوابط الإيجابية، (2) توزيع متفرق أو غير متساو من الضامة في نهاية المقايسة، أو (3) أعداد عالية من الإيجابيات كاذبة في التحليل من SH-SY5Ys غير phagocytosed. استكشاف الأخطاء وإصلاحها من ضعف الحموضة الحساسة للفلور يجب أولا التحقق من أن تلطيخ SH-SY5Ys أدى إلى بيليه الخلية مع لون أرجواني قوي. إذا كان اللون ضعيفا، تأكد من استخدام مخزون صبغة طازجة، وتأكد من أن المخزن المؤقت لوضع العلامات خال من الأمين، وأضف غسلا إضافيا إلى SH-SY5Ys قبل التلطيخ، وتحقق مما إذا كان العدد الصحيح من SH-SY5Ys ملطخا، وتأكد من عدم وجود رواسب صبغية في الأدلة، وتحسين تركيز الوسم للصبغة. إذا كانت SH-SY5Ys ملطخة بقوة، فتحقق مما إذا كان التركيز المضاف إلى لوحة الفحص صحيحا، وتأكد من أن الضامة iPSC صحية وليست قديمة جدا. النوع الثاني من المشكلة، توزيع الضامة متفاوتة، يمكن أن تنتج عن فقدان الخلايا أثناء الأنابيب وينبغي اتخاذ خطوات للحد من قوى الأنابيب التي تعاني منها الخلايا، وتجنب نصائح ضيقة تتحمل. إذا بقيت المشكلة، تقليل وقت حضانة تحميل الضامة iPSC مع صبغة الخلية permeant. والمشكلة الثالثة، فيما يتعلق بإدراج الجسيمات غير الفسائية خطأ في التحليل، تشير إلى أن هناك حاجة إلى تعظيم الاستفادة المثلى من خط أنابيب التحليل. يجب أن تركز استكشاف الأخطاء وإصلاحها أولا على تجزئة الخلايا وما إذا كان البرنامج يتضمن كائنات متجاورة. ويقترح في الملاحظات أدناه الخطوات ذات الصلة بارامترات محددة يمكن تعديلها (الخطوات 6-1-11-6-1-15 لتحليل الفاصل الزمني للخلايا الحية والخطوات 6-2-4-6-2-8 للتحليل ذي المحتوى العالي). إذا تعذر تحسين تجزئة الخلية، فإن تحليل المحتوى العالي يحتوي على خطوة إضافية (الخطوة 6.2.8) تستبعد الضامة iPSC-macrophages المقسمة بشكل غير صحيح. وعلاوة على ذلك، يمكن تحسين الوحدة التي تقوم بتصفية البقع المقبولة من الفلورة الحساسة ل درجة الحموضة داخل الضامة iPSC-Macrophages، مما يزيد من كثافة عتبة الأجسام المقبولة، مما سيساعد على استبعاد SH-SY5Ys غير الفاجوسيتوسيد (الخطوة 6.1.17 لتحليل الفاصل الزمني للخلايا الحية، والخطوة 6.2.11 لتحليل المحتوى العالي).
طورنا نوعين من قراءات المجهر لاستجواز البلعومية أن لكل منهما مزايا وقيود. يتمتع التصوير بالخلايا الحية بفاصل زمني بمزايا توفير معلومات إضافية حول الحركية البلعوية وهو متاح على نطاق أوسع من منصات التصوير عالية المحتوى. البرنامج الموصى به مفتوح المصدر لا أدري لمصدر المجهر ويمكن استخدامه مع أي مجهر فلوري جيد الجودة ، مع أو بدون قدرة على الفاصل الزمني للخلايا الحية. القيد الرئيسي للتصوير بالخلايا الحية هو الحساسية المحدودة والبصريات ، مما يجعل من الصعب اكتشاف وأداء تجزئة جيدة من الضامة iPSC. ويمكن التخفيف من هذا القيد إما بزيادة مدة تلطيخ iPSC-macrophage، أو عن طريق التحول إلى مجهر أكثر حساسية، إذا كان متاحا. إن المقايسة عالية المحتوى للتصوير بالفوسيتوسيس هي القراءة الموصى بها إذا كان نظام التصوير عالي المحتوى متاحا. تمكن أنظمة التصوير عالية المحتوى من زيادة الإنتاجية وبيانات أكثر موثوقية ، مما يتيح استخدام هذا الفحص للفحص ، حيث يتوقع أن يكون Z قويا من ≥0.7 في إخراج “عدد البقع لكلخلية” 20. بالمقارنة مع طريقة الفاصل الزمني للخلايا الحية ، فإن قراءة المجهر عالية المحتوى لديها حساسية أعلى ، ودرجة أعلى من التشغيل الآلي والسرعة ، ويمكن معالجة المزيد من الآبار وحقول التصوير ، ويتم إنتاج صور confocal عالية الدقة. تجزئة الخلايا هو أكثر فعالية مع صور جيدة، ويساعد التقسيم بالإضافة إلى ذلك من قبل برنامج تحليل التصوير عالية المحتوى توفير المزيد من أساليب تقسيم الخلايا مناسبة للخلايا على شكل غير منتظم للغاية. كما قام برنامج تحليل التصوير عالي المحتوى بحساب المزيد من معلمات الفوستيات ، مقارنة بالبرمجيات المفتوحة المصدر ، مثل النسبة المئوية للخلايا البلعوسية. القيد الرئيسي للمحتوى العالي فحص البلعوس هو واحد من التكلفة وسهولة الوصول إلى نظام التصوير وتحليل البرمجيات.
في الختام ، فإن المقايسة الكمية للفوسفات التي قدمت في هذه الورقة هي أداة مفيدة لنمذجة البلعومية الدقيقة للخلايا العصبية الميتة في المختبر. يتم تصميم microglia بواسطة الضامة iPSC والخلايا العصبية الميتة على غرار بارافورمالدهيد الثابت SH-SY5Ys. على الرغم من أن ليس الأكثر أصالة microglia ونماذج الخلايا العصبية الميت / المبرمج المنشورة، وهذه هي سهلة لإعداد وقابلة للتطوير. المقايسة نفسها متعددة الاستخدامات للغاية ، مع نوعين من قراءات التصوير مفصلة ، ولديها القدرة على التكيف للاستخدام مع نماذج مختلفة microglia / macrophage أحادية الثقافة ، أو نوع خلية مختلفة لتكون بمثابة البضائع البلعومية. إن قراءة التصوير عالية المحتوى مفيدة للحصول على البيانات الكمية ويمكن توسيع نطاقها إلى مضامين جزيء صغيرة من البلعوم ، أو متغيرات جينية الشاشة في الضامة iPSC. ومع ذلك ، نظرا لأن أنظمة التصوير عالية المحتوى مكلفة وثقيلة البيانات ، فقد تم تضمين قراءة تصوير بديلة في البروتوكول باستخدام مجهر الفاصل الزمني للخلايا الحية ، والذي يمكن استبداله بأي مجهر مضان تقليدي جيد الجودة ، إذا لزم الأمر.
Disclosures
The authors have nothing to disclose.
Acknowledgements
يشكر المؤلفان الدكتور فال ميلار والدكتور صهيب نظامي على مساعدتهما في المجهر عالي المحتوى، والدكتور دانيال إيبنر على الوصول إلى المجاهر عالية المحتوى. وعلاوة على ذلك، يشكر المؤلفان الدكتورة إيما ميد على المشورة في مجال تطوير المقايسة، والسيدة كاثي براون على دعم iPSC. تم دعم هذا العمل من قبل معهد اكتشاف الأدوية في المملكة المتحدة لأبحاث الزهايمر (ARUK ODDI ، مرجع المنح ARUK-2020DDI-OX) ، مع دعم إضافي لمرفق جيمس مارتن للخلايا الجذعية أكسفورد (S.A.C.) من مدرسة أكسفورد مارتن LC0910-004؛ جائزة اكتشاف النصب التذكاري الثقة من المملكة المتحدة باركنسون (J-1403); منصة MRC Dementias UK للمعدات الرأسمالية لشبكة الخلايا الجذعية MC_EX_MR/N50192X/1، والشراكة MR/N013255/1، وجوائز Momentum MC_PC_16034.
Materials
| 15 mL conical centrifuge tube | Falcon | 352096 | For centrifugation of cells |
| 2-20 µL, 20-200 µL, 100-1000 µL single-channel micropipettes | |||
| 2-mercaptoethanol 50 mM | Gibco | 31350010 | Component of Factory media |
| 4% paraformaldehyde in PBS | Alfa Aesar | J61899 | For fixation of cells |
| 6-well plate, tissue culture treated | |||
| AggreWell-800 24-well plate | STEMCELL Technologies | 34815 | Microwell low-adherence 24-well plate for formation of embryoid bodies |
| Annexin V-FITC Apoptosis Staining / Detection Kit | Abcam | ab14085 | Kit for annexin V-FITC staining , as an assay for quality control of fixed SH-SY5Ys. Kit contains annexin binding buffer, annexin V-FITC, and propidium iodide. |
| Automated cell counter | |||
| Benchtop centrifuge | |||
| Benchtop microcentrifuge | |||
| CellCarrier-96 Ultra Microplates, tissue culture treated, black, 96-well with lid | Perkin Elmer | 6055302 | 96-well tissue culture (TC)-treated microplate with black well walls and an optically-clear bottom, for phagocytosis assay |
| CellProfiler software | Open-source software for analysis of phagocytosis images obtained by live-cell time-lapse microscope. Download for free from website (http://cellprofiler.org/), this protocol used version 2.2.0. | ||
| CellTracker Deep Red dye | Thermo Fisher | C34565 | Deep red-fluorescent, cell-permeant, succinimidyl ester-reactive dye for staining cytoplasm of iPS-macrophages. Dissolve CellTracker Deep Red dye in DMSO to 2 mM (1.4 mg/mL). Use at 1 μM, by dilution of DMSO stock with Macrophage media. |
| Class 2 laminar air flow safety cabinet | |||
| CO2 gas bottle | Accessory for EVOS FL Auto | ||
| CO2 incubator, set to 37°C and 5 % CO2 | |||
| Columbus Image Data Storage and Analysis System | Perkin Elmer | Columbus | Data storage and analysis platform for Opera Phenix. Supports all major high content screening instruments. |
| Cytochalasin D | Cayman | 11330 | Negative control treatment for phagocytosis assay. Reconstitute in DMSO to 10 mM and store aliquots at -20°C, avoid further freeze-thaw cycles. Use at final concentration 10 µM. |
| DMEM/F12 | Gibco | 11320074 | Component of SH-SY5Y media |
| DMSO | Sigma | D8418 | Solvent for CellTracker and pHrodo dyes |
| EVOS FL Auto Imaging System | Thermo Fisher | AMF4300 | Live-cell time-lapse imaging microscope |
| EVOS Light Cube CY5 | Thermo Fisher | AMEP4656 | Accessory for EVOS FL Auto |
| EVOS Light Cube DAPI | Thermo Fisher | AMEP4650 | Accessory for EVOS FL Auto |
| EVOS Light Cube RFP | Thermo Fisher | AMEP4652 | Accessory for EVOS FL Auto |
| EVOS Onstage Incubator | Thermo Fisher | AMC1000 | Accessory for EVOS FL Auto |
| Fetal Bovine Serum | Sigma | F4135 | Component of SH-SY5Y media |
| Flow cytometer | |||
| Flow cytometry analysis software | |||
| Geltrex LDEV-Free, hESC-Qualified, Reduced Growth Factor Basement Membrane Matrix | Invitrogen | A1413302 | hESC-qualified basement membrane matrix for iPSC culture |
| GlutaMAX Supplement | Gibco | 35050-038 | Component of both Factory and Macrophage media |
| HBSS | Lonza | BE 10-547F | Hank’s balanced salt solution for washing steps |
| Human recombinant BMP4 | Gibco | PHC9534 | Component of Embryoid Body media |
| Human recombinant IL-3 | Gibco | PHC0033 | Component of both Factory and Macrophage media |
| Human recombinant SCF | Miltenyi Biotech | 130-096-695 | Component of Embryoid Body media |
| Human recombinant VEGF | Gibco | PHC9394 | Component of Embryoid Body media |
| Live Cell Imaging Solution | Thermo Fisher | A14291DJ | Phenol red-free HEPES-buffered media for labelling dead SH-SY5Ys |
| Low protein binding 2 mL tubes | Eppendorf | 30108.132 | For staining SH-SY5Ys |
| M-CSF | Thermo Fisher | PHC9501 | Component of both Factory and Macrophage media |
| mTeSR1 Medium | STEMCELL Technologies | 85850 | iPSC media |
| Multichannel 20-200 uL pipette | For liquid handling of 96-well plate | ||
| NucBlue Live ReadyProbes Reagent | Thermo Fisher | R37605 | Hoechst 33342 formulation in a dropper bottle for staining nuclei of iPS-macrophages, use 0.5 drops/mL in Macrophage media. |
| Opera Phenix High-Content Screening System | Perkin Elmer | HH14000000 | High-content imaging microscope, used with Harmony software version 4.9. |
| Penicillin-Streptomycin | Gibco | 15140-122 | Component of Factory, Macrophage, and SH-SY5Y media |
| pHrodo iFL Red STP-Ester | Thermo Fisher | P36011 | pH-sensitive red fluorescent dye for labelling dead SH-SY5Ys. Reconstitute pHrodo iFL Red STP Ester powder in DMSO to a 5 mg/mL concentration. For each 1 million SH-SY5Ys, add 2.5 μL (12.5 μg) of pHrodo iFL Red STP Ester stock to pre-warmed cells suspended in Live Cell Imaging Solution. |
| Serological pipette filler | |||
| T175 flask, tissue culture treated | Vessel for differentiations of iPSC-macrophage precursors, known as "Factories" | ||
| T75 flask | Vessel for SH-SY5Y culture | ||
| Transparent plate sealers | Greiner Bio-One | 676001 | For assay plate storage and transportation |
| TrypLE Express (1X), no phenol red | Gibco | 12604013 | Cell dissociation buffer containing recombinant trypsin-like enzymes and 1.1 mM EDTA, use neat. |
| Water bath, set to 37°C | |||
| X-VIVO 15 Medium with L-glutamine, gentamicin, and phenol red | Lonza | BE04-418F | Component of Factory and Macrophage media |
| X-VIVO 15 Medium with L-glutamine; without gentamicin or phenol red | Lonza | 04-744Q | Phenol red-free macrophage media, for use in phagocytosis without additives or growth factors |
References
- Hochreiter-Hufford, A., Ravichandran, K. S. Clearing the dead: apoptotic cell sensing, recognition, engulfment, and digestion. Cold Spring Harbour Perspectives in Biology. 5, 008748 (2013).
- Freeman, S. A., Grinstein, S. Phagocytosis: receptors, signal integration, and the cytoskeleton. Immunological Reviews. 2262, 193-215 (2014).
- Hickman, S., Izzy, S., Sen, P., Morsett, L., El Khoury, J. Microglia in neurodegeneration. Nature Neuroscience. 21 (10), 1359-1369 (2018).
- Galloway, D. A., Phillips, A. E. M., Owen, D. R. J., Moore, C. S. Phagocytosis in the brain: Homeostasis and disease. Frontiers in Immunology. 10, 790 (2019).
- Nizami, S., Hall-Roberts, H., Warrier, S., Cowley, S. A., Di Daniel, E. Microglial inflammation and phagocytosis in Alzheimer’s disease: potential therapeutic targets. British Journal of Pharmacology. 176 (18), 3515-3532 (2019).
- Hong, S., et al. Complement and microglia mediate early synapse loss in Alzheimer mouse models. Science. 352 (6286), 712-716 (2016).
- Neher, J. J., et al. Inhibition of microglial phagocytosis is sufficient to prevent inflammatory neuronal death. The Journal of Immunology. 186 (8), 4973-4983 (2011).
- Brown, G. C., Neher, J. J. Microglial phagocytosis of live neurons. Nature Reviews Neuroscience. 15 (4), 209-216 (2014).
- Scott-Hewitt, N., et al. Local externalization of phosphatidylserine mediates developmental synaptic pruning by microglia. The EMBO Journal. 39 (16), 105380 (2020).
- Li, T., et al. A splicing isoform of GPR56 mediates microglial synaptic refinement via phosphatidylserine binding. The EMBO Journal. 39 (16), 104136 (2020).
- Sapar, M. L., et al. Phosphatidylserine externalization results from and causes neurite degeneration in Drosophila. Cell Reports. 24 (9), 2273-2286 (2018).
- Skjesol, A., et al. The TLR4 adaptor TRAM controls the phagocytosis of Gram-negative bacteria by interacting with the Rab11-family interacting protein 2. PLOS Pathogens. 15 (3), 1007684 (2019).
- Wong, K., Li, X., Ma, Y. Paraformaldehyde induces elevation of intracellular calcium and phosphatidylserine externalization in platelets. Thrombosis Research. 117 (5), 537-542 (2006).
- van Wilgenburg, B., Browne, C., Vowles, J., Cowley, S. A. Efficient, long term production of monocyte-derived macrophages from human pluripotent stem cells under partly-defined and fully-defined conditions. PLoS One. 8 (8), (2013).
- Haenseler, W., et al. A highly efficient human pluripotent stem cell microglia model displays a neuronal-co-culture-specific expression profile and inflammatory response. Stem Cell Reports. 8 (6), 1727-1742 (2017).
- Buchrieser, J., James, W., Moore, M. D. Human induced pluripotent stem cell-derived macrophages share ontogeny with MYB-independent tissue-resident macrophages. Stem Cell Reports. 8 (2), 334-345 (2017).
- Hall-Roberts, H., et al. TREM2 Alzheimer’s variant R47H causes similar transcriptional dysregulation to knockout, yet only subtle functional phenotypes in human iPSC-derived macrophages. Alzheimer’s Research & Therapy. 12, 151 (2020).
- Friedman, B. A., et al. Diverse brain myeloid expression profiles reveal distinct microglial activation states and aspects of Alzheimer’s disease not evident in mouse models. Cell Reports. 22 (3), 832-847 (2018).
- Aziz, M., Yang, W. L., Wang, P. Measurement of phagocytic engulfment of apoptotic cells by macrophages using pHrodo succinimidyl ester. Current Protocols in Immunology. 100, 1-8 (2013).
- Atmaramani, R., Pancrazio, J. J., Black, B. J. Adaptation of robust Z’ factor for assay quality assessment in microelectrode array based screening using adult dorsal root ganglion neurons. Journal of Neuroscience Methods. 339, 108699 (2020).
- Fernandes, H. J. R., et al. ER Stress and Autophagic Perturbations Lead to Elevated Extracellular α-Synuclein in GBA-N370S Parkinson’s iPSC-Derived Dopamine Neurons. Stem Cell Reports. 6 (3), 342-356 (2016).
- Takahashi, K., Rochford, C. D. P., Neumann, H. Clearance of apoptotic neurons without inflammation by microglial triggering receptor expressed on myeloid cells-2. Journal of Experimental Medicine. 201 (4), 647-657 (2005).
- Kober, D. L., Brett, T. J. TREM2-ligand interactions in health and disease. Journal of Molecular Biology. 429 (11), 1607-1629 (2017).
- Hong, S., et al. Complement and microglia mediate early synapse loss in Alzheimer mouse models. Science. 352 (6286), 712-716 (2016).
- Witting, A., Müller, P., Herrmann, A., Kettenmann, H., Nolte, C. Phagocytic clearance of apoptotic neurons by microglia/brain macrophages in vitro: Involvement of lectin-, integrin-, and phosphatidylserine-mediated recognition. Journal of Neurochemistry. 75 (3), 1060-1070 (2000).
- Hsieh, C. L., et al. A role for TREM2 ligands in the phagocytosis of apoptotic neuronal cells by microglia. Journal of Neurochemistry. 109 (4), 1144-1156 (2009).
- Beccari, S., Diaz-Aparicio, I., Sierra, A. Quantifying microglial phagocytosis of apoptotic cells in the brain in health and disease. Current Protocols in Immunology. 122 (1), 49 (2018).
- Diaz-Aparicio, I., et al. Microglia actively remodel adult hippocampal neurogenesis through the phagocytosis secretome. Journal of Neuroscience. 40 (7), 1453-1482 (2020).
- Shirotani, K., et al. Aminophospholipids are signal-transducing TREM2 ligands on apoptotic cells. Scientific Reports. 9 (1), 1-9 (2019).
- Garcia-Reitboeck, P., et al. Human induced pluripotent stem cell-derived microglia-like cells harboring TREM2 missense mutations show specific deficits in phagocytosis. Cell Reports. 24 (9), 2300-2311 (2018).

