एक्सट्रासेलुलर वेसिकल्स के क्वांटिफिकेशन और आकार निर्धारण के लिए नैनोपार्टिकल ट्रैकिंग विश्लेषण
Summary
हम माउस पेरिगोनाडल एडीपोज ऊतक और मानव प्लाज्मा से अलग किए गए आकार वितरण और बाह्यसील वेसिकल के कुल कण एकाग्रता का अनुमान लगाने के लिए एक उपन्यास नैनोपार्टिकल ट्रैकिंग विश्लेषण उपकरण का उपयोग कैसे करते हैं।
Abstract
एक्सट्रासेलुलर वेसिकल्स (ईवीएस) की शारीरिक और रोगविज्ञानी भूमिकाएं तेजी से पहचानी जा चुकी हैं, जिससे ईवी क्षेत्र अनुसंधान का एक त्वरित रूप से विकसित होता है। ईवी अलगाव के लिए कई अलग-अलग तरीके हैं, प्रत्येक में अलग-अलग फायदे और नुकसान हैं जो ईवी की डाउनस्ट्रीम उपज और शुद्धता को प्रभावित करते हैं। इस प्रकार, एक चुने हुए विधि द्वारा दिए गए स्रोत से अलग ईवी तैयारी की विशेषता डाउनस्ट्रीम परिणामों की व्याख्या और प्रयोगशालाओं में परिणामों की तुलना के लिए महत्वपूर्ण है। ईवीएस के आकार और मात्रा का निर्धारण करने के लिए विभिन्न तरीके मौजूद हैं, जिन्हें रोग राज्यों द्वारा या बाहरी परिस्थितियों के जवाब में बदला जा सकता है। नैनोपार्टिकल ट्रैकिंग विश्लेषण (एनटीए) व्यक्तिगत ईवीएस के उच्च-थ्रूपुट विश्लेषण के लिए उपयोग की जाने वाली प्रमुख प्रौद्योगिकियों में से एक है। यहां, हम इस क्षेत्र में प्रमुख प्रगति का प्रतिनिधित्व करने वाली एनटीए के लिए एक सफलता प्रौद्योगिकी का उपयोग करके माउस पेरिगोनाडल एडिपोस ऊतक और मानव प्लाज्मा से अलग ईवीएस के परिमाणीकरण और आकार निर्धारण के लिए एक विस्तृत प्रोटोकॉल प्रस्तुत करते हैं। परिणाम दर्शाते हैं कि यह विधि विभिन्न तरीकों का उपयोग करके विभिन्न स्रोतों से अलग ईवीएस के लिए प्रजनन योग्य और वैध कुल कण एकाग्रता और आकार वितरण डेटा प्रदान कर सकती है, जैसा कि ट्रांसमिशन इलेक्ट्रॉन माइक्रोस्कोपी द्वारा पुष्टि की गई है। एनटीए के लिए इस उपकरण के अनुकूलन से ईवी अनुसंधान में कठोरता और प्रजनन क्षमता बढ़ाने के लिए एनटीए विधियों में मानकीकरण की आवश्यकता का समाधान होगा ।
Introduction
एक्सट्रासेलुलर वेसिकल्स (ईवीएस) छोटे (0.03-2 माइक्रोन) झिल्ली से बंधे वेसिकल्स हैं जो लगभग सभी सेल प्रकार1द्वारा स्रावित होते हैं। उन्हें अक्सर रिलीज और आकार 2 के उनके तंत्र के आधार पर “एक्सोसोम्स,” “माइक्रोवेसिकल्स” या “एपोप्टिक बॉडी” के रूप में जानाजाताहै। हालांकि शुरू में यह सोचा गया था कि ईवीएस बस होम्योपैथी3को बनाए रखने के लिए सेल से कचरे को नष्ट करने का एक साधन था, अब हम जानते हैं कि वे डीएनए, आरएनए (एमआरएनए, माइक्रोआरएनए), लिपिड, और प्रोटीन4,5 सहित आणविक सामग्री के हस्तांतरण के माध्यम से अंतरकोशिकीय संचार में भी भाग ले सकते हैं – और वे सामान्य शरीर विज्ञान के साथ-साथ पैथोलॉजिकल प्रक्रियाओं के महत्वपूर्ण नियामक हैं1, 5,6,7,8.
ईवीएस को अलग-थलग करने और मात्रा निर्धारित करने के लिए कई अलग-अलग तरीके हैं, जिन्हें कहीं और9,10,11,12वर्णित किया गया है। अलगाव प्रोटोकॉल के रूप में के रूप में अच्छी तरह से EVs के स्रोत का इस्तेमाल किया बहुत EV उपज और शुद्धता को प्रभावित कर सकते हैं । यहां तक कि अंतर अपकेंद्रित्र, लंबे समय से एक्सोसोम अलगाव के लिए “सोने के मानक” दृष्टिकोण माना जाता है, पर्याप्त परिवर्तनशीलता के अधीन किया जा सकता है बाद में प्राप्त EV आबादी को प्रभावित करने और डाउनस्ट्रीम विश्लेषण13। इस प्रकार, ईवी अलगाव और मात्राकरण के विभिन्न विभिन्न तरीकों से साहित्य में सूचित प्रयोगों के परिणामों की तुलना करना, पुन: पेश करना और व्याख्या करना मुश्किल होजाताहै। इसके अलावा, ईवी रिलीज को सेलुलर स्थितियों या विभिन्न बाहरी कारकों द्वारा विनियमित किया जा सकता है। यह सुझाव दिया गया है कि ईवीएस इंट्रासेलुलर तनाव15के खिलाफ कोशिकाओं की रक्षा करके सेलुलर होमोस्टेसिस को बनाए रखने में भूमिका निभाते हैं, क्योंकि कई अध्ययनों से पता चला है कि सेलुलर तनाव ईवी स्राव को उत्तेजित करता है। उदाहरण के लिए, हाइपोक्सिया, एंडोप्लाज्मिक रेटिकुलम तनाव, ऑक्सीडेटिव तनाव, यांत्रिक तनाव, सिगरेट के धुएं के निकालने और कण पदार्थ वायुप्रदूषण16, 17,18,19,20,21, 22के सेलुलर एक्सपोजर के बाद बढ़ी हुई ईवी रिलीज की सूचना दी गई है। ईवी रिलीज को भी वीवो में संशोधित किया गया है; चूहों एक उच्च वसा आहार या सोलह घंटे के लिए उपवास के अधीन अधिक adipocyte EVs23जारी . यह जांचने के लिए कि क्या कोई विशिष्ट उपचार या स्थिति ईवी रिलीज को बदल देती है, ईवीएस की संख्या सही रूप से निर्धारित की जानी चाहिए। ईवी आकार वितरण का आकलन भी ईवीएस के प्रमुख उपकोशिकीय मूल का संकेत हो सकता है (उदाहरण के लिए, प्लाज्मा झिल्ली बनाम प्लाज्मा झिल्ली के नवोदित के साथ देर से एंडोसोम/मल्टीवेस्कुलर निकायों का संलयन)24। इस प्रकार, कुल एकाग्रता और ईवी प्रेप के आकार वितरण का अध्ययन करने के लिए सटीक रूप से मापने के लिए मजबूत तरीकों की आवश्यकता है।
समाधान में ईवीएस के विज़ुअलाइज़ेशन और लक्षण वर्णन के लिए एक तेजी से और अत्यधिक संवेदनशील तरीका नैनोपार्टिकल ट्रैकिंग विश्लेषण (एनटीए) है। इस विधि के सिद्धांतों और ईवी आकार और एकाग्रता के आकलन के लिए वैकल्पिक तरीकों से तुलना की विस्तृत व्याख्या पहले25 , 26,27,28बताई गई है . संक्षेप में, एनटीए माप के दौरान, ईवीएस को लेजर बीम के साथ विकिरणित होने पर बिखरे हुए प्रकाश द्वारा कल्पना की जाती है। बिखरे हुए प्रकाश एक कैमरे पर एक माइक्रोस्कोप द्वारा केंद्रित है जो कण आंदोलन को रिकॉर्ड करता है। एनटीए सॉफ्टवेयर प्रत्येक कण की यादृच्छिक थर्मल गति को ट्रैक करता है, जिसे ब्राउनियन मोशन के नाम से जाना जाता है, प्रसार गुणांक का निर्धारण करने के लिए जो स्टोक्स-आइंस्टीन समीकरण का उपयोग करके प्रत्येक कण के आकार की गणना करने के लिए उपयोग किया जाता है। एनटीए को सबसे पहले 201125में जैविक नमूने में ईवीएस के मापन के लिए लागू किया गया था । हाल ही में जब तक, व्यूसाइजर 3000(इसके बाद कण ट्रैकिंग उपकरण के रूप में संदर्भित) की शुरूआत तक वाणिज्यिक एनटीए उपकरणों की पेशकश करने वाली केवल दो मुख्यधारा की कंपनियां थीं, जो अन्य एनटीए तकनीकों की महत्वपूर्ण सीमाओं को दूर करने के लिए उपन्यास हार्डवेयर और सॉफ्टवेयर समाधानों के संयोजन का उपयोग करती हैं।
कण ट्रैकिंग उपकरण उनके ब्राउनियन गति का विश्लेषण करके तरल नमूनों में नैनोकणों की विशेषता है और गुरुत्वाकर्षण बसने का विश्लेषण करके बड़े माइक्रोन आकार के कणों की विशेषता है । इस उपकरण की अनूठी ऑप्टिकल प्रणाली, जिसमें तीन लेजर प्रकाश स्रोतों (450 एनएम, 520 एनएम और 635 एनएम) के साथ बहुस्पेक्ट्रल रोशनी शामिल है, शोधकर्ताओं को एक साथ कण आकार (जैसे, एक्सोसोम्स, माइक्रोवेसिकल्स) की एक विस्तृत श्रृंखला का विश्लेषण करने की अनुमति देता है। चित्र 1 में इंस्ट्रूमेंट सेटअप का एक योजनाबद्ध दिखायागया है ।
यहां, हम एक उपन्यास एनटीए उपकरण का उपयोग करके अलग माउस और मानव ईवीएस के कण आकार वितरण और एकाग्रता माप का प्रदर्शन कैसे करते हैं।
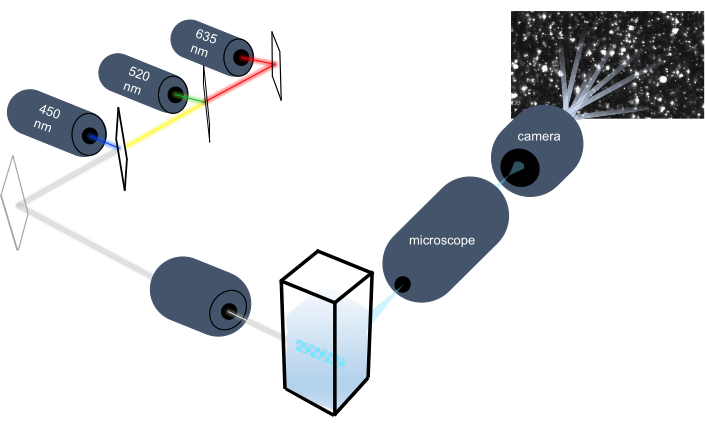
चित्रा 1:कण ट्रैकिंग उपकरण ऑप्टिकल प्रणाली। एनटीए उपकरण निम्नलिखित तरंगदैर्ध्य के साथ तीन लेजर का उपयोग करके कणों को रोशन करता है: 450 एनएम, 520 एनएम, 635 एनएम। अलग-अलग कणों से बिखरे हुए प्रकाश की वीडियो रिकॉर्डिंग का पता लगाया जाता है और क्यूवेट से 90 डिग्री उन्मुख डिजिटल वीडियो कैमरा द्वारा ट्रैक किया जाता है। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें ।
Protocol
Representative Results
Discussion
यहां, हम एक साथ कण आकार की एक विस्तृत श्रृंखला के आकार वितरण को मापने और एक पॉलीडिसपर्स नमूने में कुल ईवी एकाग्रता को मापने के लिए ईवीएस के एनटीए के लिए एक प्रोटोकॉल प्रदर्शित करते हैं। इस अध्ययन में, मा?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
इस काम को राष्ट्रीय स्वास्थ्य संस्थान (ES030973-01A1, R01ES025225, R01DK066525, P30DK026687, P30DK063608) द्वारा समर्थित किया गया था। हम जेफरी Bodycomb, HORIBA उपकरणों के पीएचडी स्वीकार करते है उसकी मदद के लिए शामिल उपकरण अंशांकन ।
Materials
| 1X dPBS | VWR | 02-0119-1000 | To dilute samples |
| 100 nm bead standard | Thermo Scientific | 3100A | To test ViewSizer 3000 calibration |
| 400 nm bead standard | Thermo Scientific | 3400A | To test ViewSizer 3000 calibration |
| Centrifugal Filter Unit | Amicon | UFC901024 | To filter PBS diluent |
| Collection tubes, 2 mL | Qiagen | 19201 | For isolation of human plasma extracellular vesicles |
| Compressed air duster | DustOff | DPSJB-12 | To clean cuvettes |
| Cuvette insert | HORIBA Scientific | – | Provided with purchase of ViewSizer 3000 |
| Cuvette jig | HORIBA Scientific | – | To align magnetic stir bar while placing inserts inside cuvette; Provided with purchase of ViewSizer 3000 |
| De-ionized water | VWR | 02-0201-1000 | To clean cuvettes |
| Desktop computer with monitor, keyboard, mouse, and all necessary cables | Dell | – | Provided with purchase of ViewSizer 3000 |
| Ethanol (70-100%) | Millipore Sigma | – | To clean cuvettes |
| ExoQuick ULTRA | System Biosciences | EQULTRA-20A-1 | For isolation of human plasma extracellular vesicles |
| Glass scintillation vials with lids | Thermo Scientific | B780020 | To clean cuvettes |
| "Hook" tool | Excelta | – | Provided with purchase of ViewSizer 3000 |
| Lint-free microfiber cloth | Texwipe | TX629 | To clean cuvettes and cover work surface |
| Microcentrifuge tubes, 2 mL | Eppendorf | 22363344 | For isolation of human plasma extracellular vesicles |
| Stir bar | Sp Scienceware | F37119-0005 | |
| Suprasil Quartz cuvette with cap | Agilent Technologies | AG1000-0544 | Initially provided with purchase of ViewSizer 3000 |
| ViewSizer 3000 | HORIBA Scientific | – | Nanoparticle tracking instrument |
References
- Colombo, M., Raposo, G., Théry, C. Biogenesis, secretion, and intercellular interactions of exosomes and other extracellular vesicles. Annual Review of Cell and Developmental Biology. 30, 255-289 (2014).
- Hessvik, N. P., Llorente, A. Current knowledge on exosome biogenesis and release. Cellular and molecular life sciences: CMLS. 75, 193-208 (2018).
- Johnstone, R. M., Adam, M., Hammond, J. R., Orr, L., Turbide, C. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes). The Journal of Biological Chemistry. 262, 9412-9420 (1987).
- Théry, C., Ostrowski, M., Segura, E. Membrane vesicles as conveyors of immune responses. Nature Reviews Immunology. 9, 581-593 (2009).
- Yáñez-Mó, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066 (2015).
- Lo Cicero, A., Stahl, A., Raposo, G. Extracellular vesicles shuffling intercellular messages: for good or for bad. Current Opinion in Cell Biology. 35, 69-77 (2015).
- Raposo, G., Stoorvogel, W. Extracellular vesicles: exosomes, microvesicles, and friends. The Journal of Cell Biology. 200, 373-383 (2013).
- Mathivanan, S., Ji, H., Simpson, R. J. Exosomes: extracellular organelles important in intercellular communication. Journal of Proteomics. 73, 1907-1920 (2010).
- Zhang, M., et al. Methods and technologies for exosome isolation and characterization. Small Methods. 2, 1800021 (2018).
- Szatanek, R., et al. The methods of choice for extracellular vesicles (EVs) characterization. International Journal of Molecular Sciences. 18, (2017).
- Erdbrügger, U., Lannigan, J. Analytical challenges of extracellular vesicle detection: A comparison of different techniques. Cytometry. Part A: The Journal of the International Society for Analytical Cytology. 89, 123-134 (2016).
- Konoshenko, M. Y., Lekchnov, E. A., Vlassov, A. V., Laktionov, P. P. Isolation of Extracellular Vesicles: General Methodologies and Latest Trends. BioMed Research International. 2018, 1-27 (2018).
- Cvjetkovic, A., Lötvall, J., Lässer, C. The influence of rotor type and centrifugation time on the yield and purity of extracellular vesicles. Journal of Extracellular Vesicles. 3, (2014).
- Taylor, D. D., Shah, S. Methods of isolating extracellular vesicles impact down-stream analyses of their cargoes. Methods. 87, 3-10 (2015).
- Desdín-Micó, G., Mittelbrunn, M. Role of exosomes in the protection of cellular homeostasis. Cell Adhesion & Migration. 11, 127-134 (2017).
- Kanemoto, S., et al. Multivesicular body formation enhancement and exosome release during endoplasmic reticulum stress. Biochemical and Biophysical Research Communications. 480, 166-172 (2016).
- Benedikter, B. J., et al. Cigarette smoke extract induced exosome release is mediated by depletion of exofacial thiols and can be inhibited by thiol-antioxidants. Free Radical Biology & Medicine. 108, 334-344 (2017).
- Saeed-Zidane, M., et al. Cellular and exosome mediated molecular defense mechanism in bovine granulosa cells exposed to oxidative stress. PloS One. 12, 0187569 (2017).
- Wang, K., et al. Mechanical stress-dependent autophagy component release via extracellular nanovesicles in tumor cells. ACS Nano. 13, 4589-4602 (2019).
- King, H. W., Michael, M. Z., Gleadle, J. M. Hypoxic enhancement of exosome release by breast cancer cells. BMC Cancer. 12, 421 (2012).
- Bonzini, M., et al. Short-term particulate matter exposure induces extracellular vesicle release in overweight subjects. Environment Research. 155, 228-234 (2017).
- Neri, T., et al. Particulate matter induces prothrombotic microparticle shedding by human mononuclear and endothelial cells. Toxicology In Vitro. 32, 333-338 (2016).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363, 989-993 (2019).
- van Niel, G., D’Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19, 213-228 (2018).
- Dragovic, R. A., et al. Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis. Nanomedicine: Nanotechnology, Biology, and Medicine. 7, 780-788 (2011).
- Saveyn, H., et al. Accurate particle size distribution determination by nanoparticle tracking analysis based on 2-D Brownian dynamics simulation. Journal of Colloid and Interface Science. 352, 593-600 (2010).
- Vander Meeren, P., Kasinos, M., Saveyn, H. Relevance of two-dimensional Brownian motion dynamics in applying nanoparticle tracking analysis. Methods in Molecular Biology. , 525-534 (2012).
- Filipe, V., Hawe, A., Jiskoot, W. Critical evaluation of Nanoparticle Tracking Analysis (NTA) by NanoSight for the measurement of nanoparticles and protein aggregates. Pharmaceutical Research. 27, 796-810 (2010).
- Bachurski, D., et al. Extracellular vesicle measurements with nanoparticle tracking analysis – An accuracy and repeatability comparison between NanoSight NS300 and ZetaView. Journal of Extracellular Vesicles. 8, 1596016 (2019).
- Varga, Z., et al. Hollow organosilica beads as reference particles for optical detection of extracellular vesicles. Journal of Thrombosis and Haemostasis. 16, 1646-1655 (2018).
- Serrano-Pertierra, E., et al. Extracellular vesicles: Current analytical techniques for detection and quantification. Biomolecules. 10, (2020).
- Maguire, C. M., Rösslein, M., Wick, P., Prina-Mello, A. Characterisation of particles in solution – a perspective on light scattering and comparative technologies. Science and Technology of Advanced Materials. 19, 732-745 (2018).
- Bohren, C. F., Huffman, D. R. . Absorption and Scattering of Light by Small Particles. , (1983).

