Mätning av tidsutvecklingen av nanoskala material med stoppat flöde och liten vinkel neutronspridning
Summary
Detta protokoll presenterar användningen av en provmiljö med stoppat flöde för att snabbt blanda flera flytande lösningar in situ under en neutronspridningsmätning med liten vinkel och för att studera kinetiska processer på nanometerlängdskalor och andra tidsskalor.
Abstract
Detta dokument presenterar användningen av en SANS-provmiljö (Stoped-Flow-Small Angle Neutron-Scattering) för att snabbt blanda vätskeprover och studera kinetiska processer i nanoskala på tidsskalor från sekunder till minuter. Provmiljön med stoppat flöde använder kommersiellt tillgängliga sprutpumpar för att blanda de önskade volymerna av vätskeprover som sedan injiceras genom en dynamisk mixer i en kvartsglascell på cirka 1 s. Tidsupplöst SANS-datainsamling synkroniseras med provblandningen för att följa utvecklingen av nanostrukturen i lösning efter blandning.
För att utnyttja neutronstråletiden så effektivt som möjligt använder vi en serie flödesväljarventiler för att automatiskt ladda, skölja och torka cellen mellan mätningarna, vilket möjliggör upprepad datainsamling under flera provinjektioner. Provinjektionerna upprepas tills tillräcklig neutronspridningsstatistik har samlats in. Blandningsuppställningen kan programmeras för att systematiskt variera förhållandena för att mäta kinetiken vid olika blandningsförhållanden, provkoncentrationer, additiva koncentrationer och temperaturer. Den minsta provvolym som krävs per injektion är cirka 150 μl beroende på kvartscellens väglängd.
Representativa resultat med användning av denna stoppade flödesprovmiljö presenteras för snabb lipidutbyteskinetik i närvaro av en tillsats, cyklodextrin. Vesiklarna utbyter yttre (yttre) lipider i storleksordningen sekunder och utbyter fullständigt både inre och yttre lipider inom några timmar. Mätning av lipidutbyteskinetik kräver in situ-blandning för att fånga de snabbare (sekunder) och långsammare (minuter) processerna och extrahera de kinetiska hastighetskonstanterna. Samma provmiljö kan också användas för att undersöka molekylärt utbyte i andra typer av flytande prover såsom lipidnanopartiklar, proteiner, ytaktiva ämnen, polymerer, emulsioner eller oorganiska nanopartiklar. Mätning av strukturella omvandlingar och kinetik på nanonivå för utbyte eller reaktion av system kommer att ge nya insikter i processer som utvecklas på nanoskalan.
Introduction
Småvinkelneutronspridning (SANS) ger ett unikt sätt att mäta storlekar, former, interaktioner och organisation av olika material på längdskalor från ≈1 nm till ≈100 nm 1,2,3. Nya instrument, inklusive VSANS-instrument (mycket liten vinkel neutronspridning) med fokuseringsspeglar, tänjer på gränserna för att mäta ännu större längdskalor upp till ≈1000 nm 4,5. I allmänhet erbjuder den unika spridningskontrasten som är inneboende i neutronspridningsmetoder flera fördelar vid mätning av tidsutvecklingen av nanostrukturer, såsom aggregering av komponenter i farmaceutiska formuleringar6, tvärbindning och geleringsreaktioner i polymersystem7,8, i mesokristallisation av membranproteiner9,10, nedbrytning och utveckling av proteiner11,12 och tillväxt av kiseldioxidbaserade material13,14,15. Den unika spridningskontrasten gör tidsupplösta SANS (TR-SANS) till ett användbart komplement till andra stoppade flödesbaserade mätningar.
Stoppade flödesblandningsmetoder implementeras ofta i röntgenspridning med liten vinkel (SAXS)16,17,18,19,20,21, fluorescensspektroskopi 22,23,24,25,26 och ljusspridning27,28,29,30, 31,32 experiment för att studera kinetiska processer på millisekundskalorna. En viktig skillnad mellan SANS och SAXS är att neutronspridning är en icke-destruktiv karakteriseringsteknik, och som sådan kan SANS användas för att mäta samma prov i timmar eller till och med dagar utan joniserande strålningsskador på provet, vilket kan hända under röntgenspridningsexperiment med högre flöde33. Eftersom upprepade SANS-mätningar inte kommer att förändra den kemiska strukturen hos sondmolekylen eller provet, kan tidsutvecklingen studeras utan effekter av till exempel fotoblekning, vilket kan komplicera kinetiska mätningar som är beroende av fluorescens23,24. Dessutom kan SANS användas för att mäta högkoncentrerade och optiskt ogenomskinliga prover som ofta är svåra att karakterisera med ljusbaserade tekniker som dynamisk ljusspridning.
Förutom att tillhandahålla strukturell information om nanoskalan kan SANS användas för att undersöka den lokala sammansättningen av dessa strukturer genom variationen i neutronspridningslängdtäthetskontrast. Spridningslängdtätheten (SLD) för olika element varierar slumpmässigt över det periodiska systemet och varierar med olika isotoper av samma element. Ett vanligt utnyttjat exempel är väte (1H eller H) och deuterium (2H eller D), som har väldigt olika neutronspridningslängder. Därför kan väterika material, såsom ytaktiva ämnen, lipider, proteiner, RNA, DNA och andra polymerer, särskiljas från deutererade lösningsmedel med användning av SANS utan att väsentligt förändra systemets fysikaliska egenskaper. Det är dock viktigt att notera att H / D-utbyte kan påverka densiteten, vätebindningen och fasövergångstemperaturerna i provet. Ändå är SANS unika känslighet för väterika material särskilt användbar i forskning om mjuk materia där proverna av intresse har lägre spridningskontrast och signal i röntgenbaserade tekniker som SAXS. Isotopsubstitution gör också SANS till ett kraftfullt verktyg för att studera molekylär utbyteskinetik i väterika material genom att helt enkelt blanda H-märkta och D-märkta molekyler. Isotopsubstitution är särskilt användbar i system där skrymmande fluorescerande färgämnen är större än tensiden eller lipidmolekylerna av intresse och kan påverka utbyteskinetiken34,35.
Tidsupplösta SANS-mätningar är fördelaktiga eftersom den uppmätta intensiteten är en funktion av tid, längdskala och SLD-kontrast. Som sådan kan TR-SANS-experiment utformas för att undersöka de tidsberoende förändringarna i de rumsliga fördelningarna och provernas kompositioner. Dessa unika fördelar med SANS har lett till viktiga insikter i kinetiska processer i många mjuka materialsystem såsom ytaktiva ämnen 36,37,38, emulsioner 39,40,41, lipider 34,42,43,44,45,46,47,48,49 ,50 och polymerer 51,52,53,54,55,56,57,58,59,60,61,62. De flesta TR-SANS-studier har fokuserat på tidsskalor från minuter till timmar. Många kinetiska processer av intresse sker dock på den andra tidsskalan och är väsentliga för att förstå de underliggande mekanismerna. Att fånga dessa tidiga tidpunkter kräver att lösningarna snabbt blandas och mäts in situ, där blandningen synkroniseras med datainsamling under ljusspridning med stoppflöde 27,28,29,30,31,32, fluorescens 22,23,24,25,26 och röntgen 16,17,18,19,20,21 experiment. Detta arbete beskriver användningen av en provmiljö utformad för att snabbt blanda flera vätskeprover och injicera blandningen i en kvartsglascell för TR-SANS-mätningar. Blandningsanordningen är en anpassning av den nyligen utvecklade kapillär-reoSANS-enheten63 och använder flera sprutpumpar och ventiler för att styra provblandningen och för att automatisera cellrengöringen. Genom att ansluta sprutpumpar till en serie flödesväljarventiler kan flera inloppsströmmar blandas, mätas, sköljas och torkas upprepade gånger för att underlätta TR-SANS-mätningar på sekundens tidsskala.
Det nuvarande förfarandet förutsätter att proverna av intresse har identifierats och förberetts. Vi fokuserar på in situ-blandningsinställningen och metoder för att samla in TR-SANS-data. Neutronspridningsdata samlades in på VSANS-instrumentet vid NIST Center for Neutron Research (NCNR); Förfarandet bör dock vara tillämpligt på andra SANS-instrument. Läsare som är intresserade av att implementera liknande protokoll på andra SANS-instrument bör rådgöra med de lokala instrumentforskarna för att bestämma den optimala instrumentkonfigurationen för att maximera neutronflödet vid önskad längdskala och tidsskala som är mest relevant för de kinetiska processerna av intresse. Data som presenteras här samlades in med hjälp av högflödeskonfigurationen “vit stråle” på VSANS för att maximera neutronantalet vid förlust av rumslig upplösning5. Detektorvagnarna placerades för att täcka en rad spridningsvektorer (q), 0,005 Å-1 < q < 0,5 Å-1, motsvarande längdskalor från ≈130 nm till ≈13 nm. Spridningsvektorn definieras som q = 4π / λ sin (θ / 2) där λ är neutronvåglängden och θ är spridningsvinkeln.
Den stoppade flödesblandningsanordning som används för TR-SANS-mätningarna består av flera pumpar, sköljsprutor, provsprutor, flödesväljare samt adynamisk blandare, provcell och blandad provbehållare, såsom visas i figur 1. Alla förseglade vätskevägar är placerade inuti ett luftkonditionerat hölje, som inkluderar sprutor, ventiler, anslutningsslangar, dynamisk mixer och provceller. En programmerbar termoelektrisk luftkonditionering används för att styra kapslingstemperaturen i området från 10 °C till 50 °C inom ±1 °C. Observera att en del av höljesisoleringen togs bort för att visa enhetens arbetsdelar. Huvudblandningsanordningens hölje är placerat på ett translationellt steg på NG3 VSANS strållinje vid NCNR. Kapslingens position justeras med hjälp av translationssteget för att placera provcellen i neutronstrålens väg (gul streckad linje).

Figur 1: En exempeluppsättning för att kombinera mätningar av stoppad flödesblandning och neutronspridning med liten vinkel vid VSANS-strålröret vid NIST Center for Neutron Research. Uppställningen innehåller fyra sprutpumpar, två sprutor för sköljning av spädningsvätska och två sprutor för provinjektion, fyra pumpväljarventiler, två blandarväljarventiler, en dynamisk blandare, en genomströmningskvartscell och en blandad provbehållare. Infallande neutroner sprids från det blandade provet som finns inuti provcellen. Ett isolerat hölje med kvartsfönster och en termoelektrisk luftkonditionerad enhet används för att styra provet och all utrustning vid konstant temperatur. Den gula streckade linjen visar neutronstrålens väg. Skalstång = 10 cm. Klicka här för att se en större version av denna figur.
Enheten som visas i figur 1 är konfigurerad med två provsprutor, två sköljsprutor och en provcell. Motsvarande flödesscheman för de olika stegen i protokollet illustreras i figur 2. De önskade volymerna av de två olika proverna injiceras i blandaren och provcellen (figur 2A). När provcellen är fylld stängs inloppsomkopplarventilen (ISV) och utloppsomkopplarventilen (OSV) för att isolera provcellen från den dynamiska blandaren och för att förhindra att provet sprids tillbaka in i cellen under TR-SANS-datainsamlingen (figur 2B). Före den dynamiska blandaren varierar anslutningsslangen i längd från 10 cm till 1 m och påverkar inte blandningsfördröjningstiden. Slanganslutningar mellan den dynamiska blandaren och provcellen påverkar dock blandningsfördröjningstiden och den erforderliga provinjektionsvolymen. Förskurna rör av rostfritt stål med innerdiameter på 0,04 tum (1 mm) och längd på 100 mm används för att ansluta den dynamiska blandaren, blandarväljarventilerna (MSV1 och MSV2) och ISV och OSV. Fluorerade rör med 1 mm innerdiameter och 115 mm längd används för att ansluta ISV och OSV (eller det dynamiska blandarutloppet) till provcellen. Den totala hålrumsvolymen som påverkar blandningsfördröjningstiden inkluderar blandarens tomrumsvolym (0,15 ml), slangen mellan blandarens utlopp och provcellens inlopp (0,09 ml) och provcellens volym (0,16 ml). I det här exemplet är den totala tomrumsvolymen 0,4 ml. Ventilernas inre hålrumsvolymer är försumbara jämfört med hålrumsvolymerna för slangar, blandare och provceller. Till exempel innehåller de använda lågtrycksväljarventilerna (0,75 mm håldiameter) ungefärliga tomrumsvolymer på 4 μL, medan högtrycksväljarventilerna och omkopplingsventilerna (0,25 mm håldiameter) innehåller ungefärliga hålrumsvolymer på 0,5 μl.
När TR-SANS-mätningen är klar trycks provet ut ur cellen med lösningsmedel och sköljvätska pumpas upprepade gånger genom cellen för att avlägsna restprovet och rengöra provcellen (figur 2C). Observera att sköljsprutorna är anslutna till större lösningsmedelsbehållare (t.ex. vatten och etanol) via pumpväljarvärden för att säkerställa att tillräckliga lösningsmedelsvolymer finns tillgängliga för att rengöra provcellen mellan mätkörningarna. Lösningsmedelskällor, provkällor och blandade provbehållare som innehåller brandfarliga vätskor placeras i ett separat hölje utan elektrisk utrustning för att eliminera alla möjliga antändningskällor. Dessutom används ånglåsande flasklock för att minimera brandfarliga ångor och lösningsmedelsindunstning. Slutligen torkas provcellen med en kvävgasström för att avlägsna det kvarvarande sköljlösningsmedlet (figur 2D). Kvävgastrycket till blandarväljarventilen regleras till cirka 2 bar (0,2 MPa, övertryck) med hjälp av en manuell tryckregulator placerad på kvävgasflaskan. När provcellen har rengjorts och torkats tillräckligt injiceras ett nyblandat prov i provcellen för nästa mätcykel (blandning och injektion upprepas som illustreras i flödesschemat i figur 2A).
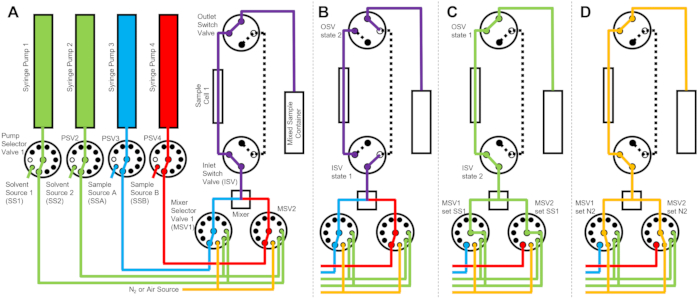
Figur 2: Exempel på flödesdiagram med en provcell, två provblandningar och två sköljmedel för rengöring . a) Blandning av prov A (blått) och prov B (rött) och sedan flöde av det blandade provet (lila) in i provcellen. (B) Under datainsamlingen, tillståndet för stoppflödesanordningen där ISV- och OSV-omkopplingsventilerna är stängda för att isolera provcellen och förhindra återspridning av provet under datainsamlingen. (C) Rengöringsstegen där provcellen sköljs med sköljvätska från SS1 (grön) efter datainsamling. d) Torkningssteg där provcellen torkas med kvävgas (orange). Förkortningar: PSV = pumpväljarventil; MSV = blandarväljarventil; OSV = utloppsbrytare; ISV = inloppsventil; SS1 = lösningsmedelskälla 1; SSA = provkälla A; N2 = kvävgaskälla. Klicka här för att se en större version av denna figur.
Figur 3 visar flödesscheman för en något annorlunda version där blandningsinställningen konfigureras med två separata provceller anslutna till samma omkopplingsventiler (figur 3A). Medan TR-SANS-data samlas in i provcell 1 sköljs provcell 2 (figur 3B) och torkas (figur 3C). När datainsamlingen är klar för provcell 1 dirigerar inloppsbrytarventilen ett nyblandat prov till provcell 2 för datainsamling (figur 3D). Medan TR-SANS-data samlas in i provcell 2 sköljs och torkas provcell 1 (figur 3E). Denna alternerande, parallella process mellan två provceller minimerar tiden mellan efterföljande provinjektioner och maximerar användningen av neutronstråletid.
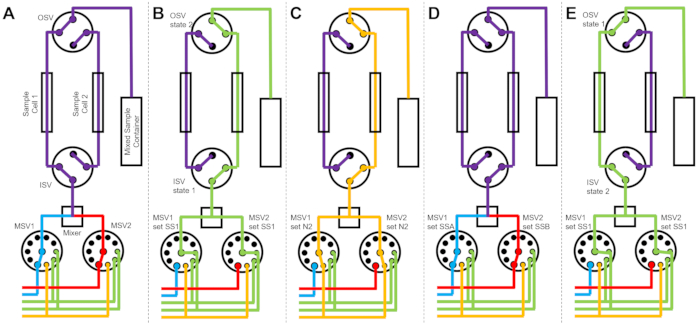
Figur 3: Exempel på flödesschema med två provceller, två provblandningar och två sköljmedel för rengöring. A) Blanda prov A (blått) och prov B (rött) och sedan flöda det blandade provet (lila) in i provcell 1. (B) Stoppflödesanordningens tillstånd under datainsamling på provcell 1 medan provcell 2 sköljs med lösningsmedel från SS1 (grön). (C) Stoppflödesanordningens tillstånd under datainsamlingen på provcell 1 medan provcell 2 torkas med kvävgas (orange). (D) När datainsamlingen av provcell 1 är klar blandas omedelbart ett nytt prov (lila) och flödas in i provcell 2. (E) Stoppflödesanordningens tillstånd under datainsamling på provcell 2 medan provcell 1 sköljs med lösningsmedel från SS1 (grön). Medan en provcell mäts rengörs och torkas den andra provcellen. Stoppflödesmätningsprocessen växlar mellan två provceller för att minimera tiden mellan efterföljande provblandningsinjektioner. Förkortningar: PSV = pumpväljarventil; MSV = blandarväljarventil; OSV = utloppsbrytare; ISV = inloppsventil; SS1 = lösningsmedelskälla 1; SSA = provkälla A; N2 = kvävgaskälla. Klicka här för att se en större version av denna figur.
Ett steg-för-steg-protokoll beskrivs nedan för anslutning av pumpar och slangledningar, grundning av systemet, sköljning och torkning av provcellen och injektion av det blandade provet. Även om encellskonfigurationen demonstreras för enkelhetens skull (figur 2) kan den flexibla modulära installationen, protokollet och skripten enkelt modifieras för att implementera fler sprutpumpar, ventiler, blandare eller provcellkonfigurationer, såsom cellkonfigurationen med två prover som visas i figur 3. Representativa råa neutronräkningshastighetsdata som samlats in under blandnings- och rengöringsinjektionscyklerna visas i figur 4, medan lipidutbyteskinetiken mätt vid 3 olika temperaturer och den extraherade normaliserade spridda intensiteten motsvarande fraktionen av utbytta lipider visas i figur 5 respektive figur 6.
Protocol
Representative Results
Discussion
Den aktuella proceduren beskriver blandningsanordningen och stegen för att utföra TR-SANS-mätningar med stoppat flöde. Enheten och protokollet är optimerade för vätskeprover med låg viskositet där tidsskalorna av intresse är ≈1 s till 5 min. För tidsskalor större än 5 minuter kan det vara enklare och önskvärt att manuellt blanda proverna och ladda dem i vanliga spridningsceller, särskilt för högviskositetsprover, geler eller pastor. Åtkomst till tidsskalor mindre än 1 s kräver en annan blandningsap…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Tillgång till NG3 VSANS tillhandahölls av Center for High-Resolution Neutron Scattering, ett partnerskap mellan National Institute of Standards and Technology och National Science Foundation enligt avtal nr. DMR-2010792. M.H.L.N erkänner finansieringen från Mitacs Globalink (Kanada). Identifieringen av kommersiella produkter eller handelsnamn är att främja förståelse och innebär inte godkännande eller rekommendation från National Institute of Standards and Technology.
Materials
| Dynamic mixer | Analytical Scientific Instruments | 462-0150A | Magnetically coupled rotor, binary dynamic mixer assembly (ternary type available), 0.15 mL dead volume (larger dead volume available) |
| Fluoropolymer tubing | IDEX Health & Science | 1507L | PFA Tubing Natural 1/16 inch OD x 0.040 inch ID x 50 ft |
| Fluoropolymer 1/4-28 flangeless fittings | IDEX Health & Science | XP-245 | PFA flangeless fitting with ferrules, 1/4-28 threading, 1/16 inch OD tubing |
| Glass syringes | Hamilton Company | 81660 | Hamilton 1000 series syringes, 10 mL (81660), model 1010 C syr, 1/4"-28 thread termination, other volumes available |
| High-pressure flow selector valves | Vici Valco | C85X-1570EUTB | Vici 10 position selector valves, 15000 psi max, 0.25 mm bore, 1/16 inch OD tubing, 10-32 coned threaded ports, USB universal actuator |
| High-pressure switch valves | Vici Valco | C82X-1574EUHB | Vici 4 port switch valves, 15000 psi max, 0.25 mm bore, 1/16 inch OD tubing, 10-32 coned threaded ports, USB universal actuator |
| High-pressure syringes | Cetoni | A2019000358 | 3 mL stainless steel syringe, 510 bar max, 21 mL/min flow rate max |
| Low-pressure flow selector valves | Vici Valco | C25-3180EUHB | Vici 10 position selector valves, max 250 psi liquid, 0.75 mm bore, 1/16 inch OD tubing, 1/4-28 threaded ports, USB universal actuator |
| neMESYS high-pressure syringe pumps | Cetoni | A3921000103 | Max force 2600 N |
| neMESYS mid-pressure syringe pumps | Cetoni | A3921000131 | Max force 1000 N |
| Power supply | Cetoni | A3921000127 | Base 600, supplies power for up to 4 high pressure pumps |
| Quartz flow-through sample cell | Starna Scientific | 3-2.30-Q-1/TC | Quartz micro flow cells, 2 mm path length (1 mm available), 2 mm by 2 mm by 30 mm internal dimension |
| Quartz windows | Technical Glass Products | NA | GE 124 Clear fused quartz ground and polished plates, 11.75 inch by 23.75 inch by 0.375 inch thick |
| Stainless steel 10-32 coned compression fittings | IDEX Health & Science | U-321X, U-320X | 316 stainless steel ferrule (U-321X) and nut (U-320X) -Valco type, 10-32 coned, for 1/16 inch OD stainless steel tubing |
| Stainless steel tubing | IDEX Health & Science | U-102 | Stainless Steel Tubing 1/16 inch OD x 0.020 inch ID, 10 cm, various precut lengths available |
| Syringe pump control software | Cetoni | T6000000004 | QmixElements software for nemesys pumps, QmixSDK software development kit |
| Thermoelectric air conditioner | EIC Solutions | AAC-140C-4XT-HC | Thermoelectric air conditioner mounted on insulated enclosure to control the pump, valve, mixer, and sample temperature |
| T-slot railing | McMaster-Carr | 47065T103 | Aluminum t-slotted railing (1.5 inch by 1.5 inch) cut to various lengths |
| Vapor locking bottle caps | Cole-Parmer | EW-12018-02 | Four 304 SS port inserts, 1/4"-28 threads, GL45 bottle cap size, PTFE body, SS threads, PP collar |
References
- Melnichenko, Y. B., Wignall, G. D. Small-angle neutron scattering in materials science: Recent practical applications. Journal of Applied Physics. 102 (2), 021101 (2007).
- Grillo, I., Borsali, R., Pecora, R. Small-angle neutron scattering and applications in soft condensed matter. Soft Matter Characterization. , (2008).
- Hollamby, M. J. Practical applications of small-angle neutron scattering. Physical Chemistry Chemical Physics. 15 (26), 10566-10579 (2013).
- Pipich, V., Fu, Z. KWS-3: Very small angle diffractor with focusing mirror. Journal of large-scale research. 1, 31 (2015).
- Barker, J. G., Kline, S., et al. . 2019 NCNR Annual Report, Special Publication (NIST SP). , (2019).
- Gilbert, P. H., et al. Preservative induced polysorbate 80 micelle aggregation. Journal of Pharmaceutical Sciences. 10 (6), 2395-2404 (2021).
- Terashima, T., et al. In situ and time-resolved small-angle neutron scattering observation of star polymer formation via arm-linking reaction in ruthenium-catalyzed living radical polymerization. Macromolecules. 43 (19), 8218-8232 (2010).
- Hashimoto, K., Fujii, K., Nishi, K., Shibayama, M. Ion gel network formation in an ionic liquid studied by time-resolved small-angle neutron scattering. The Journal of Physical Chemistry B. 122 (40), 9419-9424 (2018).
- Conn, C. E., et al. Membrane protein structures in lipid bilayers; small-Angle neutron scattering with contrast-matched bicontinuous cubic phases. Frontiers in Chemistry. 8, 619470 (2021).
- van’t Hag, L., et al. Protein-eye view of the in meso crystallization mechanism. Langmuir. 35 (25), 8344-8356 (2019).
- Mahieu, E., et al. Observing protein degradation by the PAN-20S proteasome by time-resolved neutron scattering. Biophysical Journal. 119 (2), 375-388 (2020).
- Ibrahim, Z., et al. Time-resolved neutron scattering provides new insight into protein substrate processing by a AAA+ unfoldase. Scientific Reports. 7 (1), 40948 (2017).
- Hollamby, M. J., et al. Growth of mesoporous silica nanoparticles monitored by time-resolved small-angle neutron scattering. Langmuir. 28 (9), 4425-4433 (2012).
- Blin, J. L., Impéror-Clerc, M. Mechanism of self-assembly in the synthesis of silica mesoporous materials: in situ studies by X-ray and neutron scattering. Chemical Society Reviews. 42 (9), 4071-4082 (2013).
- Impéror-Clerc, M., Grillo, I., Khodakov, A. Y., Durand, D., Zholobenko, V. L. New insights into the initial steps of the formation of SBA-15 materials: an in situ small angle neutron scattering investigation. Chemical Communications. 8, 834-836 (2007).
- Narayanan, T., Rüter, A., Olsson, U. SAXS/WAXS investigation of amyloid-β(16-22) peptide nanotubes. Frontiers in Bioengineering and Biotechnology. 9, 654349 (2021).
- Angelov, B., et al. DNA/Fusogenic lipid nanocarrier assembly: millisecond structural dynamics. The Journal of Physical Chemistry Letters. 4 (11), 1959-1964 (2013).
- Amann, M., et al. Kinetic pathways for polyelectrolyte coacervate micelle formation revealed by time-resolved synchrotron SAXS. Macromolecules. 52 (21), 8227 (2019).
- Varga, Z., Wacha, A., Bóta, A. Osmotic shrinkage of sterically stabilized liposomes as revealed by time-resolved small-angle X-ray scattering. Journal of Applied Crystallography. 47 (1), 35-40 (2014).
- Panine, P., Finet, S., Weiss, T. M., Narayanan, T. Probing fast kinetics in complex fluids by combined rapid mixing and small-angle X-ray scattering. Advances in Colloid and Interface Science. 127 (1), 9-18 (2006).
- Grillo, I. Applications of stopped-flow in SAXS and SANS. Current Opinion in Colloid & Interface Science. 14 (6), 402-408 (2009).
- Gomez-Hens, A., Perez-Bendito, D. The stopped-flow technique in analytical chemistry. Analytica Chimica Acta. 242, 147-177 (1991).
- Patel, J. T., Belsham, H. R., Rathbone, A. J., Friel, C. T. Use of stopped-flow fluorescence and labeled nucleotides to analyze the ATP turnover cycle of kinesins. Journal of Visualized Experiments: JoVE. (92), e52142 (2014).
- Biro, F. N., Zhai, J., Doucette, C. W., Hingorani, M. M. Application of stopped-flow kinetics methods to investigate the mechanism of action of a DNA repair protein. Journal of Visualized Experiments: JoVE. (37), e1874 (2010).
- Raney, K. D., Sowers, L. C., Millar, D. P., Benkovic, S. J. A fluorescence-based assay for monitoring helicase activity. Proceedings of the National Academy of Sciences of the United States of America. 91 (14), 6644-6648 (1994).
- Roder, H., Maki, K., Cheng, H. Early events in protein folding explored by rapid mixing methods. Chemical reviews. 106 (5), 1836-1861 (2006).
- Milon, A., et al. Osmotic swelling of unilamellar vesicles by the stopped-flow light scattering method. Influence of vesicle size, solute, temperature, cholesterol and three α,ω-dihydroxycarotenoids. Biochimica et Biophysica Acta (BBA) – Biomembranes. 859 (1), 1-9 (1986).
- Gast, K., Nöppert, A., Müller-Frohne, M., Zirwer, D., Damaschun, G. Stopped-flow dynamic light scattering as a method to monitor compaction during protein folding. European Biophysics Journal. 25 (3), 211-219 (1997).
- Antoun, A., Pavlov, M. Y., Tenson, T., Ehrenberg, M. M. Ribosome formation from subunits studied by stopped-flow and Rayleigh light scattering. Biological Procedures Online. 6, 35-54 (2004).
- Zhu, Z., Armes, S. P., Liu, S. pH-Induced micellization kinetics of ABC triblock copolymers measured by stopped-flow light scattering. Macromolecules. 38 (23), 9803-9812 (2005).
- Ye, J., et al. Comparative study of temperature-induced association of cyclic and linear poly(N-isopropylacrylamide) chains in dilute solutions by laser light scattering and stopped-flow temperature jump. Macromolecules. 41 (12), 4416-4422 (2008).
- Liu, X., et al. Early stage kinetics of polyelectrolyte complex coacervation monitored through stopped-flow light scattering. Soft Matter. 12 (44), 9030-9038 (2016).
- Garman, E. F., Weik, M. X-ray radiation damage to biological samples: recent progress. Journal of Synchrotron Radiation. 26 (4), 907-911 (2019).
- Garg, S., Porcar, L., Woodka, A. C., Butler, P. D., Perez-Salas, U. Noninvasive neutron scattering measurements reveal slower cholesterol transport in model lipid membranes. Biophysical Journal. 101 (2), 370-377 (2011).
- Marquardt, D., et al. 1H NMR shows slow phospholipid flip-flop in gel and fluid bilayers. Langmuir. 33 (15), 3731-3741 (2017).
- Egelhaaf, S. U., Olsson, U., Schurtenberger, P. Time-resolved SANS for surfactant phase transitions. Physica B: Condensed Matter. 276-278, 326-329 (2000).
- Tabor, R. F., Eastoe, J., Grillo, I. Time-resolved small-angle neutron scattering as a lamellar phase evolves into a microemulsion. Soft Matter. 5 (10), 2125-2129 (2009).
- Gradzielski, M., Bergmeier, M., Hoffmann, H., Müller, M., Grillo, I. Vesicle gel formed by a self-organization process. The Journal of Physical Chemistry B. 104 (49), 11594-11597 (2000).
- Lee, Y. -. T., Li, D. S., Pozzo, L. D. Kinetic analysis of ultrasound-induced oil exchange in oil-in-water emulsions through contrast variation time-resolved small-sngle neutron scattering. Langmuir. 35 (47), 15204-15213 (2019).
- Lee, Y. -. T., Pozzo, L. D. Contrast-variation time-resolved small-angle neutron scattering analysis of oil-exchange kinetics between oil-in-water emulsions stabilized by anionic surfactants. Langmuir. 35 (47), 15192-15203 (2019).
- Roger, K., Olsson, U., Schweins, R., Cabane, B. Emulsion ripening through molecular exchange at droplet contacts. Angewandte Chemie International Edition. 54 (5), 1452-1455 (2015).
- Nakano, M., Fukuda, M., Kudo, T., Endo, H., Handa, T. Determination of Interbilayer and Transbilayer Lipid Transfers by Time-Resolved Small-Angle Neutron Scattering. Physical Review Letters. 98 (23), 238101 (2007).
- Nakano, M., et al. Flip-flop of phospholipids in vesicles: kinetic analysis with time-resolved small-angle neutron scattering. The Journal of Physical Chemistry B. 113 (19), 6745-6748 (2009).
- Nguyen, M. H. L., et al. Methanol accelerates DMPC flip-flop and transfer: A SANS study on lipid dynamics. Biophysical Journal. 116 (5), 755-759 (2019).
- Nguyen, M. H. L., et al. Peptide-induced Lipid flip-flop in asymmetric liposomes measured by small angle neutron scattering. Langmuir. 35 (36), 11735-11744 (2019).
- Nguyen, M. H. L., et al. Time-resolved SANS reveals pore-forming peptides cause rapid lipid reorganization. New Journal of Chemistry. 45 (1), 447-456 (2021).
- Xia, Y., et al. Effects of nanoparticle morphology and acyl chain length on spontaneous lipid transfer rates. Langmuir. 31 (47), 12920-12928 (2015).
- Xia, Y., et al. Morphology-induced defects enhance lipid transfer rates. Langmuir. 32 (38), 9757-9764 (2016).
- Maric, S., et al. Time-resolved small-angle neutron scattering as a probe for the dynamics of lipid exchange between human lipoproteins and naturally derived membranes. Scientific Reports. 9 (1), 7591 (2019).
- Nielsen, J. E., Bjørnestad, V. A., Pipich, V., Jenssen, H., Lund, R. Beyond structural models for the mode of action: How natural antimicrobial peptides affect lipid transport. Journal of Colloid and Interface Science. 582, 793-802 (2021).
- Willner, L., Poppe, A., Allgaier, J., Mokenbusch, M., Richter, D. TIme-resolved SANS for the determintioan of unimer exchange kinetics in block copolymer micelles. Europhysics Letters. 55 (5), 667 (2001).
- Lund, R., Willner, L., Stellbrink, J., Lindner, P., Richter, D. Logarithmic chain-exchange kinetics of diblock copolymer micelles. Physical Review Letters. 96 (6), 068302 (2006).
- Lund, R., Willner, L., Richter, D., Dormidontova, E. E. Equilibrium chain exchange kinetics of diblock copolymer micelles: Tuning and logarithmic relaxation. Macromolecules. 39 (13), 4566-4575 (2006).
- Lund, R., Willner, L., Richter, D., Abe, A., Lee, K. S., Leibler, L., Kobayashi, S. Kinetics of block copolymer micelles studied by small-angle scattering methods. in Controlled Polymerization and Polymeric Structures. Advances in Polymer Science. , 51 (2013).
- Choi, S. -. H., Lodge, T. P., Bates, F. S. Mechanism of molecular exchange in diblock copolymer micelles: hypersensitivity to core chain length. Physical Review Letters. 104 (4), 047802 (2010).
- Choi, S. -. H., Bates, F. S., Lodge, T. P. Molecular exchange in ordered diblock copolymer micelles. Macromolecules. 44 (9), 3594-3604 (2011).
- Lu, J., Bates, F. S., Lodge, T. P. Chain exchange in binary copolymer micelles at equilibrium: confirmation of the independent chain hypothesis. ACS Macro Letters. 2 (5), 451-455 (2013).
- Lu, J., Bates, F. S., Lodge, T. P. Remarkable effect of molecular architecture on chain exchange in triblock copolymer micelles. Macromolecules. 48 (8), 2667-2676 (2015).
- Kelley, E. G., et al. Size evolution of highly amphiphilic macromolecular solution assemblies via a distinct bimodal pathway. Nature Communications. 5 (1), 3599 (2014).
- Murphy, R. P., Kelley, E. G., Rogers, S. A., Sullivan, M. O., Epps, T. H. Unlocking chain exchange in highly amphiphilic block polymer micellar systems: influence of agitation. ACS Macro Letters. 3 (11), 1106-1111 (2014).
- Schantz, A. B., et al. PEE-PEO block copolymer exchange rate between mixed micelles is detergent and temperature activated. Macromolecules. 50 (6), 2484-2494 (2017).
- Lantz, K. A., et al. Cavitation enables switchable and rapid block polymer exchange under high-χN conditions. Macromolecules. 51 (17), 6967-6975 (2018).
- Murphy, R. P., et al. Capillary RheoSANS: measuring the rheology and nanostructure of complex fluids at high shear rates. Soft Matter. 16 (27), 6285-6293 (2020).
- Stopped Flow Sans. usnistgov Available from: https://github.com/usnistgov/stopped-flow-sans (2021)
- Kline, S. Reduction and analysis of SANS and USANS data using IGOR Pro. Journal of Applied Crystallography. 39 (6), 895-900 (2006).
- Doktorova, M., et al. Preparation of asymmetric phospholipid vesicles for use as cell membrane models. Nature Protocols. 13 (9), 2086-2101 (2018).
- Huang, Z., London, E. Effect of cyclodextrin and membrane lipid structure upon cyclodextrin-lipid interaction. Langmuir. 29 (47), 14631-14638 (2013).
- Sugiura, T., Ikeda, K., Nakano, M. Kinetic analysis of the methyl-β-cyclodextrin-mediated intervesicular transfer of pyrene-labeled phospholipids. Langmuir. 32 (51), 13697-13705 (2016).
- Scott, H. L., et al. On the mechanism of bilayer separation by extrusion, or why your LUVs are not really unilamellar. Biophysical Journal. 117 (8), 1381-1386 (2019).
- Dicko, C., et al. NUrF-Optimization of in situ UV-vis and fluorescence and autonomous characterization techniques with small-angle neutron scattering instrumentation. Review of Scientific Instruments. 91 (7), 075111 (2020).

