Måling af tidsudviklingen af nanoskalamaterialer med stoppet flow og småvinkel neutronspredning
Summary
Denne protokol præsenterer brugen af et prøvemiljø med stoppet flow til hurtigt at blande flere flydende opløsninger in situ under en småvinkel neutronspredningsmåling og til at studere kinetiske processer på nanometerlængdeskalaer og anden tidsskalaer.
Abstract
Dette papir præsenterer brugen af et stop-flow småvinkel neutronspredningsprøvemiljø (SANS) til hurtigt at blande væskeprøver og studere kinetiske processer i nanoskala på tidsskalaer fra sekunder til minutter. Prøvemiljøet med stoppet flow bruger kommercielt tilgængelige sprøjtepumper til at blande de ønskede mængder væskeprøver, som derefter injiceres gennem en dynamisk mixer i en kvartsglascelle på ca. 1 s. Tidsopløst SANS-dataindsamling synkroniseres med prøveblandingen for at følge udviklingen af nanostrukturen i opløsning efter blanding.
For at udnytte neutronstråletiden mest effektivt bruger vi en række flowvælgerventiler til automatisk at indlæse, skylle og tørre cellen mellem målingerne, hvilket giver mulighed for gentagen dataindsamling gennem flere prøveinjektioner. Prøveinjektioner gentages, indtil der er indsamlet tilstrækkelige neutronspredningsstatistikker. Blandingsopsætningen kan programmeres til systematisk at variere forholdene for at måle kinetikken ved forskellige blandingsforhold, prøvekoncentrationer, additivkoncentrationer og temperaturer. Det mindste prøvevolumen, der kræves pr. injektion, er ca. 150 μL afhængigt af kvartscellens banelængde.
Repræsentative resultater ved anvendelse af dette stop-flow prøvemiljø præsenteres for hurtig lipidudvekslingskinetik i nærvær af et additiv, cyclodextrin. Vesiklerne udveksler ydre folder (udvendige) lipider i størrelsesordenen sekunder og udveksler fuldt ud både indvendige og udvendige lipider inden for få timer. Måling af lipidudvekslingskinetik kræver in situ-blanding for at fange de hurtigere (sekunder) og langsommere (minutter) processer og ekstrahere kinetiske hastighedskonstanter. Det samme prøvemiljø kan også bruges til at undersøge molekylær udveksling i andre typer væskeprøver, såsom lipidnanopartikler, proteiner, overfladeaktive stoffer, polymerer, emulsioner eller uorganiske nanopartikler. Måling af nanoskalaens strukturelle transformationer og kinetik ved udveksling eller reaktion af systemer vil give ny indsigt i processer, der udvikler sig på nanoskala.
Introduction
Småvinkel neutronspredning (SANS) giver en unik måde at måle størrelser, former, interaktioner og organisering af forskellige materialer på længdeskalaer fra ≈1 nm til ≈100 nm 1,2,3. Nyere instrumenter, herunder VSANS-instrumenter (meget småvinkel neutronspredning) med fokuseringsspejle, skubber grænserne mod måling af endnu større længdeskalaer op til ≈1000 nm 4,5. Generelt giver den unikke spredningskontrast, der er forbundet med neutronspredningsmetoder, flere fordele ved måling af tidsudviklingen af nanoskalastrukturer, såsom aggregering af komponenter i farmaceutiske formuleringer6, tværbindings- og geleringsreaktioner i polymersystemer7,8, i mesokrystallisation af membranproteiner9,10, nedbrydning og udfoldning af proteiner11,12 og vækst af silicabaserede materialer13,14,15. Den unikke spredningskontrast gør tidsopløste SANS (TR-SANS) til et nyttigt supplement til andre stop-flow-baserede målinger.
Stop-flow-blandingsmetoder implementeres ofte i småvinkel røntgenspredning (SAXS)16,17,18,19,20,21, fluorescensspektroskopi 22,23,24,25,26 og lysspredning 27,28,29,30. 31,32 eksperimenter til undersøgelse af kinetiske processer på millisekund tidsskalaer. En vigtig forskel mellem SANS og SAXS er, at neutronspredning er en ikke-destruktiv karakteriseringsteknik, og som sådan kan SANS bruges til at måle den samme prøve i timer eller endda dage uden ioniserende strålingsskader på prøven, hvilket kan ske under røntgenspredningseksperimenter med højere flux33. Da gentagne SANS-målinger ikke vil ændre sondemolekylets eller prøvens kemiske struktur, kan tidsudviklingen studeres uden virkninger af f.eks. fotoblegning, som kan komplicere kinetikmålinger, der er afhængige af fluorescens23,24. Desuden kan SANS bruges til at måle stærkt koncentrerede og optisk uigennemsigtige prøver, der ofte er vanskelige at karakterisere med lysbaserede teknikker såsom dynamisk lysspredning.
Ud over at give strukturelle oplysninger om nanoskala kan SANS bruges til at undersøge den lokale sammensætning af disse strukturer gennem variationen i neutronspredningslængdetæthedskontrast. Spredningslængdetætheden (SLD) af forskellige grundstoffer varierer tilfældigt på tværs af det periodiske system og varierer med forskellige isotoper af det samme element. Et almindeligt udnyttet eksempel er hydrogen (1H eller H) og deuterium (2H eller D), som har meget forskellige neutronspredningslængder. Derfor kan hydrogenrige materialer, såsom overfladeaktive stoffer, lipider, proteiner, RNA, DNA og andre polymerer, skelnes fra deutererede opløsningsmidler ved anvendelse af SANS uden signifikant at ændre systemets fysiske egenskaber. Det er dog vigtigt at bemærke, at H/D-udveksling kan påvirke densiteten, hydrogenbindingen og faseovergangstemperaturerne i prøven. Ikke desto mindre er SANS’ unikke følsomhed over for brintrige materialer især nyttig i forskning i blødt stof, hvor prøverne af interesse har lavere spredningskontrast og signal i røntgenbaserede teknikker som SAXS. Isotopsubstitution gør også SANS til et kraftfuldt værktøj til at studere molekylær udvekslingskinetik i hydrogenrige materialer ved blot at blande H-mærkede og D-mærkede molekyler. Isotopsubstitution er særlig nyttig i systemer, hvor voluminøse fluorescerende farvestoffer er større end de overfladeaktive stoffer eller lipidmolekyler af interesse og kan påvirke udvekslingskinetikken34,35.
Tidsopløste SANS-målinger er fordelagtige, fordi den målte intensitet er en funktion af tid, længdeskala og SLD-kontrast. Som sådan kan TR-SANS-eksperimenter designes til at undersøge de tidsafhængige ændringer i de rumlige fordelinger og sammensætningerne af prøverne. Disse unikke fordele ved SANS har ført til vigtig indsigt i kinetiske processer i mange bløde materialesystemer såsom overfladeaktive stoffer 36,37,38, emulsioner 39,40,41, lipider 34,42,43,44,45,46,47,48,49 ,50 og polymerer 51,52,53,54,55,56,57,58,59,60,61,62. De fleste TR-SANS-undersøgelser har fokuseret på tidsskalaer fra minutter til timer. Imidlertid forekommer mange kinetiske processer af interesse på anden tidsskala og er afgørende for at forstå de underliggende mekanismer. Registrering af disse tidlige tidspunkter kræver, at opløsningerne hurtigt blandes og måles in situ, hvor blandingen synkroniseres med dataindsamling under stoppet flowlysspredning 27,28,29,30,31,32, fluorescens 22,23,24,25,26 og røntgen 16,17,18,19,20,21 eksperimenter. Dette arbejde beskriver brugen af et prøvemiljø designet til hurtigt at blande flere væskeprøver og injicere blandingen i en kvartsglascelle til TR-SANS-målinger. Blandeanordningen er en tilpasning af den nyligt udviklede kapillære rheoSANS enhed63 og bruger flere sprøjtepumper og ventiler til at styre prøveblandingen og automatisere cellerensning. Ved at forbinde sprøjtepumper til en række flowvælgerventiler kan flere indløbsstrømme gentagne gange blandes, måles, skylles og tørres for at lette TR-SANS-målinger på sekunders tidsskala.
Den nuværende procedure forudsætter, at prøverne af interesse er blevet identificeret og forberedt. Vi fokuserer på in situ mix-opsætningen og metoder til at indsamle TR-SANS-data. Neutronspredningsdata blev indsamlet på VSANS-instrumentet ved NIST Center for Neutron Research (NCNR); Proceduren bør dog finde anvendelse på andre SANS-instrumenter. Læsere, der er interesseret i at implementere lignende protokoller på andre SANS-instrumenter, bør rådføre sig med de lokale instrumentforskere for at bestemme den optimale instrumentkonfiguration for at maksimere neutronflux på den ønskede længdeskala og tidsskala, der er mest relevant for de kinetiske processer af interesse. De data, der præsenteres her, blev indsamlet ved hjælp af højflux ‘hvid stråle’ konfiguration på VSANS for at maksimere neutrontællinger ved tab af rumlig opløsning5. Detektorvognene var placeret til at dække en række spredningsvektorer (q), 0,005 Å-1 < q < 0,5 Å-1, svarende til længdeskalaer på ≈130 nm til ≈13 nm. Spredningsvektoren defineres som q = 4π/λ sin (θ/2), hvor λ er neutronbølgelængden, og θ er spredningsvinklen.
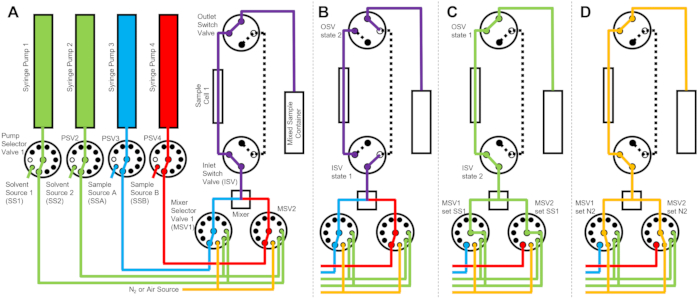
Den stop-flow-blandingsanordning, der anvendes til TR-SANS-målingerne, består af flere pumper, skyllesprøjter, prøvesprøjter, flowselektorer samt en dynamisk mixer, prøvecelle og blandet prøvebeholder som vist i figur 1. Alle forseglede væskebaner er placeret inde i et klimatiseret kabinet, som omfatter sprøjter, ventiler, forbindelsesrør, dynamisk mixer og prøveceller. Et programmerbart termoelektrisk klimaanlæg bruges til at styre kabinettemperaturen i området fra 10 ° C til 50 ° C inden for ± 1 ° C. Bemærk, at noget af kabinetisoleringen blev fjernet for at vise enhedens arbejdsdele. Hovedblandeenhedens kabinet er placeret på et translationelt trin på NG3 VSANS-strålelinjen ved NCNR. Prøvelokalets position justeres ved hjælp af oversættelsestrinnet for at placere prøvecellen i neutronstrålens bane (gul stiplet linje).

Figur 1: Et eksempel på opsætning til kombination af stop-flow blanding og småvinkel neutronspredningsmålinger ved VSANS strålelinjen ved NIST Center for Neutron Research. Opsætningen indeholder fire sprøjtepumper, to sprøjter til skylning med opløsningsmiddel og to sprøjter til prøveinjektion, fire pumpevælgerventiler, to blandevælgerventiler, en dynamisk blander, en gennemstrømningskvartscelle og en blandet prøvebeholder. Indfaldende neutroner spredes fra den blandede prøve, der er placeret inde i prøvecellen. Et isoleret kabinet med kvartsvinduer og en termoelektrisk klimatiseret enhed bruges til at styre prøven og alt udstyr ved en konstant temperatur. Den gule stiplede linje viser neutronstrålens vej. Vægtstang = 10 cm. Klik her for at se en større version af denne figur.
Enheden afbildet i figur 1 er konfigureret med to prøvesprøjter, to skyllesprøjter og en prøvecelle. Tilsvarende flowdiagrammer for de forskellige trin i protokollen er illustreret i figur 2. De ønskede volumener af de to forskellige prøver injiceres i blanderen og prøvecellen (figur 2A). Når prøvecellen er fyldt, lukkes indløbskoblingsventilen (ISV) og udløbskoblingsventilen (OSV) for at isolere prøvecellen fra den dynamiske mixer og for at forhindre prøvens tilbagediffusion i cellen under TR-SANS-dataindsamling (figur 2B). Før den dynamiske mixer varierer tilslutningsslangen i længde fra 10 cm til 1 m og påvirker ikke blandingsforsinkelsen. Slangeforbindelser mellem den dynamiske mixer og prøvecellen vil dog påvirke blandingsforsinkelsestiden og det krævede prøveinjektionsvolumen. Forskåret rør i rustfrit stål med 0,04 tommer (1 mm) indvendig diameter og 100 mm længde bruges til at forbinde den dynamiske mixer, mixervælgerventilerne (MSV1 og MSV2) og ISV og OSV. Fluorerede slanger med 1 mm indvendig diameter og 115 mm længde bruges til at forbinde ISV og OSV (eller det dynamiske mixerudløb) til prøvecellen. Det samlede tomrumsvolumen, der påvirker blandingsforsinkelsestiden, inkluderer mixerens hulrumsvolumen (0,15 ml), slangen mellem mixerens udløb og prøvecelleindløbet (0,09 ml) og prøvecellevolumenet (0,16 ml). I dette eksempel er det samlede tomrumsvolumen 0,4 ml. De indre hulrumsvolumener af ventiler er ubetydelige sammenlignet med rør-, blande- og prøvecellehulrumsvolumenerne. For eksempel indeholder de anvendte lavtryksvælgerventiler (0,75 mm borediameter) omtrentlige hulvolumener på 4 μL, mens højtryksvælgerventiler og koblingsventiler (0,25 mm borediameter) indeholder omtrentlige hulvolumener på 0,5 μL.
Når TR-SANS-målingen er afsluttet, skubbes prøven ud af cellen med opløsningsmiddel, og skylleopløsningsmidlet pumpes gentagne gange gennem cellen for at fjerne restprøven og rense prøvecellen (figur 2C). Bemærk, at skyllesprøjterne er forbundet til større opløsningsmiddelbeholdere (f.eks. vand og ethanol) via pumpevælgerværdier for at sikre, at der er tilstrækkelige opløsningsmiddelvolumener til rådighed til at rengøre prøvecellen mellem målekørsler. Opløsningsmiddelkilder, prøvekilder og blandede prøvebeholdere, der indeholder brandfarlige væsker, placeres i et separat kabinet uden elektrisk udstyr for at eliminere alle mulige antændelseskilder. Derudover bruges damplåsende flaskehætter til at minimere brandfarlige dampe og opløsningsmiddelfordampning. Endelig tørres prøvecellen med en nitrogengasstrøm for at fjerne det resterende skyllemiddel (figur 2D). Indløbsnitrogengastrykket til blandevælgerventilen reguleres til ca. 2 bar (0,2 MPa, måletryk) ved hjælp af en manuel trykregulator placeret på nitrogengasflasken. Når prøvecellen er tilstrækkeligt renset og tørret, injiceres en nyblandet prøve i prøvecellen til næste målecyklus (blanding og injektion gentages som vist i flowdiagrammet i figur 2A).
Figur 2: Eksempel på flowdiagram med en prøvecelle, to prøveblandinger og to skylleopløsningsmidler til rengøring . (A) Blanding af prøve A (blå) og prøve B (rød) og derefter flydende den blandede prøve (lilla) ind i prøvecellen. B) Under dataindsamlingen angiver anordningen til standset flow, hvor ISV- og OSV-koblingsventilerne er lukket for at isolere prøvecellen og forhindre tilbagediffusion af prøven under dataindsamlingen. C) De rengøringstrin, hvor prøvecellen skylles med skyllemiddel fra SS1 (grøn) efter dataindsamling. D) Tørringstrin, hvor prøvecellen tørres med nitrogengas (orange). Forkortelser: PSV = pumpevælgerventil; MSV = mixervælgerventil; OSV = udløbsafbryderventil; ISV = indløbsventil; SS1 = opløsningsmiddelkilde 1; SSA = prøvekilde A N2 = nitrogengaskilde. Klik her for at se en større version af denne figur.
Figur 3 viser flowdiagrammer for en lidt anden version, hvor blandingsopsætningen er konfigureret med to separate prøveceller forbundet til de samme kontaktventiler (figur 3A). Mens TR-SANS-data indsamles i prøvecelle 1, skylles prøvecelle 2 (figur 3B) og tørres (figur 3C). Når dataindsamlingen er fuldført for prøvecelle 1, leder indløbskontaktventilen en nyblandet prøve ind i prøvecelle 2 til dataindsamling (figur 3D). Mens TR-SANS-data indsamles i prøvecelle 2, skylles og tørres prøvecelle 1 (figur 3E). Denne vekslende, parallelle proces mellem to prøveceller minimerer tiden mellem efterfølgende prøveinjektioner og maksimerer brugen af neutronstråletid.
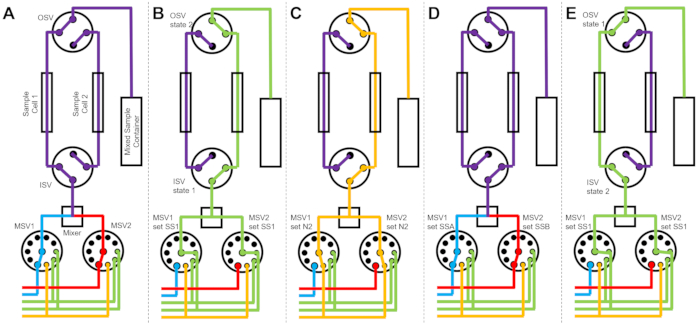
Figur 3: Eksempel på flowdiagram med to prøveceller, blanding af to prøver og to skylleopløsningsmidler til rengøring. (A) Prøve A (blå) og prøve B (rød) blandes, hvorefter den blandede prøve (lilla) blandes i prøvecelle 1. (B) Anordningen til standset flow tilstand under dataindsamling på prøvecelle 1, mens prøvecelle 2 skylles med opløsningsmiddel fra SS1 (grøn). C) Anordningen til standset flow tilstand under dataindsamlingen i prøvecelle 1, mens prøvecelle 2 tørres med nitrogengas (orange). D) Når dataindsamlingen af prøvecelle 1 er afsluttet, blandes en ny prøve (lilla) straks og flyder ind i prøvecelle 2. E) Anordningen til standset flow tilstand under dataindsamling i prøvecelle 2, mens prøvecelle 1 skylles med opløsningsmiddel fra SS1 (grøn). Mens den ene prøvecelle måles, rengøres og tørres den anden prøvecelle. Måleprocessen for stoppet flow skifter mellem to prøveceller for at minimere tiden mellem efterfølgende injektioner af prøveblandinger. Forkortelser: PSV = pumpevælgerventil; MSV = mixervælgerventil; OSV = udløbsafbryderventil; ISV = indløbsventil; SS1 = opløsningsmiddelkilde 1; SSA = prøvekilde A N2 = nitrogengaskilde. Klik her for at se en større version af denne figur.
Nedenfor beskrives en trinvis protokol til tilslutning af pumper og slangeledninger, priming af systemet, skylning og tørring af prøvecellen og injektion af den blandede prøve. Selvom enkeltcellekonfigurationen demonstreres for enkelhed (figur 2), kan den fleksible modulære opsætning, protokol og scripts let ændres til at implementere flere sprøjtepumper, ventiler, blandere eller prøvecellekonfigurationer, såsom to-prøvecellekonfigurationen vist i figur 3. Repræsentative rå neutrontællingshastighedsdata indsamlet gennem blandings- og rengøringsinjektionscyklusser er vist i figur 4, mens lipidudvekslingskinetik målt ved 3 forskellige temperaturer og den ekstraherede normaliserede spredte intensitet svarende til den udvekslede fraktion af lipider er vist i henholdsvis figur 5 og figur 6.
Protocol
Representative Results
Discussion
Den aktuelle procedure beskriver blandeanordningen og trinnene til udførelse af TR-SANS-målinger med stoppet flow. Enheden og protokollen er optimeret til væskeprøver med lav viskositet, hvor tidsskalaerne af interesse er ≈1 s til 5 min. For tidsskalaer på mere end 5 minutter kan det være lettere og ønskeligt manuelt at blande prøverne og indlæse dem i standardspredningsceller, især for prøver med høj viskositet, geler eller pastaer. Adgang til tidsskalaer mindre end 1 s kræver et andet blandingsapparat, l…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Adgang til NG3 VSANS blev leveret af Center for High-Resolution Neutron Scattering, et partnerskab mellem National Institute of Standards and Technology og National Science Foundation under aftale nr. DMR-2010792. M.H.L.N anerkender finansieringen fra Mitacs Globalink (Canada). Identifikationen af kommercielle produkter eller handelsnavne er for at fremme forståelsen og indebærer ikke godkendelse eller anbefaling fra National Institute of Standards and Technology.
Materials
| Dynamic mixer | Analytical Scientific Instruments | 462-0150A | Magnetically coupled rotor, binary dynamic mixer assembly (ternary type available), 0.15 mL dead volume (larger dead volume available) |
| Fluoropolymer tubing | IDEX Health & Science | 1507L | PFA Tubing Natural 1/16 inch OD x 0.040 inch ID x 50 ft |
| Fluoropolymer 1/4-28 flangeless fittings | IDEX Health & Science | XP-245 | PFA flangeless fitting with ferrules, 1/4-28 threading, 1/16 inch OD tubing |
| Glass syringes | Hamilton Company | 81660 | Hamilton 1000 series syringes, 10 mL (81660), model 1010 C syr, 1/4"-28 thread termination, other volumes available |
| High-pressure flow selector valves | Vici Valco | C85X-1570EUTB | Vici 10 position selector valves, 15000 psi max, 0.25 mm bore, 1/16 inch OD tubing, 10-32 coned threaded ports, USB universal actuator |
| High-pressure switch valves | Vici Valco | C82X-1574EUHB | Vici 4 port switch valves, 15000 psi max, 0.25 mm bore, 1/16 inch OD tubing, 10-32 coned threaded ports, USB universal actuator |
| High-pressure syringes | Cetoni | A2019000358 | 3 mL stainless steel syringe, 510 bar max, 21 mL/min flow rate max |
| Low-pressure flow selector valves | Vici Valco | C25-3180EUHB | Vici 10 position selector valves, max 250 psi liquid, 0.75 mm bore, 1/16 inch OD tubing, 1/4-28 threaded ports, USB universal actuator |
| neMESYS high-pressure syringe pumps | Cetoni | A3921000103 | Max force 2600 N |
| neMESYS mid-pressure syringe pumps | Cetoni | A3921000131 | Max force 1000 N |
| Power supply | Cetoni | A3921000127 | Base 600, supplies power for up to 4 high pressure pumps |
| Quartz flow-through sample cell | Starna Scientific | 3-2.30-Q-1/TC | Quartz micro flow cells, 2 mm path length (1 mm available), 2 mm by 2 mm by 30 mm internal dimension |
| Quartz windows | Technical Glass Products | NA | GE 124 Clear fused quartz ground and polished plates, 11.75 inch by 23.75 inch by 0.375 inch thick |
| Stainless steel 10-32 coned compression fittings | IDEX Health & Science | U-321X, U-320X | 316 stainless steel ferrule (U-321X) and nut (U-320X) -Valco type, 10-32 coned, for 1/16 inch OD stainless steel tubing |
| Stainless steel tubing | IDEX Health & Science | U-102 | Stainless Steel Tubing 1/16 inch OD x 0.020 inch ID, 10 cm, various precut lengths available |
| Syringe pump control software | Cetoni | T6000000004 | QmixElements software for nemesys pumps, QmixSDK software development kit |
| Thermoelectric air conditioner | EIC Solutions | AAC-140C-4XT-HC | Thermoelectric air conditioner mounted on insulated enclosure to control the pump, valve, mixer, and sample temperature |
| T-slot railing | McMaster-Carr | 47065T103 | Aluminum t-slotted railing (1.5 inch by 1.5 inch) cut to various lengths |
| Vapor locking bottle caps | Cole-Parmer | EW-12018-02 | Four 304 SS port inserts, 1/4"-28 threads, GL45 bottle cap size, PTFE body, SS threads, PP collar |
References
- Melnichenko, Y. B., Wignall, G. D. Small-angle neutron scattering in materials science: Recent practical applications. Journal of Applied Physics. 102 (2), 021101 (2007).
- Grillo, I., Borsali, R., Pecora, R. Small-angle neutron scattering and applications in soft condensed matter. Soft Matter Characterization. , (2008).
- Hollamby, M. J. Practical applications of small-angle neutron scattering. Physical Chemistry Chemical Physics. 15 (26), 10566-10579 (2013).
- Pipich, V., Fu, Z. KWS-3: Very small angle diffractor with focusing mirror. Journal of large-scale research. 1, 31 (2015).
- Barker, J. G., Kline, S., et al. . 2019 NCNR Annual Report, Special Publication (NIST SP). , (2019).
- Gilbert, P. H., et al. Preservative induced polysorbate 80 micelle aggregation. Journal of Pharmaceutical Sciences. 10 (6), 2395-2404 (2021).
- Terashima, T., et al. In situ and time-resolved small-angle neutron scattering observation of star polymer formation via arm-linking reaction in ruthenium-catalyzed living radical polymerization. Macromolecules. 43 (19), 8218-8232 (2010).
- Hashimoto, K., Fujii, K., Nishi, K., Shibayama, M. Ion gel network formation in an ionic liquid studied by time-resolved small-angle neutron scattering. The Journal of Physical Chemistry B. 122 (40), 9419-9424 (2018).
- Conn, C. E., et al. Membrane protein structures in lipid bilayers; small-Angle neutron scattering with contrast-matched bicontinuous cubic phases. Frontiers in Chemistry. 8, 619470 (2021).
- van’t Hag, L., et al. Protein-eye view of the in meso crystallization mechanism. Langmuir. 35 (25), 8344-8356 (2019).
- Mahieu, E., et al. Observing protein degradation by the PAN-20S proteasome by time-resolved neutron scattering. Biophysical Journal. 119 (2), 375-388 (2020).
- Ibrahim, Z., et al. Time-resolved neutron scattering provides new insight into protein substrate processing by a AAA+ unfoldase. Scientific Reports. 7 (1), 40948 (2017).
- Hollamby, M. J., et al. Growth of mesoporous silica nanoparticles monitored by time-resolved small-angle neutron scattering. Langmuir. 28 (9), 4425-4433 (2012).
- Blin, J. L., Impéror-Clerc, M. Mechanism of self-assembly in the synthesis of silica mesoporous materials: in situ studies by X-ray and neutron scattering. Chemical Society Reviews. 42 (9), 4071-4082 (2013).
- Impéror-Clerc, M., Grillo, I., Khodakov, A. Y., Durand, D., Zholobenko, V. L. New insights into the initial steps of the formation of SBA-15 materials: an in situ small angle neutron scattering investigation. Chemical Communications. 8, 834-836 (2007).
- Narayanan, T., Rüter, A., Olsson, U. SAXS/WAXS investigation of amyloid-β(16-22) peptide nanotubes. Frontiers in Bioengineering and Biotechnology. 9, 654349 (2021).
- Angelov, B., et al. DNA/Fusogenic lipid nanocarrier assembly: millisecond structural dynamics. The Journal of Physical Chemistry Letters. 4 (11), 1959-1964 (2013).
- Amann, M., et al. Kinetic pathways for polyelectrolyte coacervate micelle formation revealed by time-resolved synchrotron SAXS. Macromolecules. 52 (21), 8227 (2019).
- Varga, Z., Wacha, A., Bóta, A. Osmotic shrinkage of sterically stabilized liposomes as revealed by time-resolved small-angle X-ray scattering. Journal of Applied Crystallography. 47 (1), 35-40 (2014).
- Panine, P., Finet, S., Weiss, T. M., Narayanan, T. Probing fast kinetics in complex fluids by combined rapid mixing and small-angle X-ray scattering. Advances in Colloid and Interface Science. 127 (1), 9-18 (2006).
- Grillo, I. Applications of stopped-flow in SAXS and SANS. Current Opinion in Colloid & Interface Science. 14 (6), 402-408 (2009).
- Gomez-Hens, A., Perez-Bendito, D. The stopped-flow technique in analytical chemistry. Analytica Chimica Acta. 242, 147-177 (1991).
- Patel, J. T., Belsham, H. R., Rathbone, A. J., Friel, C. T. Use of stopped-flow fluorescence and labeled nucleotides to analyze the ATP turnover cycle of kinesins. Journal of Visualized Experiments: JoVE. (92), e52142 (2014).
- Biro, F. N., Zhai, J., Doucette, C. W., Hingorani, M. M. Application of stopped-flow kinetics methods to investigate the mechanism of action of a DNA repair protein. Journal of Visualized Experiments: JoVE. (37), e1874 (2010).
- Raney, K. D., Sowers, L. C., Millar, D. P., Benkovic, S. J. A fluorescence-based assay for monitoring helicase activity. Proceedings of the National Academy of Sciences of the United States of America. 91 (14), 6644-6648 (1994).
- Roder, H., Maki, K., Cheng, H. Early events in protein folding explored by rapid mixing methods. Chemical reviews. 106 (5), 1836-1861 (2006).
- Milon, A., et al. Osmotic swelling of unilamellar vesicles by the stopped-flow light scattering method. Influence of vesicle size, solute, temperature, cholesterol and three α,ω-dihydroxycarotenoids. Biochimica et Biophysica Acta (BBA) – Biomembranes. 859 (1), 1-9 (1986).
- Gast, K., Nöppert, A., Müller-Frohne, M., Zirwer, D., Damaschun, G. Stopped-flow dynamic light scattering as a method to monitor compaction during protein folding. European Biophysics Journal. 25 (3), 211-219 (1997).
- Antoun, A., Pavlov, M. Y., Tenson, T., Ehrenberg, M. M. Ribosome formation from subunits studied by stopped-flow and Rayleigh light scattering. Biological Procedures Online. 6, 35-54 (2004).
- Zhu, Z., Armes, S. P., Liu, S. pH-Induced micellization kinetics of ABC triblock copolymers measured by stopped-flow light scattering. Macromolecules. 38 (23), 9803-9812 (2005).
- Ye, J., et al. Comparative study of temperature-induced association of cyclic and linear poly(N-isopropylacrylamide) chains in dilute solutions by laser light scattering and stopped-flow temperature jump. Macromolecules. 41 (12), 4416-4422 (2008).
- Liu, X., et al. Early stage kinetics of polyelectrolyte complex coacervation monitored through stopped-flow light scattering. Soft Matter. 12 (44), 9030-9038 (2016).
- Garman, E. F., Weik, M. X-ray radiation damage to biological samples: recent progress. Journal of Synchrotron Radiation. 26 (4), 907-911 (2019).
- Garg, S., Porcar, L., Woodka, A. C., Butler, P. D., Perez-Salas, U. Noninvasive neutron scattering measurements reveal slower cholesterol transport in model lipid membranes. Biophysical Journal. 101 (2), 370-377 (2011).
- Marquardt, D., et al. 1H NMR shows slow phospholipid flip-flop in gel and fluid bilayers. Langmuir. 33 (15), 3731-3741 (2017).
- Egelhaaf, S. U., Olsson, U., Schurtenberger, P. Time-resolved SANS for surfactant phase transitions. Physica B: Condensed Matter. 276-278, 326-329 (2000).
- Tabor, R. F., Eastoe, J., Grillo, I. Time-resolved small-angle neutron scattering as a lamellar phase evolves into a microemulsion. Soft Matter. 5 (10), 2125-2129 (2009).
- Gradzielski, M., Bergmeier, M., Hoffmann, H., Müller, M., Grillo, I. Vesicle gel formed by a self-organization process. The Journal of Physical Chemistry B. 104 (49), 11594-11597 (2000).
- Lee, Y. -. T., Li, D. S., Pozzo, L. D. Kinetic analysis of ultrasound-induced oil exchange in oil-in-water emulsions through contrast variation time-resolved small-sngle neutron scattering. Langmuir. 35 (47), 15204-15213 (2019).
- Lee, Y. -. T., Pozzo, L. D. Contrast-variation time-resolved small-angle neutron scattering analysis of oil-exchange kinetics between oil-in-water emulsions stabilized by anionic surfactants. Langmuir. 35 (47), 15192-15203 (2019).
- Roger, K., Olsson, U., Schweins, R., Cabane, B. Emulsion ripening through molecular exchange at droplet contacts. Angewandte Chemie International Edition. 54 (5), 1452-1455 (2015).
- Nakano, M., Fukuda, M., Kudo, T., Endo, H., Handa, T. Determination of Interbilayer and Transbilayer Lipid Transfers by Time-Resolved Small-Angle Neutron Scattering. Physical Review Letters. 98 (23), 238101 (2007).
- Nakano, M., et al. Flip-flop of phospholipids in vesicles: kinetic analysis with time-resolved small-angle neutron scattering. The Journal of Physical Chemistry B. 113 (19), 6745-6748 (2009).
- Nguyen, M. H. L., et al. Methanol accelerates DMPC flip-flop and transfer: A SANS study on lipid dynamics. Biophysical Journal. 116 (5), 755-759 (2019).
- Nguyen, M. H. L., et al. Peptide-induced Lipid flip-flop in asymmetric liposomes measured by small angle neutron scattering. Langmuir. 35 (36), 11735-11744 (2019).
- Nguyen, M. H. L., et al. Time-resolved SANS reveals pore-forming peptides cause rapid lipid reorganization. New Journal of Chemistry. 45 (1), 447-456 (2021).
- Xia, Y., et al. Effects of nanoparticle morphology and acyl chain length on spontaneous lipid transfer rates. Langmuir. 31 (47), 12920-12928 (2015).
- Xia, Y., et al. Morphology-induced defects enhance lipid transfer rates. Langmuir. 32 (38), 9757-9764 (2016).
- Maric, S., et al. Time-resolved small-angle neutron scattering as a probe for the dynamics of lipid exchange between human lipoproteins and naturally derived membranes. Scientific Reports. 9 (1), 7591 (2019).
- Nielsen, J. E., Bjørnestad, V. A., Pipich, V., Jenssen, H., Lund, R. Beyond structural models for the mode of action: How natural antimicrobial peptides affect lipid transport. Journal of Colloid and Interface Science. 582, 793-802 (2021).
- Willner, L., Poppe, A., Allgaier, J., Mokenbusch, M., Richter, D. TIme-resolved SANS for the determintioan of unimer exchange kinetics in block copolymer micelles. Europhysics Letters. 55 (5), 667 (2001).
- Lund, R., Willner, L., Stellbrink, J., Lindner, P., Richter, D. Logarithmic chain-exchange kinetics of diblock copolymer micelles. Physical Review Letters. 96 (6), 068302 (2006).
- Lund, R., Willner, L., Richter, D., Dormidontova, E. E. Equilibrium chain exchange kinetics of diblock copolymer micelles: Tuning and logarithmic relaxation. Macromolecules. 39 (13), 4566-4575 (2006).
- Lund, R., Willner, L., Richter, D., Abe, A., Lee, K. S., Leibler, L., Kobayashi, S. Kinetics of block copolymer micelles studied by small-angle scattering methods. in Controlled Polymerization and Polymeric Structures. Advances in Polymer Science. , 51 (2013).
- Choi, S. -. H., Lodge, T. P., Bates, F. S. Mechanism of molecular exchange in diblock copolymer micelles: hypersensitivity to core chain length. Physical Review Letters. 104 (4), 047802 (2010).
- Choi, S. -. H., Bates, F. S., Lodge, T. P. Molecular exchange in ordered diblock copolymer micelles. Macromolecules. 44 (9), 3594-3604 (2011).
- Lu, J., Bates, F. S., Lodge, T. P. Chain exchange in binary copolymer micelles at equilibrium: confirmation of the independent chain hypothesis. ACS Macro Letters. 2 (5), 451-455 (2013).
- Lu, J., Bates, F. S., Lodge, T. P. Remarkable effect of molecular architecture on chain exchange in triblock copolymer micelles. Macromolecules. 48 (8), 2667-2676 (2015).
- Kelley, E. G., et al. Size evolution of highly amphiphilic macromolecular solution assemblies via a distinct bimodal pathway. Nature Communications. 5 (1), 3599 (2014).
- Murphy, R. P., Kelley, E. G., Rogers, S. A., Sullivan, M. O., Epps, T. H. Unlocking chain exchange in highly amphiphilic block polymer micellar systems: influence of agitation. ACS Macro Letters. 3 (11), 1106-1111 (2014).
- Schantz, A. B., et al. PEE-PEO block copolymer exchange rate between mixed micelles is detergent and temperature activated. Macromolecules. 50 (6), 2484-2494 (2017).
- Lantz, K. A., et al. Cavitation enables switchable and rapid block polymer exchange under high-χN conditions. Macromolecules. 51 (17), 6967-6975 (2018).
- Murphy, R. P., et al. Capillary RheoSANS: measuring the rheology and nanostructure of complex fluids at high shear rates. Soft Matter. 16 (27), 6285-6293 (2020).
- Stopped Flow Sans. usnistgov Available from: https://github.com/usnistgov/stopped-flow-sans (2021)
- Kline, S. Reduction and analysis of SANS and USANS data using IGOR Pro. Journal of Applied Crystallography. 39 (6), 895-900 (2006).
- Doktorova, M., et al. Preparation of asymmetric phospholipid vesicles for use as cell membrane models. Nature Protocols. 13 (9), 2086-2101 (2018).
- Huang, Z., London, E. Effect of cyclodextrin and membrane lipid structure upon cyclodextrin-lipid interaction. Langmuir. 29 (47), 14631-14638 (2013).
- Sugiura, T., Ikeda, K., Nakano, M. Kinetic analysis of the methyl-β-cyclodextrin-mediated intervesicular transfer of pyrene-labeled phospholipids. Langmuir. 32 (51), 13697-13705 (2016).
- Scott, H. L., et al. On the mechanism of bilayer separation by extrusion, or why your LUVs are not really unilamellar. Biophysical Journal. 117 (8), 1381-1386 (2019).
- Dicko, C., et al. NUrF-Optimization of in situ UV-vis and fluorescence and autonomous characterization techniques with small-angle neutron scattering instrumentation. Review of Scientific Instruments. 91 (7), 075111 (2020).

