Tijd-opgeloste Förster Resonantie Energie Transfer Assays voor meting van endogene gefosforyleerde STAT-eiwitten in menselijke cellen
Summary
Tijd-opgeloste Förster resonantie energieoverdracht cel-gebaseerde assay protocollen worden beschreven voor de eenvoudige, specifieke, gevoelige en robuuste kwantificering van endogene gefosforyleerde signaal transducer en activator van transcriptie (STAT) 1/3/4/5/6 eiwitten in cellysaten in een 384-well formaat.
Abstract
De Janus kinase (JAK)/signaaltransducer en activator of transcription (STAT) signaleringsroute speelt een cruciale rol bij het bemiddelen van cellulaire reacties op cytokines en groeifactoren. STAT-eiwitten worden geactiveerd door tyrosinefosforylering die voornamelijk wordt gemedieerd door JAKs. De abnormale activering van STAT-signaalroutes is betrokken bij veel menselijke ziekten, met name kanker en immuungerelateerde aandoeningen. Daarom is het vermogen om STAT-eiwitfosforylatie binnen de inheemse celsignaleringsomgeving te volgen belangrijk voor zowel academisch als geneesmiddelenontdekkingsonderzoek. De traditionele assayformaten die beschikbaar zijn om gefosforyleerde STAT-eiwitten te kwantificeren, omvatten western blotting en de enzyme-linked immunosorbent assay (ELISA). Deze heterogene methoden zijn arbeidsintensief, low-throughput en vaak niet betrouwbaar (specifiek) in het geval van western blotting. Homogene (no-wash) methoden zijn beschikbaar, maar blijven duur.
Hier worden gedetailleerde protocollen verstrekt voor de gevoelige, robuuste en kosteneffectieve meting in een 384-well-formaat van endogene niveaus van gefosforyleerde STAT1 (Y701), STAT3 (Y705), STAT4 (Y693), STAT5 (Y694 / Y699) en STAT6 (Y641) in cellysaten van adherente of suspensiecellen met behulp van het nieuwe THUNDER time-resolved Förster resonance energy transfer (TR-FRET) -platform. De workflow voor de cellulaire test is eenvoudig, snel en ontworpen voor high-throughput screening (HTS). Het testprotocol is flexibel, maakt gebruik van een monster met een laag volume (15 μL), vereist slechts één reagenstoevoegingsstap en kan worden aangepast aan toepassingen met een lage doorvoer en een hoge doorvoer. Elke fosfo-STAT sandwich immunoassay wordt gevalideerd onder geoptimaliseerde omstandigheden met bekende agonisten en remmers en genereert de verwachte farmacologie en Z’-factor waarden. Omdat TR-FRET-assays ratiometrisch zijn en geen wasstappen vereisen, bieden ze een veel betere reproduceerbaarheid dan traditionele benaderingen. Samen biedt deze reeks assays nieuwe kosteneffectieve hulpmiddelen voor een uitgebreidere analyse van specifieke gefosforyleerde STAT-eiwitten na celbehandeling en de screening en karakterisering van specifieke en selectieve modulatoren van de JAK / STAT-signaleringsroute.
Introduction
De JAK/STAT-signaleringsroute speelt een sleutelrol bij het bemiddelen van cellulaire reacties op diverse cytokines, interferonen, groeifactoren en gerelateerde moleculen1,2. De binding van deze liganden aan specifieke celoppervlakreceptoren resulteert in de activering van JAKs, die op hun beurt STAT-eiwitten activeren door fosforylering van specifieke tyrosineresiduen. STAT-fosforylering resulteert in hun dimerisatie en translocatie in de kern, waar ze hun effect uitoefenen op de transcriptie van gereguleerde doelgenen. De STAT-familie bestaat uit zeven leden: STAT1, STAT2, STAT3, STAT4, STAT5a, STAT5b en STAT6. De leden spelen een complexe en essentiële rol in de regulatie van fysiologische celprocessen, waaronder proliferatie, differentiatie, apoptose, angiogenese en regulatie van het immuunsysteem. De abnormale activering van STAT-signaalroutes is betrokken bij veel menselijke ziekten, met name kanker en immuungerelateerde aandoeningen3,4. Daarom is het vermogen om STAT-eiwitfosforylatie binnen de inheemse celsignaleringsomgeving te beoordelen belangrijk voor zowel academisch als geneesmiddelenontdekkingsonderzoek.
Tot op heden zijn de conventionele methoden die worden gebruikt om intracellulaire gefosforyleerde eiwitniveaus te meten, inclusief STATs, gebaseerd op antilichamen en omvatten western blotting, ELISA en fosfoflowcytometrie. Deze heterogene methoden zijn arbeidsintensief, tijdrovend, foutgevoelig, lage doorvoer en vaak onbetrouwbaar (bijv. Specificiteitsproblemen) in het geval van western blotting5. Homogene assays vereisen daarentegen minder experimentele stappen, gebruiken kleinere steekproefvolumes en zijn vatbaar voor HTS. Er zijn vijf homogene celgebaseerde immunoassayplatforms in de handel beschikbaar die kunnen worden gebruikt om JAK-afhankelijke fosforylering van STATs in cellysaten kwantitatief te monitoren: SureFire, HTRF, LANCE, LanthaScreen en Lumit. Elk van deze platforms heeft zijn voor- en nadelen.
SureFire is gebaseerd op luminescente zuurstof channeling-technologie, die donor- en acceptorparels gebruikt die zijn gecoat om specifiek een paar antilichamen te vangen, waarvan er één is gebiotinyleerd. In aanwezigheid van gefosforyleerd eiwit brengen de twee antilichamen de donor- en acceptorparels in de nabijheid, waardoor een chemiluminescent signaal kan worden gegenereerd6. Hoewel veelzijdig en gevoelig, is deze technologie duur, wordt beïnvloed door biotine in het kweekmedium, is zeer gevoelig voor omgevingstemperatuur en licht en vereist een speciale lezer voor detectie. HTRF en LANCE zijn beide gebaseerd op TR-FRET-technologie die gebruik maakt van langlevende luminescerende lanthanide-ioncomplexen (Europium- of Terbiumchelaten of Europiumcryptaat) als donormoleculen en verrode fluoroforen als de acceptormoleculen7. Wanneer twee eiwitspecifieke antilichamen gelabeld met donor- of acceptormoleculen in de nabijheid worden gebracht, vindt FRET plaats, waardoor een toename van de fluorescentie van de acceptor en een afname van de fluorescentie van de donor ontstaat. Deze langlevende fluorescerende signalen kunnen op een tijdsgeoploeide en ratiometrische manier worden gemeten om testinterferentie te verminderen en de gegevenskwaliteit te verhogen. Andere voordelen van TR-FRET zijn dat het niet lichtgevoelig is, herhaalde metingen mogelijk maakt en een lange signaalstabiliteit vertoont. Hoewel TR-FRET op grote schaal wordt geïmplementeerd in HTS vanwege zijn veelzijdigheid, gevoeligheid en hoge robuustheid, zijn alle commerciële TR-FRET-gebaseerde testplatforms duur, waardoor de brede toepassing ervan in academische en kleine industriële laboratoria wordt uitgesloten. De LanthaScreen-test maakt ook gebruik van een op TR-FRET gebaseerde uitlezing, maar is afhankelijk van een gemanipuleerde U2OS-cellijn die stabiel groen fluorescerend eiwit (GFP) -STAT1-fusie-eiwit tot expressie brengt in combinatie met een terbium-gelabeld fosfo-specifiek STAT1-antilichaam8. Naast het feit dat deze methode beperkt is in termen van keuze van signaaleiwitten, vereist deze methode de aankoop van dure getransfecteerde cellijnen, waardoor de toepasbaarheid ervan wordt verminderd en de mogelijkheid van experimentele artefacten wordt vergroot. Lumit is een generiek bioluminescent immunoassay-platform dat secundaire antilichamen (anti-muis en anti-konijn) gebruikt die chemisch zijn gelabeld met de kleine en grote NanoBit-subeenheden van NanoLuc Luciferase9. De binding van twee primaire antilichamen aan het doeleiwit brengt de secundaire antilichamen in de nabijheid om een actief enzym te vormen dat een luminescentiesignaal genereert. Hoewel luminescentie over het algemeen een gevoelige en robuuste uitlezing is, beperkt de vereiste voor primaire antilichamen die in twee verschillende soorten zijn verhoogd de keuzes voor het ontwerp van de test. Bovendien kan het gebruik van secundaire antilichamen in complexe monstermatrixen gevoelig zijn voor assay-interferentie.
Er bestaat dus nog steeds behoefte aan een betrouwbaar, snel, maar betaalbaar testplatform op basis van cellen voor het meten van individuele gefosforyleerde en totale STAT-eiwitten op een manier die compatibel is met HTS. Om aan deze behoefte te voldoen, werd een nieuw high-throughput celgebaseerd immunoassayplatform ontwikkeld op basis van een verbeterde TR-FRET-technologie (THUNDER) en ontworpen om eenvoudige, gevoelige, robuuste en kosteneffectieve meting van endogene tot expressie gebrachte intracellulaire eiwitten (gefosforyleerd of totaal) in cellysaten mogelijk te maken. De voordelen van deze technologie komen voort uit de combinatie van een donor/acceptor FRET-paar met uitzonderlijke spectrale compatibiliteit en TR-FRET-signaal, rigoureus gevalideerde antilichamen en geoptimaliseerde lysisbuffers. Deze assays zijn geformatteerd als sandwich immunoassays en maken gebruik van een eenvoudige workflow in drie stappen (figuur 1). Cellen worden eerst behandeld om eiwitfosforylatie te moduleren en vervolgens gelyseerd met de specifieke lysisbuffer in de kit. Het doelgefosforyleerde of totale STAT-eiwit in het cellysaat wordt gedetecteerd in een enkele reagenstoevoegings- en incubatiestap met een paar fluorofoor-gelabelde antilichamen die verschillende epitopen op het doeleiwit herkennen (figuur 2). Eén antilichaam wordt gelabeld met een Europium-chelaatdonor (Eu-Ab1), terwijl het tweede antilichaam wordt gelabeld met een verrode acceptorfluoofoor (FR-Ab2). De twee gelabelde antilichamen binden zich aan het eiwit in oplossing, waardoor de twee labels dicht bij elkaar komen. Excitatie van het donor-europiumchelaat bij 320 of 340 nm activeert een FRET naar de acceptor, die een langlevend TR-FRET-signaal uitzendt bij 665 nm evenredig met de concentratie van doeleiwit (gefosforyleerd of totaal) in het cellysaat.
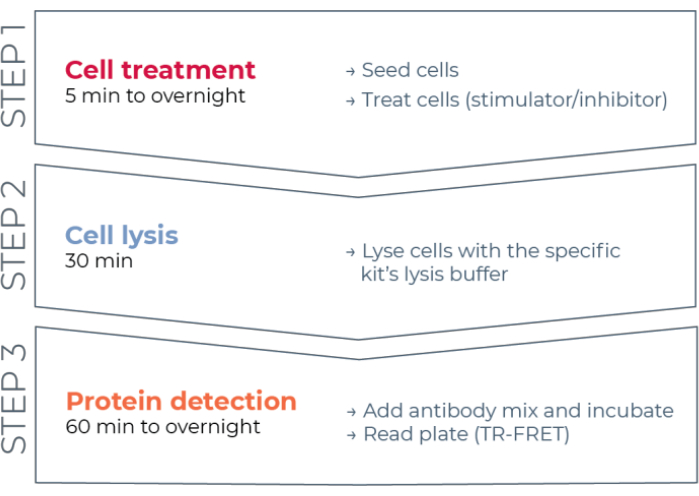
Figuur 1: TR-FRET assay workflow. De workflow bestaat uit drie stappen: celbehandeling, cellysis en eiwitdetectie met BEHULP VAN TR-FRET. In het tweeplatentestprotocol worden lysaten overgebracht naar een witte 384-well detectieplaat, terwijl in het one-plate protocol alle stappen worden uitgevoerd in dezelfde witte 384-well detectieplaat (all-in-one-well protocol). Ongeacht het gebruikte testprotocol wordt eiwitdetectie uitgevoerd in hetzelfde totale volume (20 μL per put). Afkorting: TR-FRET = time-resolved Förster resonantie energieoverdracht. Klik hier om een grotere versie van deze figuur te bekijken.
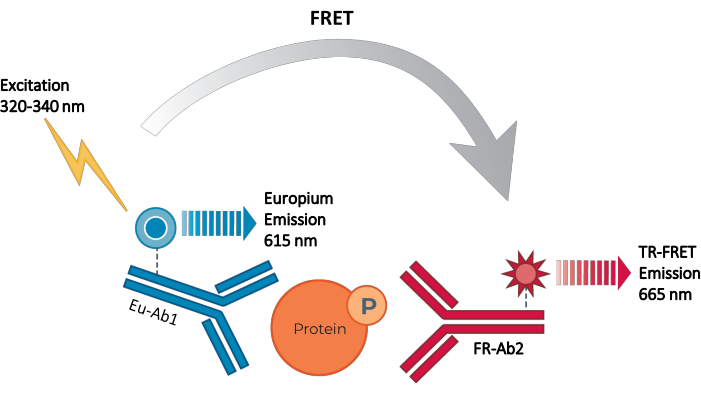
Figuur 2: TR-FRET sandwich immunoassay principe. Eén antilichaam wordt gelabeld met de Europium chelaatdonor (Eu-Ab1) en het tweede met de verrode kleine fluorofoor acceptor (FR-Ab2). De twee gelabelde antilichamen binden specifiek aan verschillende epitopen op het doeleiwit (gefosforyleerd of totaal) in het cellysaat, waardoor de twee fluoroforen in de buurt komen. Excitatie van het donor-Europiumchelaat bij 320 of 340 nm veroorzaakt een FRET van de donor naar de acceptormoleculen, die op hun beurt een signaal uitzenden bij 665 nm. Dit signaal is evenredig met de concentratie eiwit in het cellysaat. Bij afwezigheid van het specifieke doeleiwit zijn de donor- en acceptorfluooforen te ver van elkaar verwijderd om FRET te laten optreden. Afkortingen: FRET = Förster resonantie energieoverdracht; TR-FRET = tijd-opgeloste FRET; Ab = antilichaam; FR = verrood; Eu – Europiumchelaat; P = fosforylering. Klik hier om een grotere versie van deze figuur te bekijken.
Hier worden gedetailleerde protocollen verstrekt voor het meten, in een 384-well-formaat, van de intracellulaire niveaus van gefosforyleerde STAT1 (Y701), STAT3 (Y705), STAT4 (Y693), STAT5 (Y694/Y699) en STAT6 (Y641), samen met de totale STAT1, STAT3, STAT5 en STAT6, in cellysaten van adherent- of suspensiecellen met behulp van het THUNDER TR-FRET-platform. Deze protocollen definiëren stappen voor celbehandeling, lysis en TR-FRET-gebaseerde doeleiwitdetectie met behulp van een twee-plaat overdrachtsprotocol of een één-plaat all-in-one-well-protocol. Deze celgebaseerde assays worden toegepast voor het bepalen van het farmacologische profiel van bekende activatoren en remmers van de JAK/STAT-route. De robuustheid en geschiktheid van geselecteerde testen voor HTS worden aangetoond. Ten slotte worden belangrijke experimenten voor assay-optimalisatie besproken, samen met aanbevelingen voor het oplossen van problemen met assays.
Protocol
Representative Results
Discussion
Vergeleken met conventionele methoden voor fosfoproteïne-analyse zoals western blotting en ELISA-gebaseerde methoden, is de workflow voor een THUNDER TR-FRET cellulaire test eenvoudig en snel, maakt gebruik van een monster met een laag volume (15 μL), is ontworpen voor HTS in een 384-well formaat en is zeer vatbaar voor automatisering. Het testprotocol is flexibel en kan gemakkelijk worden aangepast aan zowel toepassingen met een gemiddelde als hoge doorvoer. Assays kunnen worden uitgevoerd met behulp van een twee-plaa…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Geen.
Materials
| 96-well microplate, clear, flat bottom, polystyrene, tissue culture-treated, sterile | Corning | 3595 | This is the plate for culturing cells when using the two-plate assay protocol. Other cell culture 96-well plates can be used |
| 384-well microplate, white, low-volume | PerkinElmer | 6007290 | This is the plate for TR-FRET detection when using the two- or one-plate assay protocols. Other low-volume, white 384-well plates can be used |
| A431 cell line | ATCC | CRL-1555 | |
| Adhesive microplate seal | PerkinElmer | 6050185 | |
| DMSO | Fisher | D159-4 | |
| Dulbecco’s modified Eagle medium (DMEM) | Wisent | 319-005-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| EnVision Xcite Multilabel plate reader | PerkinElmer | 2104-0020A | The assays can be performed on a variety of plate readers equipped with the TR-FRET option |
| Erlotinib hydrochloride | Sigma | CDS022564 | |
| Falcon tissue culture treated flasks | Fisher | 13-680-65 | |
| Fetal bovine serum (FBS) | Wisent | 098-150 | |
| HeLa cell line | ATCC | CCL-2 | |
| JAK Inhibitor 1 | Cayman Chemical | 15146 | |
| Orbital plate shaker | Many options available | Not applicable | |
| Recombinant human EGF | PeproTech | AF-100-15 | |
| Recombinant human IFNα2b | ProSpec | CYT-460 | |
| Recombinant human IL-4 | R&D Systems | 204-IL | |
| Roswell Park Memorial Institute 1640 medium (RPMI) | Wisent | 350-007-CL | THUNDER TR-FRET is compatible with culture medium containing phenol red |
| THUNDER Phospho-STAT1 (Y701) + Total STAT1 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT1PT-500 | |
| THUNDER Phospho-STAT3 (Y705) + Total STAT3 Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT3PT-500 | |
| THUNDER Phospho-STAT4 (Y693) + Total STAT4 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT4PT-500 | |
| THUNDER Phospho-STAT5 (Y694/Y699) + Total STAT5 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT5PT-500 | |
| THUNDER Phospho-STAT6 (Y641) + Total STAT6 TR-FRET Cell Signaling Assay Kit | BioAuxilium Research | KIT-STAT6PT-500 | |
| Trypsin/EDTA 0.05% | Wisent | 325-542-CL | |
| U266B1 cell line | ATCC | TIB-196 | |
| Ultrapure water | NA | NA | Use Milli-Q grade water (18 MΩ.cm) to dilute Lysis Buffer and Detection Buffer |
References
- Villarino, A., Kanno, Y., O’Shea, J. Mechanisms and consequences of Jak-STAT signaling in the immune system. Nature Immunology. 18 (4), 374-384 (2017).
- Hammarén, H. M., Virtanen, A. T., Raivola, J., Silvennoinen, O. The regulation of JAKs in cytokine signaling and its breakdown in disease. Cytokine. 118, 48-63 (2019).
- O’Shea, J. J., et al. The JAK-STAT pathway: impact on human disease and therapeutic intervention. Annual Review of Medicine. 66, 311-328 (2015).
- Verhoeven, Y., et al. et al. potential and controversy of targeting STAT family members in cancer. Seminars in Cancer Biology. 60 (2), 41-56 (2020).
- Gilda, J. E., et al. et al. blotting inaccuracies with unverified antibodies: need for a Western blotting minimal reporting standard (WBMRS). PLoS One. 10 (8), 0135392 (2015).
- Binder, C., et al. et al. and utilization of the SureFire phospho-STAT5 assay for a cell-based screening campaign. Assay and Drug Development Technologies. 6 (1), 27-37 (2008).
- Ayoub, M. A., et al. Homogeneous time-resolved fluorescence-based assay to monitor extracellular signal-regulated kinase signaling in a high-throughput format. Frontiers in Endocrinology. 5, 94 (2014).
- Robers, M. B., Machleidt, T., Carlson, C. B., Bi, K. Cellular LanthaScreen and beta-lactamase reporter assays for high-throughput screening of JAK2 inhibitors. Assay and Drug Development Technologies. 6 (4), 519-529 (2008).
- Hwang, B., Engel, L., Goueli, S. A., Zegzouti, H. A. Homogeneous bioluminescent immunoassay to probe cellular signaling pathway regulation. Communications Biology. 3 (8), 1-12 (2020).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high-throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Osmond, R. I. W., Das, S., Crouch, M. F. Development of cell-based assays for cytokine receptor signaling, using an AlphaScreen SureFire assay format. Analytical Biochemistry. 403 (1-2), 94-101 (2010).
- Haan, C., et al. Jak1 has a dominant role over Jak3 in signal transduction through γc-containing cytokine receptors. Chemistry & Biology. 18 (3), 314-323 (2011).
- Kim, Y., Apetri, M., Luo, B., Settleman, J. E., Anderson, K. S. Differential effects of tyrosine kinase inhibitors on normal and oncogenic EGFR signaling and downstream effectors. Molecular Cancer Research. 13 (4), 765-774 (2015).
- Qian, J., et al. Comparison of two homogeneous cell-based kinase assays for JAK2 V617F: SureFire pSTAT5 and GeneBLAzer fluorescence resonance energy transfer assays. ASSAY and Drug Development Technologies. 10 (2), 212-217 (2012).
- Iversen, P. W., et al., Markossian, S., et al. HTS assay validation. Assay Guidance Manual. , (2012).
- Muelas, M. W., Ortega, F., Breitling, R., Bendtsen, C., Westerhoff, H. V. Rational cell culture optimization enhances experimental reproducibility in cancer cells. Scientific Reports. 8, 3029 (2018).

