ייצור והפעלה של זרימה רציפה, מערכת מיקרו-אלקטרופורציה עם זיהוי חלחול
Summary
פרוטוקול זה מתאר את טכניקות המיקרו-פבריקציה הנדרשות לבניית התקן אלקטרופורציה מיקרופלואידי במעבדה על שבב. מערך הניסוי מבצע טרנספקציות מבוקרות ברמת תא בודד בזרימה רציפה וניתן להרחיב אותן לתפוקות גבוהות יותר עם בקרה מבוססת אוכלוסייה. ניתן ניתוח המציג את היכולת לעקוב באופן חשמלי אחר מידת החדירה של קרום התא בזמן אמת.
Abstract
החידושים הטיפוליים הנוכחיים, כגון טיפול בתאי CAR-T, מסתמכים במידה רבה על העברת גנים בתיווך ויראלי. למרות יעילותה, טכניקה זו מלווה בעלויות ייצור גבוהות, מה שהביא להתעניינות בשימוש בשיטות חלופיות להעברת גנים. אלקטרופורציה היא גישה אלקטרו-פיזיקלית, לא ויראלית, להעברה תוך-תאית של גנים וחומרים אקסוגניים אחרים. עם יישום שדה חשמלי, קרום התא מאפשר באופן זמני העברה מולקולרית לתוך התא. בדרך כלל, אלקטרופורציה מבוצעת בקנה מידה מאקרו כדי לעבד מספר גדול של תאים. עם זאת, גישה זו דורשת פיתוח פרוטוקול אמפירי נרחב, שהוא יקר כאשר עובדים עם סוגי תאים ראשוניים וקשים להעברה. פיתוח פרוטוקולים ממושך, יחד עם הדרישה למתחים גדולים כדי להשיג עוצמות שדה חשמלי מספיקות כדי לחדור לתאים, הובילו לפיתוח התקני אלקטרופורציה בקנה מידה זעיר. התקני מיקרו-אלקטרופורציה אלה מיוצרים בטכניקות מיקרו-פבריקציה נפוצות ומאפשרים בקרה ניסיונית רבה יותר עם פוטנציאל לשמירה על יכולות תפוקה גבוהות. עבודה זו מתבססת על טכנולוגיה מיקרופלואידית-אלקטרופורציה המסוגלת לזהות את רמת החדירה של קרום התא ברמת תא בודד תחת זרימה רציפה. עם זאת, טכנולוגיה זו הוגבלה ל -4 תאים מעובדים בשנייה, ולכן גישה חדשה להגדלת תפוקת המערכת מוצעת ומוצגת כאן. טכניקה חדשה זו, המסומנת כבקרת משוב מבוססת אוכלוסיית תאים, בוחנת את תגובת חלחול התא למגוון תנאי פעימת אלקטרופורציה וקובעת את תנאי פולס האלקטרופורציה המתאימים ביותר לסוג התא הנבדק. לאחר מכן נעשה שימוש במצב תפוקה גבוהה יותר, שבו הדופק ‘האופטימלי’ הזה מוחל על השעיית התא במעבר. השלבים לייצור המכשיר, להגדרה ולהפעלה של הניסויים המיקרופלואידיים ולניתוח התוצאות מוצגים בפירוט. לבסוף, טכנולוגיית מיקרו-אלקטרופורציה זו מודגמת על ידי העברת קידוד פלסמיד DNA עבור חלבון פלואורסצנטי ירוק (GFP) לתאי HEK293.
Introduction
חידושים טיפוליים עכשוויים במחקר ביו-רפואי, כגון טיפול בתאי CAR-T (קולטן אנטיגן כימרי מהונדס) ועריכה גנטית באמצעות קריספר (רצפי דנ”א חוזרים פלינדרומיים קצרים בין-מרחביים באופן קבוע)/Cas9, מסתמכים במידה רבה על היכולת להעביר חומר אקסוגני הן בהצלחה והן ביעילות לחלל התוך-תאי1. בטיפול CAR-T, תקן הזהב לביצוע שלב העברת הגנים בייצור טיפול תאי הוא שימוש בווקטורים נגיפיים2. למרות שהעברת גנים בתיווך ויראלי היא שיטת העברה יעילה, יש לה גם כמה חסרונות. אלה כוללים עלויות ייצור, ציטוטוקסיות, אימונוגניות, פוטנציאל מוטגנזה/גידול ומגבלות גודל על הגנים שיסופקו3. מגבלות אלה הובילו למחקר ופיתוח של טכנולוגיות אספקה חלופיות, שאינן ויראליות.
אלקטרופורציה, חלופה להעברת גנים בתיווך ויראלי, מסתמכת על יישום של צורת גל אופטימלית של פולס חשמלי לביצוע טרנספקציות של דנ”א, רנ”א וחלבונים של תאים. בעקבות יישום של שדה חשמלי חיצוני, קרום התא נפגע לזמן קצר, מה שהופך את התא רגיש להעברה תוך תאית של חומרים אקסוגניים אטומים אחרת4. בהשוואה לאספקה בתיווך ויראלי, אלקטרופורציה היא יתרון מכיוון שהיא בדרך כלל בטוחה, קלה לתפעול ובעלת עלויות תפעול נמוכות. אלקטרופורציה יכולה לספק מטענים מולקולריים קטנים וגדולים כאחד ויכולה להיות יעילה בהעברת תאים ללא קשר לשושלת5. כדי להשיג תוצאות רצויות לאחר אלקטרופורציה, כלומר כדאיות טובה ויעילות אלקטרו-טרנספקציה טובה, יש לבצע אופטימיזציה משותפת של מגוון פרמטרים ניסיוניים. אלה כוללים את סוג התא6, צפיפות התא, ריכוז מולקולות7, תכונות חיץ אלקטרופורציה (למשל, הרכב מולקולרי, מוליכות ואוסמולריות)8, גודל/גיאומטריה של אלקטרודה9, וצורת גל של פולס חשמלי (צורה, קוטביות, מספר פולסים)10 (עיין באיור 1 להמחשה). למרות שלכל אחד מהפרמטרים הללו יכולה להיות השפעה משמעותית על התוצאות של ניסויי אלקטרופורציה, צורת הגל של הפולס נחקרה במיוחד בפירוט רב, שכן האנרגיה החשמלית של הפולסים המיושמים היא שורש הפשרה הפנימית בין כדאיות התא המתקבלת לבין יעילות האלקטרו-טרנספקציה8.
בדרך כלל, ניסויי אלקטרופורציה מבוצעים בקנה מידה מאקרו, שבו התאים תלויים ב-100 שניות של מיקרוליטרים של חיץ בין קבוצה של אלקטרודות גדולות בעלות לוח מקבילי בתוך קובט אלקטרופורציה. האלקטרודות מיוצרות בדרך כלל מאלומיניום עם מרחק אלקטרודה של 1-4 מ”מ. לאחר שהתאים נטענים ידנית באמצעות פיפטה, הקובט מחובר חשמלית למחולל פולסים חשמלי מגושם שבו המשתמש יכול להגדיר וליישם את הפרמטרים של צורת הגל של הפולס כדי לחשמל את מתלה התא. למרות שאלקטרופורציה בקנה מידה מאקרו או בתפזורת יכולה לעבד את צפיפות התאים >106 תאים למ”ל, תכונה זו יכולה להיות בזבזנית בעת מיטוב הגדרות צורת הגל של הפולס החשמלי. זה מדאיג במיוחד בעת אלקטרופורציה של סוגי תאים ראשוניים שבהם ניתן להגביל את מספר אוכלוסיית התאים. בנוסף, בשל המרחק הגדול בין האלקטרודות, מחולל הפולסים חייב להיות מסוגל לספק מתחים גדולים כדי להשיג עוצמות שדה חשמלי >1kV/cm11. מתחים גבוהים אלה גורמים לפיזור כוח התנגדותי דרך מאגר האלקטרוליטים וכתוצאה מכך לחימום ג’ול, מה שעלול להזיק לכדאיות התא המתקבל12. לבסוף, ביצוע אלקטרופורציה על תרחיף צפוף של תאים יהיה נטל באופן עקבי עם שונות מולדת ביעילות ההעברה החשמלית המתקבלת ובכדאיות התא. כל תא בהשעיה יכול לחוות חוזק שדה חשמלי שונה עקב התאים הסובבים אותו. תלוי אם חוזק השדה החשמלי המנוסה גדל או יורד, כדאיות התא המתקבלת או יעילות ההעברה החשמלית עשויות להיות מושפעות כל אחת לרעה11. חסרונות אלה של אלקטרופורציה בקנה מידה מאקרו הובילו למרדף ופיתוח של טכנולוגיות חלופיות הפועלות בקנה מידה זעיר ומאפשרות שליטה טובה יותר ברמת התא הבודד.
תחום הביו-MEMS, או מערכות מיקרו-אלקטרו-מכניות ביו-רפואיות, נובע מההתקדמות הטכנולוגית בתעשיית המיקרו-אלקטרוניקה. באופן ספציפי, שימוש בתהליכי מיקרו-פבריקציה לפיתוח מיקרו-התקנים לקידום המחקר הביו-רפואי. פיתוחים אלה כוללים פיתוח מערכי מיקרו-אלקטרודות לניטור חשמלי in vivo 13, מיקרו-אלקטרודות קיבוליות עבור אלקטרופורציה in situ14, התקני איבר-על-שבב ממוזערים 15, אבחון נקודת טיפול מיקרופלואידית 16, ביוסנסורים 17, ומערכות אספקת תרופות 18, כולל התקני ננו-אלקטרופורציה ומיקרו-אלקטרופורציה 19,20,21 . בשל היכולת לתכנן ולייצר התקנים באותו קנה מידה של תאים ביולוגיים, טכנולוגיות ננו-ומיקרו-אלקטרופורציה הן יתרון בהשוואה למקבילותיהן בקנה מידה מאקרו22,23. התקני אלקטרופורציה אלה מבטלים את הדרישה של יישומי פולסים במתח גבוה, מכיוון שמערכות אלקטרודות עם מרווחים של 10 עד 100 שניות של מיקרומטרים משולבות בדרך כלל. תכונה זו מפחיתה באופן דרסטי את הזרם דרך האלקטרוליט, אשר בתורו מפחית את הצטברות של מוצרי אלקטרוליזה רעילים ואת ההשפעות של חימום ג’ול במערכות אלה. התעלות בקנה מידה זעיר גם מבטיחות כי שדה חשמלי אחיד הרבה יותר מוחל באופן אמין על התאים במהלך יישום הדופק, וכתוצאה מכך תוצאות עקביות יותר24. בנוסף, מקובל גם שמכשירי מיקרו-אלקטרופורציה ישולבו בפלטפורמה מיקרופלואידית המאפשרת שילוב עתידי בטכנולוגיה אוטומטית לחלוטין, יכולת רצויה ביותר בייצור תרפיה תאית25. לבסוף, אלקטרופורציה בקנה מידה זעיר מאפשרת חקירה חשמלית של אירועי אלקטרופורציה. לדוגמה, ניתן לנטר את מידת החדירה של קרום התא בזמן אמת ברמת תא בודד26,27. מטרת שיטה זו היא לתאר את המיקרו-פברינציה, פעולת המערכת והניתוח של מכשיר מיקרו-אלקטרופורציה חד-תאי, המסוגל למדוד את מידת החדירות של קרום התא לצורך אופטימיזציה של פרוטוקולי אלקטרופורציה, ועם זאת להגדיל את התפוקה בהשוואה לקודמתה.
ביצוע אלקטרופורציה ברמת התא הבודד כבר אינה טכניקה חדשנית, כפי שהודגם לראשונה על ידי Rubinsky et al. בשנת 2001 עם פיתוח טכנולוגיית אלקטרופורציה של תאים סטטיים28. המיקרו-מכשיר שלהם היה חדשני מכיוון שהם היו הראשונים להדגים את היכולת לנטר חשמלית את אירוע האלקטרופורציה. זה הוביל עוד יותר לפיתוח של טכנולוגיות אלקטרופורציה סטטיות, חד-תאיות המסוגלות לזהות חשמלית את מידת החדירה של קרום התא באופן מקביל כדי להגדיל את התפוקה של המכשירים. עם זאת, אפילו עם מקביליות ועיבוד אצווה, התקנים אלה חסרים מאוד את המספר הכולל של תאים שהם יכולים לעבד ליחידת זמן29,30. מגבלה זו הובילה לפיתוח התקנים זורמים המסוגלים לבצע מיקרו-אלקטרופורציה ברמת תא יחיד בתפוקות גדולות בהרבה31. מעבר מכשיר זה, מסביבה סטטית לסביבה זרימה, מגביל את היכולת לנטר חשמלית את מידת החדירה של קרום התא בעקבות יישום פולס האלקטרופורציה. השיטה המתוארת בעבודה זו מגשרת על הפער בין שתי הטכנולוגיות הללו, טכנולוגיית מיקרו-אלקטרופורציה המסוגלת לזהות, לפעום ולנטר באופן חשמלי את מידת החדירה של קרום התא של תאים בודדים, באופן סדרתי בעל זרימה רציפה.
טכנולוגיה זו תוארה לאחרונה ב- Zheng et al. בעבודה זו הוצגו היכולות של טכנולוגיה זו עם השלמת מחקר פרמטרי, שבו הן המשרעת והן משך הזמן של פולס האלקטרופורציה היו מגוונים, והאות החשמלי שבא בעקבותיו, המעיד על חדירת קרום התא, נחקר32. התוצאות הראו כי עלייה בעוצמת פולס האלקטרופורציה (כלומר, עלייה בשדה החשמלי המופעל או עלייה במשך הפולס) גרמה לעלייה בחדירת קרום התא הנמדדת. כדי לאמת עוד יותר את המערכת, נוסף למתלה התא אינדיקטור פלואורסצנטי נפוץ לאלקטרופורציה מוצלחת, פרופידיום יודיד33, ותמונת פלואורסצנציה נלכדה מיד לאחר יישום הפולס החשמלי. האות האופטי, כלומר עוצמת הפלואורסצנטיות של פרופידיום יודיד בתוך התא, היה בקורלציה חזקה עם המדידה החשמלית של מידת החדירה של קרום התא, מה שמאמת את האמינות של מדידה חשמלית זו. עם זאת, עבודה זו שקלה רק את המסירה של המולקולה הקטנה פרופידיום יודיד, אשר יש משמעות מועטה עד אפסית לתרגום.
בעבודה זו, יישום חדש של טכנולוגיה זו מוצג כדי לשפר את התפוקה של המערכת תוך אספקת וקטור DNA פלסמיד פעיל ביולוגית (pDNA) והערכת יעילות ההעברה החשמלית של תאים מצופים מחדש ותרבית לאחר אלקטרופורציה. למרות שהעבודה הקודמת עולה בביצועיה על טכנולוגיות מיקרו-אלקטרופורציה קיימות המסוגלות למדוד חשמלית את אירוע האלקטרופורציה, המצב הנוכחי של המכשיר עדיין דורש זמני מעבר ארוכים של התא בין מערך האלקטרודות (~250 אלפיות השנייה) כדי לבצע את זיהוי התא, יישום הפולסים ומדידת החדירה של קרום התא. בערוץ יחיד, פעולה זו מגבילה את התפוקה ל- 4 תאים לשנייה. כדי להילחם במגבלה זו, מוצג רעיון חדש של אלקטרופורציה מבוקרת משוב מבוססת אוכלוסיית תאים לביצוע טרנספיקציה של pDNA. על ידי שימוש במאגר אלקטרופורציה היפו-פיזיולוגי של מוליכות, מערכת זו מאפשרת חקירה חשמלית של תאים בודדים על פני מספר רב של יישומי פולסים אלקטרופורציה. בהתבסס על התגובה החשמלית, נקבע פולס אלקטרופורציה ‘אופטימלי’. לאחר מכן מיושם מצב ‘תפוקה גבוהה’ שבו קביעת החדירה של קרום התא מתבטלת, קצב הזרימה מוגבר, ומחזור העבודה של פולס האלקטרופורציה מותאם לזמן המעבר של התא כדי להבטיח פעימה אחת לכל תא במעבר בין האלקטרודות. עבודה זו תספק פרטים נרחבים על שלבי המיקרו-פבריקציה לייצור המיקרו-מכשיר, החומר/הציוד והגדרתם הנדרשים לביצוע הניסוי, והפעלה/ניתוח של המכשיר ויעילות ההעברה החשמלית שלו (eTE).
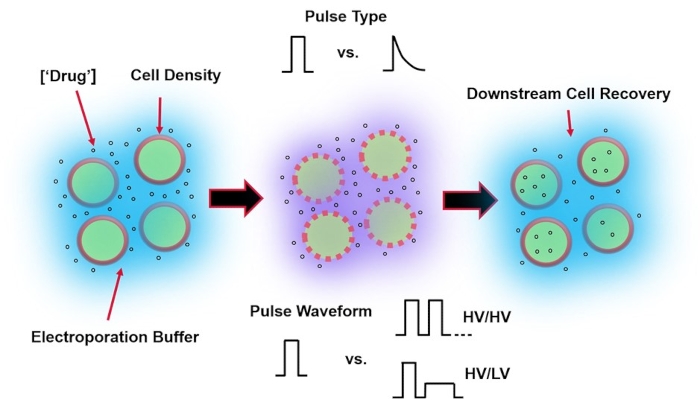
איור 1: גורמים ניסיוניים המשפיעים על תוצאות האלקטרופורציה. (משמאל) תרחיף תאים – גורמים חשובים שיש לקחת בחשבון לפני תחילת האלקטרופורציה כוללים: מטען (במקרה זה, pDNA), ריכוז, צפיפות תאים ותכונות חיץ אלקטרופורציה. תכונות חיץ אלקטרופורציה שיש לקחת בחשבון הן מוליכות, אוסמולריות וההרכב המולקולרי המדויק התורם לערכים אלה. (באמצע) יישום פולס – סוג הפולס המדויק (גל מרובע לעומת דעיכה מעריכית) וצורת הגל של הפולס (פולס יחיד לעומת רכבת דופק) חייבים להיות ממוטבים כדי למקסם הן את כדאיות התא המתקבלת והן את יעילות ההעברה החשמלית. רכבות פולסים נפוצות המיושמות בתהליכי אלקטרופורציה מורכבות בדרך כלל מסדרה של פולסים במתח גבוה (HV) או סדרה של פולסים המסתובבים בין סדרי גודל של פולסים של HV ומתח נמוך (LV). (זכות) יש למטב את שלבי העיבוד של Cell Recovery-Down-stream, בפרט, את מדיית תרבית תאי ההתאוששות שאליה מועברים התאים. לא מוצג (השמאל הקיצוני), ניתן ליישם שלבי עיבוד תאים נוספים במעלה הזרם לאופטימיזציה כוללת של תהליך האלקטרופורציה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Protocol
Representative Results
Discussion
המתודולוגיה המוצגת בפרוטוקול זה מתמקדת בעיקר במיקרו-פבריקציה של התקן מיקרופלואידי המשולב לאחר מכן במערך ניסויי מיוחד של אלקטרופורציה. המונח ‘מתכון’, המשמש לעתים קרובות כאשר מתארים את הפרטים של תהליך המיקרו-פברייקציה, רומז על החשיבות של מעקב/אופטימיזציה של כל שלב כדי לייצר בהצלחה מכשיר מת…
Disclosures
The authors have nothing to disclose.
Acknowledgements
המחברים רוצים להודות על תמיכה כספית של הקרן הלאומית למדע (NSF CBET 0967598, DBI IDBR 1353918) והכשרת הבוגרים של משרד החינוך האמריקאי בתחומים מתפתחים של דיוק ורפואה מותאמת אישית (P200A150131) למימון הסטודנט לתואר שני J.J.S. על המלגה.
Materials
| 150-mm diameter petri dishes | VWR | 25384-326 | step 6.1.1 to secure wafer |
| 24-well tissue culture plates | VWR | 10062-896 | step 10.3.6 to plate electroporated cells |
| 33220A Waveform/Function generator | Agilent | step 9.2.3 electroporation pulse generator | |
| 4'' Si-wafers | University Wafer | subsection 2.1 for microfluidic channel fabrication | |
| 6-well tissue culture plates | VWR | 10062-892 | step 8.1.8 to plate cells |
| Acetone | Fisher Scientific | A18-4 | step 2.1.2 for cleaning and step 5.1 photoresist lift-off |
| Allegra X-22R Centrifuge | Beckman Coulter | steps 8.1.4 , 8.3.2. and 8.3.3. to spin down cells | |
| AutoCAD 2018 | Autodesk | subsection 1.1. to design transparency masks | |
| Buffered oxide etchant 10:1 | VWR | 901621-1L | subsection 3.1 for HF etching |
| CCD Monochrome microscope camera | Hamamatsu | Orca 285 C4742-96-12G04 | step 11.2.3. for imaging |
| CMOS camera- Sensicam QE 1.4MP | PCO | subsection 9.3 part of the experimental setup | |
| Conductive Epoxy | CircuitWorks | CW2400 | subsection 7.6. for wire attachement |
| Conical Centrifuge Tubes, 15 mL | Fisher Scientific | 14-959-70C | step 8.1.4. for cell centrifuging |
| Dektak 3ST Surface Profilometer | Veeco (Sloan/Dektak) | step 2.1.15 and 5.4 for surface profilometry | |
| Disposable biopsy punch, 0.75 mm | Robbins Instruments | RBP075 | step 6.2.3 for inlet access |
| Disposable biopsy punch, 3 mm | Robbins Instruments | RBP30P | step 6.2.3 for outlet access |
| DRAQ5 | abcam | ab108410 | step 11.2.2. for live cell staining |
| Dulbecco’s Modified Eagle’s Medium | ThermoFisher Scientific | 11885084 | step 8.1.2. part of media composition |
| E3631A Bipolar Triple DC power supply | Agilent | step 9.2.1.-9.2.2.part of the experimental setup | |
| Eclipse TE2000-U Inverted Microscope | Nikon | subsection 9.3. part of the experimental setup | |
| EVG620 UV Lithography System | EVG | step 2.1.9. and 2.2.7. for UV Exposure | |
| Fetal Bovine Serum | Neuromics | FBS001 | step 8.1.2. part of media composition |
| FS20 Ultrasonic Cleaner | Fisher Scientific | subsection 5.1. for photoresist lift-off | |
| Glass Media Bottle with Cap, 100mL | Fisher Scientific | FB800100 | step 8.2.1. for buffer storage |
| Glass Media Bottle with Cap, 500mL | Fisher Scientific | FB800500 | step 8.1.2.for media storage |
| HEK-293 cell line | ATCC | CRL-1573 | subsection 8.1 for cell culturing |
| HEPES buffer solution | Sigma Aldrich | 83264-100ML-F | step 8.2.1 part of electroporation buffer composition |
| Hexamethyldisilazane | Sigma Aldrich | 379212-25ML | step 2.2.3 adhesion promoter |
| HF2LI Lock-in Amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| HF2TA Current amplifier | Zurich Instruments | subsection 9.2 part of the experimental setup | |
| Isopropyl Alcohol | Fisher Scientific | A459-1 | step 2.1.2 for cleaning, step 2.1.14 for rinsing wafer following SU-8 development, and step 6.3.1 for cleaning PDMS |
| IX81 fluorescence microscope | Olympus | step 11.2.3 for imaging | |
| L-Glutamine Solution | Sigma Aldrich | G7513-20ML | step 8.1.2. part of media composition |
| M16878/1BFA 22 gauge wire | AWC | B22-1 | subsection 7.5 for device fabrication |
| Magnesium chloride | Sigma Aldrich | 208337-100G | step 8.1.2 part of electroporation buffer composition |
| MF 319 Developer | Kayaku Advanced Materials | 10018042 | step 2.2.9. photoresist developer |
| Microposit S1818 photoresist | Kayaku Advanced Materials | 1136925 | step 2.2.4 positive photoresist for electrode patterning |
| Microscope slides, 75 x 25 mm | VWR | 16004-422 | step 2.2.1 electrode soda lime glass substrate |
| Model 2350 High voltage amplifier | TEGAM | 2350 | step 9.2.5. part of the experimental setup |
| National Instruments LabVIEW | National Instruments | data acquisition | |
| Needle, 30G x 1 in | BD Scientific | 305128 | step 10.1.1. part of the system priming |
| PA90 IC OPAMP Power circuit | Digi-key | 598-1330-ND | Part of the custom circuit |
| Penicillin-Streptomycin | Sigma Aldrich | P4458-20ML | step 8.1.2. part of media composition |
| Plasmid pMAX-GFP | Lonza | VCA-1003 | step 8.3.4. for intracellular delivery |
| Plastic tubing, 0.010'' x 0.030" | VWR | 89404-300 | step 10.1.2. for system priming |
| Platinum targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Potassium chloride | Sigma Aldrich | P9333-500G | step 8.2.1. part of electroporation buffer composition |
| Pump 11 PicoPlus microfluidic syringe pump | Harvard Apparatus | MA1 70-2213 | step 10.1.4. for system priming |
| PVD75 Physical vapor deposition system | Kurt J. Lesker | subsection 4.1. for physical vapor deposition | |
| PWM32 Spinner System | Headway Research | steps 2.1.6 and 2.2.2. for substrate coating with photoresist | |
| PX-250 Plasma treatment system | March Instruments | subsection 7.2 for PDMS and glass substrate bonding | |
| SDG1025 Function/Waveform generator | Siglent | step 9.2.2. part of the experimental setup | |
| Sodium hydroxide | Sigma Aldrich | S8045-500G | step 8.2.1. part of electroporation buffer composition |
| SU-8 2010 negative photoresist | Kayaku Advanced Materials | Y111053 | step 2.1.7. for microfluidic channel patterning |
| SU-8 developer | Microchem | Y010200 | step 2.1.12. for photoresist developing |
| Sucrose | Sigma Aldrich | S7903-1KG | step 8.2.1. part of electroporation buffer composition |
| Sylgard 184 elastomer kit | Dow Corning | 3097358-1004 | step 6.2.1 10 : 1 mixture of PDMS polymer and hardening agent |
| Syringe, 1 ml | BD Scientific | 309628 | step 8.3.4. part of system priming |
| SZ61 Stereomicroscope System | Olympus | subsection 7.3. for channel and electrode alignment | |
| Tissue Culture Treated T25 Flasks | Falcon | 353108 | step 8.1.2 for cell culturing |
| Titanium targets | Kurt J. Lesker | subsection 4.2. for physical vapor deposition | |
| Transparency masks | CAD/ART Services | steps 2.1.9. and 2.2.7. for photolithography | |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Sigma Aldrich | 448931-10G | step 6.1.2. for wafer silanization |
| Trypsin-EDTA solution | Sigma Aldrich | T4049-100ML | steps 8.1.3. and 8.3.1. for cell harvesting |
References
- Gao, Q. Q., et al. Therapeutic potential of CRISPR/Cas9 gene editing in engineered T-cell therapy. Cancer Medicine. 8 (9), 4254-4264 (2019).
- Aijaz, A., et al. Biomanufacturing for clinically advanced cell therapies. Nature Biomedical Engineering. 2 (6), 362-376 (2018).
- Milone, M. C., O’Doherty, U. Clinical use of lentiviral vectors. Leukemia. 32 (7), 1529-1541 (2018).
- Weaver, J. C., Chizmadzhev, Y. A. Theory of electroporation: A review. Bioelectrochemistry and Bioenergetics. 41 (2), 135-160 (1996).
- Kotnik, T., Rems, L., Tarek, M., Miklavcic, D. Membrane electroporation and electropermeabilization: mechanisms and models. Annual Review of Biophysics. 48, 63-91 (2019).
- Rosazza, C., Meglic, S. H., Zumbusch, A., Rols, M. P., Miklavcic, D. Gene electrotransfer: A mechanistic perspective. Current Gene Therapy. 16 (2), 98-129 (2016).
- Clauss, J., et al. Efficient non-viral T-cell engineering by sleeping beauty minicircles diminishing DNA toxicity and miRNAs silencing the endogenous T-cell receptors. Human Gene Therapy. 29 (5), 569-584 (2018).
- Sherba, J. J., et al. The effects of electroporation buffer composition on cell viability and electro-transfection efficiency. Scientific Reports. 10 (1), 3053 (2020).
- Lu, H., Schmidt, M. A., Jensen, K. F. A microfluidic electroporation device for cell lysis. Lab on a Chip. 5 (1), 23-29 (2005).
- Kar, S., et al. Single-cell electroporation: current trends, applications and future prospects. Journal of Micromechanics and Microengineering. 28 (12), (2018).
- Shi, J. F., et al. A review on electroporation-based intracellular delivery. Molecules. 23 (11), (2018).
- Wang, S. N., Zhang, X. L., Wang, W. X., Lee, L. J. Semicontinuous flow electroporation chip for high-throughput transfection on mammalian cells. Analytical Chemistry. 81 (11), 4414-4421 (2009).
- Wei, W. J., et al. An implantable microelectrode array for simultaneous L-glutamate and electrophysiological recordings in vivo. Microsystems & Nanoengineering. 1, (2015).
- Maschietto, M., Dal Maschio, M., Girardi, S., Vassanelli, S. In situ electroporation of mammalian cells through SiO2 thin film capacitive microelectrodes. Scientific Reports. 11 (1), (2021).
- Wu, Q. R., et al. Organ-on-a-chip: recent breakthroughs and future prospects. Biomedical Engineering Online. 19 (1), (2020).
- Pandey, C. M., et al. Microfluidics Based Point-of-Care Diagnostics. Biotechnology Journal. 13 (1), (2018).
- Vigneshvar, S., Sudhakumari, C. C., Senthilkumaran, B., Prakash, H. Recent advances in biosensor technology for potential applications – An overview. Frontiers in Bioengineering and Biotechnology. 4, (2016).
- Nuxoll, E. BioMEMS in drug delivery. Advanced Drug Delivery Reviews. 65 (11-12), 1611-1625 (2013).
- Kang, S., Kim, K. H., Kim, Y. C. A novel electroporation system for efficient molecular delivery into Chlamydomonas reinhardtii with a 3-dimensional microelectrode. Scientific Reports. 5, (2015).
- Zheng, M. D., Shan, J. W., Lin, H., Shreiber, D. I., Zahn, J. D. Hydrodynamically controlled cell rotation in an electroporation microchip to circumferentially deliver molecules into single cells. Microfluidics and Nanofluidics. 20 (1), (2016).
- Santra, T. S., Kar, S., Chang, H. Y., Tseng, F. G. Nano-localized single-cell nano-electroporation. Lab on a Chip. 20 (22), 4194-4204 (2020).
- Lee, W. G., Demirci, U., Khademhosseini, A. Microscale electroporation: challenges and perspectives for clinical applications. Integrative Biology. 1 (3), 242-251 (2009).
- Santra, T. S., Chang, H. Y., Wang, P. C., Tseng, F. G. Impact of pulse duration on localized single-cell nano-electroporation. Analyst. 139 (23), 6249-6258 (2014).
- Geng, T., Lu, C. Microfluidic electroporation for cellular analysis and delivery. Lab on a Chip. 13 (19), 3803-3821 (2013).
- Hsi, P., et al. Acoustophoretic rapid media exchange and continuous-flow electrotransfection of primary human T cells for applications in automated cellular therapy manufacturing. Lab on a Chip. 19 (18), 2978-2992 (2019).
- Khine, M., Ionescu-Zanetti, C., Blatz, A., Wang, L. P., Lee, L. P. Single-cell electroporation arrays with real-time monitoring and feedback control. Lab on a Chip. 7 (4), 457-462 (2007).
- Ye, Y. F., et al. Single-cell electroporation and real-time electrical monitoring on a microfluidic chip. 2020 33rd Ieee International Conference on Micro Electro Mechanical Systems (Mems 2020). , 1040-1043 (2020).
- Huang, Y., Rubinsky, B. Microfabricated electroporation chip for single cell membrane permeabilization. Sensors and Actuators a-Physical. 89 (3), 242-249 (2001).
- Guo, X. L., Zhu, R. Controllable in-situ cell electroporation with cell positioning and impedance monitoring using micro electrode array. Scientific Reports. 6, (2016).
- Punjiya, M., Nejad, H. R., Mathews, J., Levin, M., Sonkusale, S. A flow through device for simultaneous dielectrophoretic cell trapping and AC electroporation. Scientific Reports. 9, (2019).
- Wang, H. Y., Lu, C. Microfluidic electroporation for delivery of small molecules and genes into cells using a common DC power supply. Biotechnology and Bioengineering. 100 (3), 579-586 (2008).
- Zheng, M. D., et al. Continuous-flow, electrically-triggered, single cell-level electroporation. Technology. 5 (1), 31-41 (2017).
- Batista Napotnik, T., Miklavcic, D. In vitro electroporation detection methods – An overview. Bioelectrochemistry. 120, 166-182 (2018).
- MICROPOSIT™ S1800® G2 Series Photoresists. KAYAKU Available from: https://kayakuam.com/wp-content/uploads/2019/09/S1800-G2.pdf (2021)
- SU-8 2000 Permanent Negative Epoxy Photoresist. KAYAKU Available from: https://kayakuam.com/wp-content/uploads/2020/08/KAM-SU-8-2000-2000.5-2015-Datasheet-8.13.20-final.pdf (2001)
- Substrate Preparation. MicroChemicals Available from: https://www.microchemicals.com/technical_information/subtrate_cleaning_adhesion_photoresist.pdf (2021)
- Lisinenkova, M., Hahn, L., Schulz, J. . 4M 2006 – Second International Conference on Multi-Material Micro Manufacture. , 91-94 (2006).
- Beh, C. W., Zhou, W. Z., Wang, T. H. PDMS-glass bonding using grafted polymeric adhesive – alternative process flow for compatibility with patterned biological molecules. Lab on a Chip. 12 (20), 4120-4127 (2012).
- PA90 High Voltage Power Operational Amplifiers. APEX Available from: https://www.apexanalog.com/resources/products/pa90u.pdf (2021)
- Lissandrello, C. A., et al. High-throughput continuous-flow microfluidic electroporation of mRNA into primary human T cells for applications in cellular therapy manufacturing. Scientific Reports. 10 (1), 18045 (2020).

