大腸菌およびその他の細菌からの細胞外小胞のスケーラブルな単離および精製(英語)
Summary
細菌は、生理活性のある生体分子を運ぶナノメートルサイズの細胞外小胞(EV)を分泌します。EVの研究は、それらの生合成、微生物-微生物および宿主-微生物の相互作用および疾患における役割、ならびにそれらの潜在的な治療用途を理解することに焦点を当てています。EV研究の標準化を促進するために、さまざまな細菌からEVをスケーラブルに分離するためのワークフローが提示されます。
Abstract
多様な細菌種は、脂質、タンパク質、核酸、糖鎖、および親細胞に由来する他の分子からなる細胞外小胞(EV)を~20~300nm分泌します。EVは、種内および種間のコミュニケーションベクトルとして機能すると同時に、感染とコロニー形成の文脈における細菌と宿主生物の間の相互作用にも貢献します。健康と病気におけるEVに起因する多数の機能を考えると、 in vitro および in vivo 研究のためにEVを分離することへの関心が高まっています。物理的特性、すなわちサイズに基づいてEVを分離することで、多様な細菌培養物からの小胞の分離が容易になるという仮説が立てられました。
単離ワークフローは、細菌培養物からEVを単離するための遠心分離、ろ過、限外ろ過、およびサイズ排除クロマトグラフィー(SEC)で構成されています。ポンプ駆動のタンジェンシャルフローろ過(TFF)ステップが組み込まれ、スケーラビリティが向上し、数リットルの開始細胞培養から材料を分離できるようになりました。大腸 菌 をモデル系として、EV関連ナノルシフェラーゼおよび非EV関連mCherryをレポータータンパク質として発現させた。ナノルシフェラーゼは、そのN末端をサイトリシンAと融合させることによってEVを標的としました。関連するサイトライシンA-nanoLucを有する20〜100 nm EVを含む初期のクロマトグラフィー画分は、遊離タンパク質を含む後の画分とは異なっていました。EV関連ナノルシフェラーゼの存在は、免疫金標識および透過型電子顕微鏡によって確認された。このEV分離ワークフローは、他のヒト腸関連グラム陰性菌種およびグラム陽性菌種に適用できます。結論として、遠心分離、ろ過、限外ろ過/ TFF、およびSECを組み合わせることで、多様な細菌種からEVをスケーラブルに分離できます。標準化された分離ワークフローを採用することで、種を超えた微生物EVの比較研究が容易になります。
Introduction
細胞外小胞(EV)は、脂質、タンパク質、糖鎖、核酸で構成されるナノメートルサイズのリポソーム様構造であり、原核細胞と真核細胞の両方から分泌されます1。グラム陰性菌2からのEVの放出を視覚化する初期の研究以来、細菌のEVに起因する生物学的機能の数(直径20〜300 nm)は過去数十年で絶えず増加しています。それらの機能には、抗生物質耐性の転移3、バイオフィルム形成4、クオラムセンシング5、および毒素送達6が含まれます。また、細菌性EVを治療薬として使用すること、特にワクチン学7 とがん治療8への関心も高まっています。
EV研究への関心が高まっているにもかかわらず、隔離方法に関する技術的な課題がまだあります。具体的には、再現性があり、スケーラブルで、多様なEV産生生物に適合する分離法が求められています。EVの分離と研究方法を計画および報告するための統一された一連の原則を作成するために、国際細胞外小胞学会はMISEVポジションペーパー9を発行および更新します。さらに、EV-TRACKコンソーシアムは、透明性を高めるために、公開された原稿で使用されているEV分離の詳細な方法論を報告するためのオープンプラットフォームを提供します10。
このプロトコルでは、哺乳類細胞培養物からのEVの単離に使用された以前の方法論が、細菌細胞培養物からのEVの単離を可能にするために適応されました11,12。私たちは、スケーラブルなさまざまな微生物からEVを分離し、EVの純度と収量のバランスをとる方法を採用することを目指しました(MISEVポジションペーパー9で説明されています)。遠心分離とろ過によって細菌の細胞や破片を除去した後、培養液は遠心装置限外ろ過(最大~100 mLの容量の場合)またはポンプ駆動のTFF(大容量の場合)のいずれかによって濃縮されます。その後、EVは、小型EVの精製に最適化されたカラムを使用してSECによって分離されます。
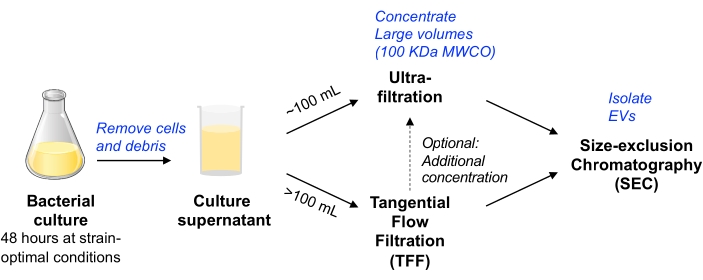
図1:細菌EV分離ワークフローの概略図。 略語:EV =細胞外小胞;TFF =タンジェンシャルフローろ過;SEC = サイズ排除クロマトグラフィー;MWCO =分子量カットオフ。この図の拡大版を表示するには、ここをクリックしてください。
Escherichia coliのマウス共生株(すなわち、大腸菌MP113)をモデル生物として使用し、以前に報告されているように、細胞ライシンAへの融合によってEV関連ナノルシフェラーゼを発現するように改変した14。ここで使用される方法は、少なくとも最大数リットルの細菌培養を処理し、EV関連タンパク質と非EV関連タンパク質を効果的に分離することができる。最後に、この方法は、他のグラム陽性菌種およびグラム陰性菌種にも使用することができる。報告された実験のすべての関連データは、EV-TRACKナレッジベース(EV-TRACK ID:EV210211)10に提出されました。
Protocol
Representative Results
Discussion
上記のプロトコルでは、スケーラブルで、さまざまなグラム陰性/陽性および好気性/嫌気性細菌からEVを確実に分離する方法が説明されています。手順全体を通していくつかの潜在的な停止点がありますが、馴化細菌培養培地からEVを分離するのに48時間以上かかることは避けることをお勧めします。
まず、細菌を培養して馴化細菌培養培地を生成することからなる。培養…
Disclosures
The authors have nothing to disclose.
Acknowledgements
上記の研究は、NIH TL1 TR002549-03トレーニング助成金によってサポートされました。粒子サイズ分析装置へのアクセスを容易にしてくれたジョンC.ティルトン博士とザカリートロイヤー博士(ケースウエスタンリザーブ大学)に感謝します。Lew Brown(スペクトラダイン)は、粒度分布データの分析に関する技術支援を提供します。コーネル大学のデビッド・パットナム博士は、pClyA-GFPプラスミド14を提供しました。ペンシルベニア大学のマーク・グーリアン博士は、 大腸菌 MP113を提供してくれました。
Materials
| 0.5 mL flat cap, thin-walled PCR tubes | Thermo Scientific | 3430 | it is important to use thin-walled PCR tubes to obtain accurate readings with Qubit |
| 16% Paraformaldehyde (formaldehyde) aqueous solution | Electron microscopy sciences | 15700 | |
| 250 mL Fiberlite polypropylene centrifuge bottles | ThermoFisher | 010-1495 | |
| 500 mL Fiberlite polypropylene centrifuge bottles | ThermoFisher | 010-1493 | |
| 65 mm Polypropylene Round-Bottom/Conical Bottle Adapter | Beckman Coulter | 392077 | Allows Vivacell to fit in rotor |
| Akkermansia mucinophila | ATCC | BAA-835 | |
| Amicon-15 (100 kDa MWCO) | MilliporeSigma | UFC910024 | |
| Avanti J-20 XPI centrifuge | Beckman Coulter | No longer sold by Beckman. Avanti J-26XP is closest contemporary model. | |
| Bacteroides thetaiotaomicron VPI 5482 | ATCC | 29148 | |
| Bifidobacterium breve | NCIMB | B8807 | |
| Bifidobacterium dentium | ATCC | 27678 | |
| Brain Heart infusion (BHI) broth | Himedia | M2101 | After autoclaving, Both BHI broth and agar were introduced into the anaerobic chamber, supplemented with Menadione (1 µg/L), hematin (1.2 µg/L), and L-Cysteine Hydrochloride (0.05%). They were then incubated for at least 24 h under anaerobic conditions before inoculation with the anaerobic bacterial strains. |
| C-300 microfluidics cartridge | Spectradyne | ||
| Chloramphenicol | MP Biomedicals | ICN19032105 | |
| Escherichia coli HST08 (Steller competent cells) | Takara | 636763 | |
| Escherichia coli MP1 | Dr. Mark Goulian (gift) | commensal bacteria derived from mouse gut | |
| Fiberlite 500 mL to 250 mL adapter | ThermoFisher | 010-0151-05 | used with Fiberlite rotor to enable 250 mL bottles to be used for smaller size of starting bacterial culture |
| Fiberlite fixed-angle centrifuge rotor | ThermoFisher | F12-6×500-LEX | fits 6 x 500 mL bottles |
| Formvar Carbon Film 400 Mesh, Copper | Electron microscopy sciences | FCF-400-CU | |
| Glutaraldehyde (EM-grade, 10% aqeous solution) | Electron microscopy sciences | 16100 | |
| Hematin | ChemCruz | 207729B | Stock solution was made in 0.2 M L-histidine solution as 1.2 mg/mL |
| Infinite M Nano+ Microplate reader | Tecan | This equibment was used to measure the mCherry fluorescence | |
| In-Fusion HD Cloning Plus | Takara | 638909 | For cloning of the PCR fragements into the PCR-lineraized vectors |
| JS-5.3 AllSpin Swinging-Bucket Rotor | Beckman Coulter | 368690 | |
| Lauria Bertani (LB) broth, Miller | Difco | 244620 | |
| L-Cysteine Hydrochloride | J.T. Baker | 2071-05 | It should be weighed and added directly to the autoclaved BHI media inside the anaerobic chamber |
| Masterflex Fitting, Polypropylene, Straight, Female Luer to Hose Barb Adapter, 1/8" ID; 25/PK | cole-parmer – special | HV-30800-08 | connection adapters for filtration tubing circuit |
| Masterflex Fitting, Polypropylene, Straight, Male Luer to Hose Barb Adapter, 1/8" ID; 25/PK | cole-parmer – special | HV-30800-24 | connection adapters for filtration tubing circuit |
| Masterflex L/S Analog Variable-Speed Console Drive, 20 to 600 rpm | Masterflex | HV-07555-00 | |
| Masterflex L/S Easy-Load Head for Precision Tubing, 4-Roller, PARA Housing, SS Rotor | Masterflex | EW-07514-10 | |
| Masterflex L/S Precision Pump Tubing, PharmaPure, L/S 16; 25 ft | Cole Palmer | EW-06435-16 | low-binding/low-leaching tubing |
| Menadione (Vitamin K3) | MP | 102259 | Stock solution was made in ethanol as 1 mg/mL |
| MIDIKROS 41.5CM 100K MPES 0.5MM FLL X FLL 1/PK | Repligen | D04-E100-05-N | TFF device we have used to filter up to 2 L of E. coli culture supernatant |
| Nano-Glo Luciferase Assay System | Promega | N1110 | This assay kit was used to measure the luminescence of the nluc reporter protein |
| NanoLuc (Nluc) Luciferase Antibody, clone 965808 | R&D Systems | MAB10026 | |
| nCS1 microfluidics resistive pulse sensing instrument | Spectradyne | ||
| nCS1 Viewer | Spectradyne | Analysis software for particle size distribution | |
| OneTaq 2x Master Mix with Standard Buffer | NEB | M0482 | DNA polymerase master mix used to perform the routine PCR reactions for colony checking |
| Protein LoBind, 2.0 mL, PCR clean tubes | Eppendorf | 30108450 | |
| Q5 High-Fidelity 2x Master Mix | NEB | M0492 | DNA polymerase master mix used to perform the PCR reactions needed for cloning |
| qEV original, 35 nm | Izon | maximal loading volume of 0.5 mL | |
| qEV rack | Izon | for use with the qEV-original SEC columns | |
| qEV-2, 35 nm | Izon | maximal loading volume of 2 mL | |
| Qubit fluorometer | ThermoFisher | Item no longer available. Closest available product is Qubit 4.0 Fluorometer (cat. No. Q33238) | |
| Qubit protein assay kit | ThermoFisher | Q33211 | Store kit at room temperature. Standards are stored at 4 °C. |
| Sorvall Lynx 4000 centrifuge | ThermoFisher | 75006580 | |
| SpectraMax i3x Microplate reader | Molecular Devices | This equipment was used to measure the nanoluciferase bioluminescence | |
| Stericup Quick-release-GP Sterile Vacuum Filtration system (150, 250, or 500 mL) | MilliporeSigma | S2GPU01RE S2GPU02RE S2GPU05RE |
One or multiple filters can be used to accommodate working volumes. In our experience, you can filter twice the volume listed on the product size. |
| Uranyl acetate | Electron microscopy sciences | 22400 | |
| Vinyl anaerobic chamber | Coy Lab | ||
| Vivacell 100, 100,000 MWCO PES | Sartorius | VC1042 | |
| Whatman Anotop 10 Plus syringe filters (0.02 micron) | MilliporeSigma | WHA68093002 | to filter MRPS diluent |
References
- Yanez-Mo, M., et al. Biological properties of extracellular vesicles and their physiological functions. Journal of Extracellular Vesicles. 4, 27066 (2015).
- Chatterjee, S. N., Das, J. Electron microscopic observations on the excretion of cell-wall material by Vibrio cholerae. Journal of General Microbiology. 49 (1), 1-11 (1967).
- Ciofu, O., Beveridge, T. J., Kadurugamuwa, J., Walther-Rasmussen, J., Hoiby, N. Chromosomal beta-lactamase is packaged into membrane vesicles and secreted from Pseudomonas aeruginosa. Journal of Antimicrobial Chemotherapy. 45 (1), 9-13 (2000).
- Yonezawa, H., et al. Outer membrane vesicles of Helicobacter pylori TK1402 are involved in biofilm formation. BMC Microbiology. 9, 197 (2009).
- Mashburn, L. M., Whiteley, M. Membrane vesicles traffic signals and facilitate group activities in a prokaryote. Nature. 437 (7057), 422-425 (2005).
- Kato, S., Kowashi, Y., Demuth, D. R. Outer membrane-like vesicles secreted by Actinobacillus actinomycetemcomitans are enriched in leukotoxin. Microbial Pathogenesis. 32 (1), 1-13 (2002).
- Petousis-Harris, H., et al. Effectiveness of a group B outer membrane vesicle meningococcal vaccine against gonorrhoea in New Zealand: a retrospective case-control study. Lancet. 390 (10102), 1603-1610 (2017).
- Kim, O. Y., et al. Bacterial outer membrane vesicles suppress tumor by interferon-gamma-mediated antitumor response. Nature Communications. 8 (1), 626 (2017).
- Thery, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Consortium, E. -. T., et al. EV-TRACK: transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14 (3), 228-232 (2017).
- Watson, D. C., et al. Efficient production and enhanced tumor delivery of engineered extracellular vesicles. Biomaterials. 105, 195-205 (2016).
- Watson, D. C., et al. Scalable, cGMP-compatible purification of extracellular vesicles carrying bioactive human heterodimeric IL-15/lactadherin complexes. Journal of Extracellular Vesicles. 7 (1), 1442088 (2018).
- Lasaro, M., et al. Escherichia coli isolate for studying colonization of the mouse intestine and its application to two-component signaling knockouts. Journal of Bacteriology. 196 (9), 1723-1732 (2014).
- Kim, J. Y., et al. Engineered bacterial outer membrane vesicles with enhanced functionality. Journal of Molecular Biology. 380 (1), 51-66 (2008).
- Beveridge, T. J. Structures of gram-negative cell walls and their derived membrane vesicles. Journal of Bacteriology. 181 (16), 4725-4733 (1999).
- Reimer, S. L., et al. Comparative analysis of outer membrane vesicle isolation methods with an Escherichia coli tolA mutant reveals a hypervesiculating phenotype with outer-inner membrane vesicle content. Frontiers in Microbiology. 12, 628801 (2021).

