Estudio del tráfico de proteínas de membrana en células fotorreceptoras de Drosophila utilizando proteínas marcadas con eGFP
Summary
Aquí, se describen métodos no invasivos para la localización de proteínas de membrana fotorreceptoras y la evaluación de la degeneración retiniana en el ojo compuesto de Drosophila utilizando fluorescencia eGFP.
Abstract
El tráfico de proteínas de membrana regula la incorporación y eliminación de receptores y canales iónicos en la membrana plasmática. Este proceso es fundamentalmente importante para la función celular y la integridad celular de las neuronas. Las células fotorreceptoras de Drosophila se han convertido en un modelo para estudiar el tráfico de proteínas de membrana. Además de la rodopsina, que tras la iluminación se internaliza desde la membrana del fotorreceptor y se degrada, el canal iónico similar al potencial del receptor transitorio (TRPL) en Drosophila exhibe una translocación dependiente de la luz entre la membrana del fotorreceptor rabdomeral (donde se encuentra en la oscuridad) y el cuerpo celular fotorreceptor (al que se transporta tras la iluminación). Este transporte intracelular de TRPL se puede estudiar de una manera simple y no invasiva mediante la expresión de TRPL marcado con eGFP en células fotorreceptoras. La fluorescencia eGFP se puede observar en el pseudopúplo profundo o mediante microscopía de inmersión en agua. Estos métodos permiten la detección de fluorescencia en el ojo intacto y, por lo tanto, son útiles para ensayos de alto rendimiento y pruebas genéticas para mutantes de Drosophila defectuosos en la translocación de TRPL. Aquí, se explican en detalle la preparación de moscas, las técnicas microscópicas, así como los métodos de cuantificación utilizados para estudiar esta translocación de TRPL desencadenada por la luz. Estos métodos se pueden aplicar también para estudios de tráfico en otras proteínas fotorreceptoras de Drosophila , por ejemplo, rodopsina. Además, mediante el uso de proteínas rabdomerales marcadas con eGFP, estos métodos se pueden utilizar para evaluar la degeneración de las células fotorreceptoras.
Introduction
Al entregar y eliminar proteínas hacia y desde la membrana plasmática, el tráfico de proteínas de membrana en las neuronas controla el equipo de membrana plasmática con receptores y canales iónicos y, como resultado, regula la función neuronal. La mala regulación o los defectos en el tráfico de proteínas suelen tener efectos perjudiciales en las células y provocar una degeneración neuronal. En los seres humanos, esto puede causar enfermedades neurodegenerativas como la enfermedad de Alzheimer y Parkinson o la retinosis pigmentaria1. Los fotorreceptores en el ojo compuesto de Drosophila melanogaster se han convertido en un sistema modelo in vivo para estudiar el tráfico de proteínas de membrana2. Esto no solo se debe a la versatilidad genética de Drosophila que permite exámenes genéticos efectivos, sino también a que todos los componentes esenciales de la membrana fotorreceptora absorbente de luz se caracterizan con gran detalle y se dispone de técnicas microscópicas eficientes que se pueden aplicar al ojo de mosca. Estas técnicas son el foco de este artículo.
En las células fotorreceptoras de Drosophila, la membrana plasmática apical forma una pila densamente empaquetada de microvellosidades a lo largo de un lado de la célula, denominada rabdomero. Los rabdomeros de las células fotorreceptoras R1-6 están dispuestos en un patrón trapezoidal característico, mientras que las células fotorreceptoras R7 y R8 forman un solo rabdomero en el centro de este trapecio3. El tráfico de proteínas de membrana es necesario para un recambio regulado de proteínas de membrana rabdomeral como la rodopsina y los canales iónicos TRP (potencial de receptor transitorio) y TRPL (similar a TRP) activados por la luz para asegurar la cantidad adecuada de estas proteínas de fototransducción en el rabdomero. Las proteínas de membrana fotorreceptoras se sintetizan en el retículo endoplásmico y se transportan a través del aparato de Golgi al rabdomero. Después de la activación de la rodopsina por la luz, una molécula de rodopsina puede inactivarse por absorción de un segundo fotón o puede ser eliminada del rabdomero por endocitosis mediada por clatrina. La rodopsina endocitosa se degrada en el lisosoma o se recicla de nuevo al rabdomero 4,5. El canal iónico TRPL también se internaliza tras la activación de la cascada de fototransducción y sufre una translocación dependiente de la luz entre el rabdomero (donde se encuentra cuando las moscas se mantienen en la oscuridad) y un compartimento de almacenamiento enriquecido con ER en el cuerpo celular (al que se transporta dentro de varias horas después de la iluminación)6,7,8,9,10 . A diferencia de la rodopsina endocitosa, solo pequeñas cantidades de TRPL se degradan a través de la vía endolisosomal, y la mayoría se almacena intracelularmente en su lugar y se recicla de nuevo al rabdomero tras la adaptación oscura6. Por lo tanto, TRPL se puede utilizar para analizar el tráfico de proteínas de membrana plasmática desencadenado por la luz. Las células fotorreceptoras de Drosophila también se emplean para estudiar la degeneración neuronal. La degeneración de las células fotorreceptoras se determina con frecuencia mediante la evaluación de la estructura de los rabdomeros, que se desintegran como resultado de procesos degenerativos5.
Con el fin de estudiar la localización subcelular de TRPL y rodopsina en células fotorreceptoras o degeneración de células fotorreceptoras, se han aplicado aquí dos métodos de microscopía de fluorescencia que difieren con respecto a la velocidad de análisis y la resolución. Un método muy rápido y no invasivo que se puede utilizar para cribados genéticos pero con una resolución espacial limitada es la detección de fluorescencia en el pseudopúpilo profundo (DPP). El DPP es un fenómeno óptico de ojos compuestos de artrópodos cuyo origen geométrico ha sido explicado en detalle por Franceschini y Kirschfeld en 197111. En resumen, en varios planos ópticos debajo de la superposición de retina se pueden observar imágenes de rabdomeros de ommatidios adyacentes. En un plano focal a través del centro de la curvatura del ojo, estas proyecciones superpuestas forman una imagen que se asemeja al diseño trapezoidal de rabdomeros en un solo ommatidio solo órdenes de magnitud más grande. Este fenómeno también se puede observar independientemente de la expresión exógena de proteínas de fluorescencia (por ejemplo, TRPL::eGFP8), que sin embargo hacen que el DPP sea más fácil de detectar (Figura 1A-A”)12. Un segundo método no invasivo es la microscopía de inmersión en agua que se basa en la obtención de imágenes de proteínas marcadas con fluorescencia después de neutralizar ópticamente el aparato dióptrico de los ojos con agua (Figura 1B-C”)12. Utilizando el método de inmersión en agua, la cantidad relativa de TRPL::eGFP en los rabdomeros o cuerpo celular se puede evaluar cuantitativamente para células fotorreceptoras individuales. Además, las proteínas marcadas con fluorescencia no translocadoras se pueden utilizar para evaluar la integridad rabdomeral y determinar el curso temporal de una degeneración potencial de manera cuantitativa, como se describe aquí.
Si bien las grabaciones del DPP son, con mucho, los métodos más fáciles y rápidos de realizar, la resolución espacial de los datos que generan es limitada. Además, hay numerosas razones por las que un DPP puede estar ausente, que no son necesariamente discernibles por las propias imágenes de DPP. Dado que el DPP representa una suma de varios ommatidios, se pierde información sobre células individuales. Por lo tanto, las imágenes DPP de baja resolución cumplen una función importante en la detección de un gran número de moscas, pero generalmente deben ir seguidas de grabaciones de mayor resolución a través de microscopía de inmersión en agua. Las micrografías de inmersión en agua permiten interpretaciones sobre células individuales, defectos del desarrollo, morfología ocular, mala localización de proteínas o degeneración de la retina, así como la cuantificación de estos efectos. Este Protocolo describe estas dos técnicas en detalle.
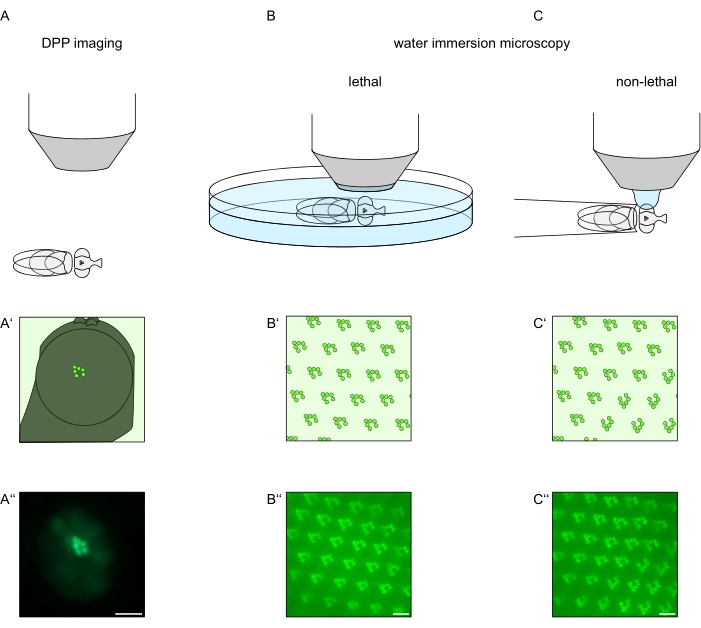
Figura 1: Descripción general de las variaciones de microscopía para el ojo de Drosophila presentadas en este Protocolo. Representaciones esquemáticas y micrografías ejemplares de imágenes de pseudopúpodo profundo fluorescente (DPP) (A-A‘‘), microscopía letal de inmersión en agua (B-B”) de rabdomeros fluorescentes y (C-C”) microscopía de gota de agua no letal de rabdomeros fluorescentes. Barra de escala (A”): 100 μm. Barras de escala (B”–C”): 10 μm. La figura ha sido modificada a partir de la referencia13. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
La aplicabilidad de las proteínas de fluorescencia y la simplicidad de la detección mediante imágenes DPP y microscopía de inmersión en agua de la retina han demostrado ser exitosas por muchos grupos12. Estrategias similares a las aquí presentadas se han utilizado en varios cribados genéticos para detectar defectos en los niveles de expresión de rodopsina, homeostasis, organización retiniana o integridad celular con la ayuda de Rh1::eGFP 17,18,19,20,21.<…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Nos gustaría agradecer a nuestros estudiantes investigadores a lo largo de los años. En particular, Nina Meyer, Sibylle Mayer, Juliane Kaim y Laura Jaggy, cuyos datos se han utilizado en este protocolo como resultados representativos. La investigación de nuestro grupo presentada aquí fue financiada por subvenciones de la Deutsche Forschungsgemeinschaft (Hu 839/2-4, Hu 839/7-1) a Armin Huber.
Materials
| 15 mL centrifuge tube | Greiner Bio-One | 188271 | |
| CO2 anaesthesia fly pad | Flystuff | 59-172 | |
| Cold light lamp (KL 1500 LCD) | Zeiss | ||
| Fiji/ImageJ | NIH | ||
| Fluorescence microscope with UV lamp, camera, filter set and software (AxioImager.Z1m, Axiocam 530 mono, 38 HE, ZEN2 blue edition) | Zeiss | ||
| Fluorescent tube (Lumilux T8, L 30W/840, 4000 K, G13) [1750 Lux, Ee470nm = 298 µW cm-2, Ee590nm = 215 µW cm-2] and [760 Lux, Ee470nm = 173 µW cm-2, Ee590nm = 147 µW cm-2] |
Osram | 4050300518039 | |
| Laboratory pipette (20-200 µL) | Eppendorf | ||
| Object slide | Roth | 0656.1 | |
| Petri dish (94 mm) | Greiner Bio-One | 633102 | |
| Pipette tips (200 µL) | Labsolute | 7695844 | |
| Plasticine (Blu-Tack) | Bostik | 30811745 | |
| Stereo microscope (SMZ445) | Nikon | ||
| Stereo microscope with UV lamp, camera, filer set and software (MZ16F, MC170 HD, GFP3, LAS 4.12) | Leica |
References
- Wang, X., Huang, T., Bu, G., Xu, H. Dysregulation of protein trafficking in neurodegeneration. Molecular Neurodegeneration. 9. 9, 31 (2014).
- Schopf, K., Huber, A. Membrane protein trafficking in Drosophila photoreceptor cells. European Journal of Cell Biology. 96 (5), 391-401 (2017).
- Hardie, R. C. The photoreceptor array of the dipteran retina. Trends in Neurosciences. 9, 419-423 (1986).
- Wang, T., Montell, C. Phototransduction and retinal degeneration in Drosophila. Pflügers Archiv – European Journal of Physiology. 454 (5), 821-847 (2007).
- Xiong, B., Bellen, H. J. Rhodopsin homeostasis and retinal degeneration: lessons from the fly. Trends in Neurosciences. 36 (11), 652-660 (2013).
- Bähner, M., et al. Light-regulated subcellular translocation of Drosophila TRPL channels induces long-term adaptation and modifies the light-induced current. Neuron. 34 (1), 83-93 (2002).
- Cronin, M. A., Lieu, M. -. H., Tsunoda, S. Two stages of light-dependent TRPL-channel translocation in Drosophila photoreceptors. Journal of Cell Science. 119, 2935-2944 (2006).
- Meyer, N., Joel-Almagor, T., Frechter, S., Minke, B., Huber, A. Subcellular translocation of the eGFP-tagged TRPL channel in Drosophila photoreceptors requires activation of the phototransduction cascade. Journal of Cell Science. 119, 2592-2603 (2006).
- Oberegelsbacher, C., Schneidler, C., Voolstra, O., Cerny, A., Huber, A. The Drosophila TRPL ion channel shares a Rab-dependent translocation pathway with rhodopsin. European Journal of Cell Biology. 90 (8), 620-630 (2011).
- Wagner, K., Smylla, T. K., Lampe, M., Krieg, J., Huber, A. Phospholipase D and retromer promote recycling of TRPL ion channel via the endoplasmic reticulum. Traffic. , (2021).
- Franceschini, N., Kirschfeld, K. Les phénoménes de pseudopupille dans l’oeil compose de Drosophila. Kybernetik. 9 (5), 159-182 (1971).
- Pichaud, F., Desplan, C. A new visualization approach for identifying mutations that affect differentiation and organization of the Drosophila ommatidia. Development. 128 (6), 815-826 (2001).
- Smylla, T. K., Wagner, K., Huber, A. Application of fluorescent proteins for functional dissection of the Drosophila visual system. International Journal of Molecular Sciences. 22 (16), (2021).
- Meyer, N. Mechanisms of the light-dependent translocation of the ion channel TRPL in the photoreceptors of Drosophila melanogaster: Dissertation for obtaining the academic degree Dr. rer. nat. University of Karlsruhe (TH). , (2005).
- Meyer, N., Oberegelsbacher, C., Dürr, T. D., Schäfer, A., Huber, A. An eGFP-based genetic screen for defects in light-triggered subcelluar translocation of the Drosophila photoreceptor channel TRPL. Fly. 2 (1), 36-46 (2008).
- Zheng, L., Carthew, R. W. Lola regulates cell fate by antagonizing Notch induction in the Drosophila eye. Mechanisms of Development. 125 (1-2), 18-29 (2008).
- Hibbard, K. L., O’Tousa, J. E. A role for the cytoplasmic DEAD box helicase Dbp21E2 in rhodopsin maturation and photoreceptor viability. Journal of Neurogenetics. 26 (2), 177-188 (2012).
- Huang, Y., Xie, J., Wang, T. A Fluorescence-based genetic screen to study retinal degeneration in Drosophila. PloS One. 10 (12), 0144925 (2015).
- Zhao, H., Wang, J., Wang, T. The V-ATPase V1 subunit A1 is required for rhodopsin anterograde trafficking in Drosophila. Molecular Biology of the Cell. 29 (13), 1640-1651 (2018).
- Xiong, L., et al. ER complex proteins are required for rhodopsin biosynthesis and photoreceptor survival in Drosophila and mice. Cell Death and Differentiation. 27 (2), 646-661 (2020).
- Zhao, H., Wang, T. PE homeostasis rebalanced through mitochondria-ER lipid exchange prevents retinal degeneration in Drosophila. PLoS Genetics. 16 (10), 1009070 (2020).
- Cerny, A. C., et al. The GTP- and phospholipid-binding protein TTD14 regulates trafficking of the TRPL ion channel in Drosophila photoreceptor cells. PLoS Genetics. 11 (10), 1005578 (2015).
- Richter, D. Structural and functional analyses of TRP ion channels in the photoreceptor cells of Drosophila melanogaster: Dissertation for obtaining the academic degree Dr. rer, nat. University of Karlsruhe (TH). , (2007).
- Gambis, A., Dourlen, P., Steller, H., Mollereau, B. Two-color in vivo imaging of photoreceptor apoptosis and development in Drosophila. Developmental Biology. 351 (1), 128-134 (2011).
- Hardie, R. C., Liu, C. -. H., Randall, A. S., Sengupta, S. In vivo tracking of phosphoinositides in Drosophila photoreceptors. Journal of Cell Science. 128 (23), 4328-4340 (2015).
- Chakrabarti, P., et al. A dPIP5K dependent pool of phosphatidylinositol 4,5 bisphosphate (PIP2) is required for G-protein coupled signal transduction in Drosophila photoreceptors. PLoS Genetics. 11 (1), 1004948 (2015).

