Fremstilling af enantiopure ikke-aktiverede aziridiner og syntese af biemamid B, D og epiallo-isomuscarin
Summary
I denne undersøgelse forbereder vi både enantiomerer af aziridin-2-carboxylat, som anvendes i den asymmetriske syntese af alkaloider, herunder biemamid B og D, og (-) -epiallo-isomuscarin.
Abstract
Nitrogenholdige heterocykliske aziridiner er syntetisk meget værdifulde til fremstilling af azacykliske og acykliske molekyler. Det er imidlertid meget vanskeligt og besværligt at fremstille azariridiner i optisk rene former i stor skala for at anvende asymmetrisk syntese af azaforbindelser. Heldigvis opnåede vi med succes både enantiomerer (2R)- og (2S)-aziridin-2-carboxylater med den elektrondonerende α-methylbenzylgruppe ved ringkvælstof som ikke-aktiverede aziridiner. Disse startende aziridiner har to forskellige funktionelle grupper – stærkt reaktiv treledet ring og alsidig carboxylat. De kan anvendes i ringåbning eller ringtransformation med aziridin og i funktionel gruppetransformation til andre fra carboxylat. Begge disse enantiomerer blev anvendt til fremstilling af biologisk vigtige amino acykliske og / eller aza-heterocykliske forbindelser på en asymmetrisk måde. Specifikt beskriver denne rapport den første hensigtsmæssige asymmetriske syntese af både enantiomerer af 5, 6-dihydrouracil-type marine naturlige produkter biemamid B og D som potentielle TGF-β hæmmere. Denne syntese bestod af regio- og stereoselektiv ringåbningsreaktion af azieridin-2-carboxylat og efterfølgende dannelse af 4-aminoteterahydropyrimidin-2,4-dion. Endnu et eksempel i denne protokol behandlede en meget stereoselektiv Mukaiyama-reaktion af aziridin-2-carboxylat og silylenolether efter intramolekylær aziridinringåbning for at give let og letkøbt adgang til (-) epiallo-isomuscarin.
Introduction
Små ringe bestående af cyclopropaner, oxiriner og aziridiner findes i forskellige forbindelser såsom naturlige produkter og lægemidler 1,2. De bruges primært som udgangsmaterialer, der udnytter deres ringstamme. Blandt de tre-ringforbindelser er azieridin blevet undersøgt mindre omfattende på grund af dets ustabilitet og ukontrollable reaktivitet3. Som vist i de elektrostatiske potentialekort (figur 1) gør en gruppe knyttet til azieridinring-nitrogen, hvad enten det er elektrondonerende eller elektrontiltrækkende, nitrogenets grundlæggende karakter anderledes. Denne forskel giver en slående kontrast til reaktiviteten og selektiviteten af de tilsvarende aziridiner.
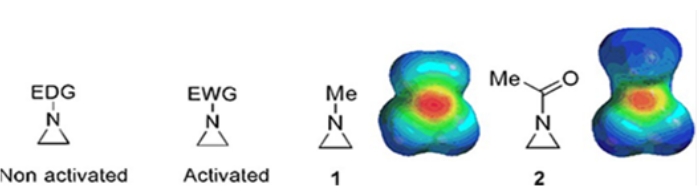
Figur 1: Kemiske strukturer af “aktiverede” og “ikke-aktiverede” aziridiner og elektrostatiske potentialekort over deres repræsentative eksempler N-methylaziridin og N-acetylaziridin4. Dette tal er blevet ændret med tilladelse fra Ranjith et al.4. Klik her for at se en større version af denne figur.
Når ringkvælstofet har en elektronudtagende gruppe, såsom sulfonat, fosfonat og carbamat, kalder vi det “aktiveret” aziridin. Dette er let reaktivt med nukleofiler for at kompensere for dets ustabilitet med et begrænset omfang af regiokemi. Disse aktiverede aziridiner fremstilles gennem forskellige katalytiske metoder og anvendes som udgangsmateriale. Meget af nyere aziridinkemi har behandlet disse aktiverede aziridiner. Aktiverede aziridiner lider imidlertid visse begrænsninger som følge af deres ustabilitet og begrænsede reaktionsomfang af ringåbningen. På den anden side er aziridiner, der bærer elektrondonerende substituenter, som alkyl eller substituerede alkylgrupper, ved ringkvælstof kaldet “ikke-aktiveret”4, relativt stabile under de fleste omstændigheder og kan efterlades på bænken i lang tid uden signifikant nedbrydning. De nukleofile ringåbningsreaktioner af ikke-aktiveret aziridin forekommer via dannelsen af aziridiniumioner. De fleste reaktioner af aziridinringåbning og ringtransformationer fortsætter på en meget regiokemisk måde. Imidlertid diskuterer meget få litteraturrapporter fremstillingen af optisk rene ikke-aktiverede aziridiner med substituenter på C2- eller C3-positionerne 5,6.
Dette papir viser den vellykkede fremstilling af α-methylbenzylgruppe-indeholdende chiral aziridin-2-carboxylatderivater, specifikt (-)-mentolyl (1R)-phenylethylaziridin-2-carboxylater som dets diastereomere blanding, fra reaktionen af 2,3-dibromopropionat og (1R) -phenylethylamin. Fra denne diastereomere blanding blev enantiopure (1R)-phenylethyl-(2R)- og (2S)-aziridin-2-carboxylater som deres (-)-mentolylestere opnået i optisk rene former ved selektiv omkrystallisation fra MeOH og n-pentan på multi-hundrede kilo skalaer (figur 1)7. Disse (-)-mentolestere kan let omdannes til deres ethyl- eller methylestere ved omesterificering under tilstedeværelse af magnesium- eller kaliumcarbonat7. Disse forbindelser kan også let fremstilles på laboratorieskala ud fra reaktionerne af alkyl 2,3-dibrompropionater eller vinyltriflatet af α-ketoester med chiral 2-phenylethylamin efterfulgt af adskillelse af den diastereomere blanding ved anvendelse af simpel flashkolonnekromatografi8.
Når vi har enantiopure chiral aziridin-2-carboxylat, kan vi syntetisere forskellige cykliske og acykliske nitrogenholdige biologisk vigtige målmolekyler baseret på funktionelle gruppetransformationer af carboxylat og stærkt regio- og stereoselektive aziridinringsåbningsreaktioner 6,9,10. Den første hensigtsmæssige asymmetriske syntese blev anvendt på både enantiomerer af 5, 6-dihydrouracil-type marine naturlige produkter biemamid B og D som potentielle TGF-β hæmmere11,12. For det andet blev den diastereoselektive syntese af β-(aziridin-2-yl)-β-hydroxy ketoner opnået ved Mukaiyama aldol-reaktion af optisk ren 1-(1-phenylethyl)-aziridin-2-carboxaldehyd og forskellige enolsilianer i nærværelse af ZnCl2 i højt udbytte (>82%) med næsten perfekt stereoselektivitet (98: 2 dr) via en kelationskontrolleret overgangstilstand. Disse blev anvendt til asymmetrisk syntese af epiallo-isomuscarinalkaloider 13,14,15.
Protocol
Representative Results
Discussion
Azieridiner som nitrogenholdige treledede heterocykler har et enormt potentiale for syntetiske startkampe eller mellemprodukter til fremstilling af nitrogenrige organiske molekyler. Baseret på gruppen, der bærer ved ringkvælstoffet, klassificeres de som “aktiverede” og “ikke-aktiverede” aziridiner, hvis kemiske reaktivitet og selektivitet er forskellige. Imidlertid er der meget begrænsede metoder til rådighed til at forberede denne værdifulde aziridin i en optisk aktiv form.
Protokollen…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Denne forskning blev støttet af National Research Foundation of Korea (NRF-2020R1A2C1007102 og 2021R1A5A6002803) med Center for New Directions in Organic Synthesis og et HUFS Grant 2022.
Materials
| (2R)-1-[(1R)-1-Phenylethyl]-2-aziridinecarboxylic acid (-)-menthol ester, 98% | Sigma-Aldrich | 57054-0 | |
| (2S)-1-[(1R)-1-Phenylethyl]-2-aziridinecarboxylic acid (-)-menthol ester | Sigma-Aldrich | 57051-6 | |
| 1-(3-Dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride | TCI | 424331-25 g | CAS No: 25952-53-8 |
| 1,4-Dioxane | SAMCHUN | D0654-1 kg | CAS No: 123-91-1 |
| 1-Hydroxybenzotriazole hydrate | Aldrich | 219-989-7-50 g | CAS No: 123333-53-9 |
| 2,6-Lutidine | Alfa Aesar | A10478-AP, 500 mL | CAS No: 108-48-5 |
| Acetonitrile | SAMCHUN | A0127-18 L | CAS No: 75-05-8 |
| Acetonitrile-d3 | Cambridge Isotope Laboratories, | 15G-744-25 g | CAS No: 2206-26-0 |
| Aluminum chloride hexahydrate | Aldrich | 231-208-1, 500 g | CAS No : 7784-13-6 |
| Bruker AVANCE III HD (400 MHz) spectrometer | Bruker | NA | |
| Chloroform-d | Cambridge Isotope Laboratories, | 100 g | CAS No: 865-49-6 |
| Dichloromethane | SAMCHUN | M0822-18 L | CAS No: 75-09-2 |
| Dimethyl sulfoxide-d6 | Cambridge Isotope Laboratories, | 25 g | CAS No: 2206-27-1 |
| Ethanol | EMSURE | 1009831000,1L | CAS No: 64-17-5 |
| Ethyl acetate | SAMCHUN | E0191-18 L | CAS No: 141-78-6 |
| High resolution mass spectra/MALDI-TOF/TOF Mass Spectrometry | AB SCIEX | 4800 Plus | High resolution mass spectra |
| JASCO P-2000 | JASCO | P-2000 | For optical rotation |
| Lithium aluminum hydride | TCI | L0203-100 g | CAS No: 16853-85-3 |
| L-Selectride, 1 M solution in THF | Acros | 176451000, 100 mL | CAS No: 38721-52-7 |
| Methanol | SAMCHUN | M0585-18 L | CAS No: 67-56-1 |
| N-[(9H-Fluoren-9-ylmethoxy)carbonyl]-β-alanine | TCI | F08825G-5 g | CAS No: 35737-10-1 |
| N-Ethyldiisopropylamine | Aldrich | 230-392-0, 100 mL | CAS No: 7087-68-5 |
| n-Hexane | SAMCHUN | H0114-18 L | CAS No: 110-54-3 |
| Ninhydrin | Alfa Aesar | A10409-250 g | CAS No: 485-47-2 |
| p-Anisaldehyde | aldrich | A88107-5 g | CAS No: 123-11-5 |
| Phosphomolybdic acid hydrate | TCI | P1910-100 g | CAS No: 51429-74-4 |
| Sodium azide | D.S.P | 703301-500 g | CAS No: 26628-22-8 |
| Sodium Hydride 60% dispersion in mineral oil | Sigma-Aldrich | 452912-100 G | CAS No: 7646-69-7 |
| Sodium hydroxide | DUKSAN | A31226-1 kg | CAS No: 1310-73-2 |
| Sodium sulfate | SAMCHUN | S1011-1 kg | CAS No: 7757-82-6 |
| Thin Layer Chromatography (TLC) | Merck | 100390 | |
| Tert-Butyldimethylsilyl trifluoromethanesulfonate, 98% | Aldrich | 274-102-0, 25 g | CAS NO: 69739-34-0 |
| Tetrahydrofuran | SAMCHUN | T0148-18 L | CAS No: 109-99-9 |
| Triethylethylamine | DAEJUNG | 8556-4400-1 L | CAS No: 121-44-8 |
| UV light | Korea Ace Sci | TN-4C | 254 nm |
| Zinc chloride, anhydrous, 98+% | Alfa Aesar | A16281-22100 g | CAS No : 7646-85-7 |
References
- Pitzer, K. S. Strain energies of cyclic hydrocarbons. Science. 101 (2635), 672 (1945).
- Dudev, T., Lim, C. Ring strain energies from ab initio calculations. Journal of the American Chemical Society. 120 (18), 4450-4458 (1998).
- D’hooghe, M., Ha, H. -. J. . Synthesis of 4- to 7-Membered Heterocycles by Ring Expansion. , (2016).
- Ranjith, J., Ha, H. -. J. Synthetic applications of aziridinium ions. Molecules. 26 (6), 1744 (2021).
- Sweeney, J. B. Aziridines: epoxides’ ugly cousins. Chemical Society Reviews. 31 (5), 247-258 (2002).
- Stankovic, S., et al. Regioselectivity in the ring opening of non-activated aziridines. Chemical Society Reviews. 41 (2), 643-665 (2012).
- Lee, W. K., Ha, H. -. J. Highlights of the chemistry of enantiomerically pure aziridine-2-carboxylates. Aldrichimica Acta. 36 (2), 57-63 (2003).
- Tranchant, M. J., Dalla, V., Jabin, I., Decroix, B. Reaction of vinyl triflates of α-keto esters with primary amines: efficient synthesis of aziridine carboxylates. Tetrahedron. 58 (42), 8425-8432 (2002).
- Ha, H. -. J., Jung, J. -. H., Lee, W. K. Application of regio- and stereoselective functional group transformation of chiral aziridine-2-carboxylate. Asian Journal of Organic Chemistry. 3 (10), 1020-1035 (2014).
- Kim, Y., et al. Preparation of 2,3-diaminopropionate from ring opening of aziridine-2-carboxylate. Tetrahedron Letters. 46 (25), 4407-4409 (2005).
- Srivastava, N., Macha, L., Ha, H. -. J. Total synthesis and stereochemical revision of biemamides B and D. Organic Letters. 21 (22), 8992-8996 (2019).
- Zhang, F., et al. Biemamides A-E, inhibitors of the TGF-β pathway that block the epithelial to mesenchymal transition. Organic Letters. 20 (18), 5529-5532 (2018).
- Srivastava, N., Ha, H. -. J. Highly efficient and stereoselective Mukaiyama Aldol reaction with chiral aziridine-2-carboxaldehyde and its synthetic applications. Asian Journal of Organic Chemistry. 11 (1), 2021005671 (2021).
- Kempter, I., et al. Synthesis and structural characterization of the isomuscarines. Tetrahedron. 70 (10), 1918-1927 (2014).
- Pirrrung, M. C., DeAmicis, C. V. Total synthesis of the muscarines. Tetrahedron Letters. 29 (2), 159-162 (1988).

