Beredning av enantiopure icke-aktiverade aziridiner och syntes av biemamid B, D och epiallo-isomuskarin
Summary
I denna studie förbereder vi båda enantiomererna av aziridin-2-karboxylat, som används vid asymmetrisk syntes av alkaloider, inklusive biemamid B och D, och (-)-epiallo-isomuskarin.
Abstract
Kvävehaltiga heterocyklineraziridiner är syntetiskt mycket värdefulla för framställning av azacykliska och acykliska molekyler. Det är emellertid mycket svårt och mödosamt att göra aziridiner i optiskt rena former i stor skala för att tillämpa asymmetrisk syntes av aza-föreningar. Lyckligtvis uppnådde vi framgångsrikt både enantiomerer (2R) – och (2S) -aziridin-2-karboxylater med den elektrondonerande α-metylbensylgruppen vid ringkväve som icke-aktiverade aziridiner. Dessa startaziridiner har två distinkta funktionella grupper – mycket reaktiv treledad ring och mångsidig karboxylat. De är tillämpliga vid ringöppning eller ringtransformation med aziridin och i funktionell grupptransformation till andra från karboxylat. Båda dessa enantiomerer användes vid framställning av biologiskt viktiga aminoacykliska och/eller aza-heterocykliska föreningar på ett asymmetriskt sätt. Specifikt beskriver denna rapport den första lämpliga asymmetriska syntesen av båda enantiomererna av 5, 6-dihydrouracil-typ marina naturprodukter biemamid B och D som potentiella TGF-β-hämmare. Denna syntes bestod av regio- och stereoselektiv ringöppningsreaktion av aziridin-2-karboxylat och efterföljande bildning av 4-aminoteterahydropyrimidin-2,4-dion. Ytterligare ett exempel i detta protokoll behandlade en mycket stereoselektiv Mukaiyama-reaktion av aziridin-2-karboxylat och silylenoleter, efter intramolekylär aziridinringöppning för att ge enkel och lätt tillgång till (-) -epiallo-isomuskarin.
Introduction
Små ringar bestående av cyklopropaner, oxiraner och aziridiner finns i olika föreningar såsom naturliga produkter och läkemedel 1,2. De används främst som utgångsmaterial som utnyttjar deras ringstam. Bland de tre-ring föreningarna har aziridin studerats mindre omfattande på grund av dess instabilitet och okontrollerbara reaktivitet3. Som visas i de elektrostatiska potentialkartorna (figur 1) gör en grupp fäst vid aziridinringkvävet, oavsett om det är elektrondonerande eller elektronadragande, kvävets grundlighet annorlunda. Denna skillnad ger en slående kontrast till reaktiviteten och selektiviteten hos motsvarande aziridiner.
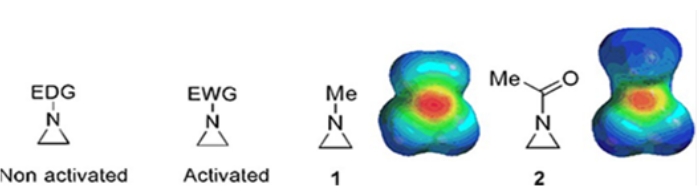
Figur 1: Kemiska strukturer av “aktiverade” och “icke-aktiverade” aziridiner och elektrostatiska potentialkartor över deras representativa exempel N-metylaziridin och N-acetylaziridin4. Denna siffra har ändrats med tillstånd från Ranjith et al.4. Klicka här för att se en större version av denna siffra.
När ringkväve har en elektronuttagande grupp, såsom sulfonat, fosfonat och karbamat, kallar vi det “aktiverat” aziridin. Detta är lätt reaktivt med nukleofiler för att kompensera för dess instabilitet med ett begränsat omfång av regiokemi. Dessa aktiverade aziridiner framställs genom olika katalytiska metoder och används som utgångsmaterial. Mycket av den senaste tidens aziridinkemi har behandlat dessa aktiverade aziridiner. Aktiverade aziridiner lider emellertid av vissa begränsningar till följd av deras instabilitet och begränsade reaktionsomfång för ringöppningen. Å andra sidan är aziridiner som bär elektrondonerande substituenter, som alkyl- eller substituerade alkylgrupper, vid ringkvävet som kallas “icke-aktiverat”4, relativt stabila under de flesta omständigheter och kan lämnas på bänken under lång tid utan signifikant sönderdelning. De nukleofila ringöppningsreaktionerna av icke-aktiverat aziridin sker via bildandet av aziridiniumjoner. De flesta reaktioner av aziridinringöppning och ringtransformationer fortsätter på ett mycket regiokemiskt sätt. Mycket få litteraturrapporter diskuterar emellertid beredningen av optiskt rena icke-aktiverade aziridiner med substituenter vid C2- eller C3-positionerna 5,6.
Detta papper visar den framgångsrika beredningen av α-metylbensylgruppinnehållande kirala aziridin-2-karboxylatderivat, specifikt (-)-mentolyl (1R)-fenyletylaziridin-2-karboxylater som dess diastereomera blandning, från reaktionen av 2,3-dibromopropionat och (1R)-fenyletylamin. Från denna diastereomera blandning erhölls enantiopure (1R)-fenyletyl-(2R)- och (2S)-aziridin-2-karboxylater som deras (-)-mentolylestrar i optiskt rena former genom selektiv omkristallisation från MeOH och n-pentan på flerahundra kilo skalor (figur 1)7. Dessa (-)-mentholylestrar kan lätt omvandlas till sina etyl- eller metylestrar genom transesterifiering i närvaro av magnesium- ellerkaliumkarbonat7. Dessa föreningar kan också enkelt framställas i laboratorieskala från reaktionerna av alkyl 2,3-dibromopropionater eller vinyltriflaten av α-ketoester med kiral 2-fenyletylamin följt av separation av den diastereomera blandningen med användning av enkel blixtkolonnkromatografi8.
När vi väl har enantiopure kirala aziridin-2-karboxylat kan vi syntetisera olika cykliska och acykliska kväveinnehållande biologiskt viktiga målmolekyler baserat på funktionella grupptransformationer av karboxylat och mycket regio- och stereoselektiva aziridinringöppningsreaktioner 6,9,10. Den första lämpliga asymmetriska syntesen applicerades för båda enantiomererna av 5, 6-dihydrouracil-typ marina naturprodukter biemamid B och D som potentiella TGF-β-hämmare11,12. För det andra uppnåddes den diastereoselektiva syntesen av β-(aziridin-2-yl)-β-hydroxiketoner genom Mukaiyama-aldolkreaktion av optiskt ren 1-(1-fenyletyl)-aziridin-2-karboxaldehyd och olika enolsilaner i närvaro av ZnCl2, i högt utbyte (>82%) med nästan perfekt stereoselektivitet (98:2 dr) via ett kelatkontrollerat övergångstillstånd. Dessa användes för asymmetrisk syntes av epiallo-isomuskarin alkaloider 13,14,15.
Protocol
Representative Results
Discussion
Aziridiner som kvävehaltiga treledade heterocykler har en enorm potential för syntetiska startkrig eller intermediärer för att framställa kväverika organiska molekyler. Baserat på grupplagret vid ringkväve klassificeras de som “aktiverade” och “icke-aktiverade” aziridiner vars kemiska reaktivitet och selektivitet är olika. Emellertid, mycket begränsade metoder finns tillgängliga för att förbereda denna värdefulla aziridin i en optiskt aktiv form.
Protokollet i detta dokument bes…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Denna forskning stöddes av National Research Foundation of Korea (NRF-2020R1A2C1007102 och 2021R1A5A6002803) med Center for New Directions in Organic Synthesis och ett HUFS Grant 2022.
Materials
| (2R)-1-[(1R)-1-Phenylethyl]-2-aziridinecarboxylic acid (-)-menthol ester, 98% | Sigma-Aldrich | 57054-0 | |
| (2S)-1-[(1R)-1-Phenylethyl]-2-aziridinecarboxylic acid (-)-menthol ester | Sigma-Aldrich | 57051-6 | |
| 1-(3-Dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride | TCI | 424331-25 g | CAS No: 25952-53-8 |
| 1,4-Dioxane | SAMCHUN | D0654-1 kg | CAS No: 123-91-1 |
| 1-Hydroxybenzotriazole hydrate | Aldrich | 219-989-7-50 g | CAS No: 123333-53-9 |
| 2,6-Lutidine | Alfa Aesar | A10478-AP, 500 mL | CAS No: 108-48-5 |
| Acetonitrile | SAMCHUN | A0127-18 L | CAS No: 75-05-8 |
| Acetonitrile-d3 | Cambridge Isotope Laboratories, | 15G-744-25 g | CAS No: 2206-26-0 |
| Aluminum chloride hexahydrate | Aldrich | 231-208-1, 500 g | CAS No : 7784-13-6 |
| Bruker AVANCE III HD (400 MHz) spectrometer | Bruker | NA | |
| Chloroform-d | Cambridge Isotope Laboratories, | 100 g | CAS No: 865-49-6 |
| Dichloromethane | SAMCHUN | M0822-18 L | CAS No: 75-09-2 |
| Dimethyl sulfoxide-d6 | Cambridge Isotope Laboratories, | 25 g | CAS No: 2206-27-1 |
| Ethanol | EMSURE | 1009831000,1L | CAS No: 64-17-5 |
| Ethyl acetate | SAMCHUN | E0191-18 L | CAS No: 141-78-6 |
| High resolution mass spectra/MALDI-TOF/TOF Mass Spectrometry | AB SCIEX | 4800 Plus | High resolution mass spectra |
| JASCO P-2000 | JASCO | P-2000 | For optical rotation |
| Lithium aluminum hydride | TCI | L0203-100 g | CAS No: 16853-85-3 |
| L-Selectride, 1 M solution in THF | Acros | 176451000, 100 mL | CAS No: 38721-52-7 |
| Methanol | SAMCHUN | M0585-18 L | CAS No: 67-56-1 |
| N-[(9H-Fluoren-9-ylmethoxy)carbonyl]-β-alanine | TCI | F08825G-5 g | CAS No: 35737-10-1 |
| N-Ethyldiisopropylamine | Aldrich | 230-392-0, 100 mL | CAS No: 7087-68-5 |
| n-Hexane | SAMCHUN | H0114-18 L | CAS No: 110-54-3 |
| Ninhydrin | Alfa Aesar | A10409-250 g | CAS No: 485-47-2 |
| p-Anisaldehyde | aldrich | A88107-5 g | CAS No: 123-11-5 |
| Phosphomolybdic acid hydrate | TCI | P1910-100 g | CAS No: 51429-74-4 |
| Sodium azide | D.S.P | 703301-500 g | CAS No: 26628-22-8 |
| Sodium Hydride 60% dispersion in mineral oil | Sigma-Aldrich | 452912-100 G | CAS No: 7646-69-7 |
| Sodium hydroxide | DUKSAN | A31226-1 kg | CAS No: 1310-73-2 |
| Sodium sulfate | SAMCHUN | S1011-1 kg | CAS No: 7757-82-6 |
| Thin Layer Chromatography (TLC) | Merck | 100390 | |
| Tert-Butyldimethylsilyl trifluoromethanesulfonate, 98% | Aldrich | 274-102-0, 25 g | CAS NO: 69739-34-0 |
| Tetrahydrofuran | SAMCHUN | T0148-18 L | CAS No: 109-99-9 |
| Triethylethylamine | DAEJUNG | 8556-4400-1 L | CAS No: 121-44-8 |
| UV light | Korea Ace Sci | TN-4C | 254 nm |
| Zinc chloride, anhydrous, 98+% | Alfa Aesar | A16281-22100 g | CAS No : 7646-85-7 |
References
- Pitzer, K. S. Strain energies of cyclic hydrocarbons. Science. 101 (2635), 672 (1945).
- Dudev, T., Lim, C. Ring strain energies from ab initio calculations. Journal of the American Chemical Society. 120 (18), 4450-4458 (1998).
- D’hooghe, M., Ha, H. -. J. . Synthesis of 4- to 7-Membered Heterocycles by Ring Expansion. , (2016).
- Ranjith, J., Ha, H. -. J. Synthetic applications of aziridinium ions. Molecules. 26 (6), 1744 (2021).
- Sweeney, J. B. Aziridines: epoxides’ ugly cousins. Chemical Society Reviews. 31 (5), 247-258 (2002).
- Stankovic, S., et al. Regioselectivity in the ring opening of non-activated aziridines. Chemical Society Reviews. 41 (2), 643-665 (2012).
- Lee, W. K., Ha, H. -. J. Highlights of the chemistry of enantiomerically pure aziridine-2-carboxylates. Aldrichimica Acta. 36 (2), 57-63 (2003).
- Tranchant, M. J., Dalla, V., Jabin, I., Decroix, B. Reaction of vinyl triflates of α-keto esters with primary amines: efficient synthesis of aziridine carboxylates. Tetrahedron. 58 (42), 8425-8432 (2002).
- Ha, H. -. J., Jung, J. -. H., Lee, W. K. Application of regio- and stereoselective functional group transformation of chiral aziridine-2-carboxylate. Asian Journal of Organic Chemistry. 3 (10), 1020-1035 (2014).
- Kim, Y., et al. Preparation of 2,3-diaminopropionate from ring opening of aziridine-2-carboxylate. Tetrahedron Letters. 46 (25), 4407-4409 (2005).
- Srivastava, N., Macha, L., Ha, H. -. J. Total synthesis and stereochemical revision of biemamides B and D. Organic Letters. 21 (22), 8992-8996 (2019).
- Zhang, F., et al. Biemamides A-E, inhibitors of the TGF-β pathway that block the epithelial to mesenchymal transition. Organic Letters. 20 (18), 5529-5532 (2018).
- Srivastava, N., Ha, H. -. J. Highly efficient and stereoselective Mukaiyama Aldol reaction with chiral aziridine-2-carboxaldehyde and its synthetic applications. Asian Journal of Organic Chemistry. 11 (1), 2021005671 (2021).
- Kempter, I., et al. Synthesis and structural characterization of the isomuscarines. Tetrahedron. 70 (10), 1918-1927 (2014).
- Pirrrung, M. C., DeAmicis, C. V. Total synthesis of the muscarines. Tetrahedron Letters. 29 (2), 159-162 (1988).

