Дальнекрасный флуоресцентный датчик старения, связанный с β-галактозидазой для идентификации и обогащения стареющих опухолевых клеток с помощью проточной цитометрии
Summary
Представлен протокол флуоресцентной, проточной цитометрической количественной оценки стареющих раковых клеток, индуцированных химиотерапевтическими препаратами в клеточной культуре или в моделях опухолей мышей. Необязательные процедуры включают совместное иммуноиммунтирование, фиксацию образца для облегчения анализа больших партий или временных точек и обогащение жизнеспособных стареющих клеток путем проточной цитометрической сортировки.
Abstract
Клеточное старение – это состояние пролиферативной остановки, вызванное биологическим повреждением, которое обычно накапливается в течение многих лет в стареющих клетках, но также может быстро возникать в опухолевых клетках в ответ на повреждение, вызванное различными методами лечения рака. Старение опухолевых клеток, как правило, считается нежелательным, так как стареющие клетки становятся устойчивыми к смерти и блокируют ремиссию опухоли, усугубляя злокачественность опухоли и резистентность к лечению. Поэтому идентификация стареющих опухолевых клеток представляет постоянный интерес для сообщества исследователей рака. Существуют различные анализы старения, многие из которых основаны на активности хорошо известного маркера старения, бета-галактозидазы, связанной со старением (SA-β-Gal).
Как правило, sa-β-Gal проводится с использованием хромогенного субстрата (X-Gal) на фиксированных клетках, с медленным и субъективным перечислением «синих» стареющих клеток с помощью световой микроскопии. Улучшенные анализы с использованием проникающих в клетки флуоресцентных субстратов SA-β-Gal, включая C12-FDG (зеленый) и DDAO-галактозид (DDAOG; дальний красный), позволили анализировать живые клетки и позволили использовать высокопроизводительные флуоресцентные аналитические платформы, включая проточные цитометры. C12-FDG является хорошо документированным зондом для SA-β-Gal, но его зеленое флуоресцентное излучение перекрывается с внутренней клеточной автофлуоресценцией (AF), которая возникает во время старения из-за накопления агрегатов липофусцина. Используя дальний красный зонд SA-β-Gal DDAOG, зеленая клеточная автофлуоресценция может быть использована в качестве вторичного параметра для подтверждения старения, добавляя надежность анализу. Остальные флуоресцентные каналы могут быть использованы для окрашивания жизнеспособности клеток или необязательной флуоресцентной иммуномаркировки.
Используя проточную цитометрию, мы демонстрируем использование автофлуоресценции DDAOG и липофусцина в качестве двухпараметрического анализа для идентификации стареющих опухолевых клеток. Проводится количественное определение процента жизнеспособных стареющих клеток. При желании может быть включен необязательный этап иммуномаркировки для оценки интересующих антигенов клеточной поверхности. Идентифицированные стареющие клетки также могут быть цитометрически отсортированы и собраны для последующего анализа. Собранные стареющие клетки могут быть немедленно лизированы (например, для иммуноанализа или анализа омики) или дополнительно культивированы.
Introduction
Стареющие клетки обычно накапливаются в организмах в течение многих лет во время нормального биологического старения, но также могут быстро развиваться в опухолевых клетках в ответ на повреждение, вызванное различными методами лечения рака, включая лучевую и химиотерапию. Хотя опухолевые клетки больше не размножаются, вызванные терапией стареющие (ТИС) опухолевые клетки могут способствовать резистентности к лечению и вызывать рецидив 1,2,3. Факторы, секретируемые клетками TIS, могут усугубить злокачественность опухоли, способствуя иммунному уклонению или метастазированию 4,5. Клетки TIS развивают сложные, контекстно-зависимые фенотипы, измененные метаболические профили и уникальные иммунные реакции 6,7,8. Поэтому идентификация и характеристика опухолевых клеток TIS, индуцированных различными подходами к лечению рака, является темой, представляющей постоянный интерес для сообщества исследователей рака.
Для обнаружения опухолевых клеток ТИС широко используются обычные анализы старения, в первую очередь основанные на обнаружении повышенной активности фермента маркера старения, лизосомальной бета-галактозидазы GLB19. Обнаружение при почти нейтральном (а не кислом) лизосомальном рН позволяет специфическо обнаруживать бета-галактозидазу, связанную со старением (SA-β-Gal)10. Стандартный анализ SA-β-Gal, который использовался в течение нескольких десятилетий, использует X-Gal (5-бром-4-хлор-3-индолил-β-D-галактопиранозид), синюю хромогенную субстрату бета-галактозидазы, для обнаружения SA-β-Gal в фиксированных клетках с помощью световой микроскопии11. Анализ X-Gal позволяет качественно визуально подтвердить ТИС с использованием общедоступных реагентов и лабораторного оборудования. Базовый микроскоп пропускаемого света является единственным прибором, необходимым для оценки присутствия синего хромогена. Тем не менее, процедура окрашивания X-Gal может не иметь чувствительности, иногда требуется более 24 часов для развития цвета. Окрашивание сопровождается низкопроизводительным, субъективным подсчетом отдельных стареющих клеток на основе подсчета клеток, демонстрирующих некоторый уровень интенсивности синего хромогена под световым микроскопом. Поскольку X-Gal непроницаем, для этого анализа требуются ячейки, фиксированные растворителем, которые не могут быть восстановлены для последующего анализа. При работе с ограниченными образцами от животных или пациентов это может быть серьезным недостатком.
Улучшенные анализы SA-β-Gal с использованием клеточно-проникающих, флуоресцентных ферментных субстратов, включая C12-FDG (5-додеканоиламинофлуоресцеин Ди-β-D-галактопиранозид, зеленый) и DDAOG (9H-(1,3-дихлор-9,9-диметилакридин-2-один-7-ил) β-D-галактопиранозид, дальний красный) ранее появлялись в литературе 12,13,14,15. Структура химического зонда и оптические характеристики DDAOG показаны на дополнительном рисунке S1. Эти зонды, пронизывающие клетки, позволяют анализировать живые (а не фиксированные) клетки, а флуоресцентные, а не хромогенные зонды облегчают использование быстрых высокопроизводительных флуоресцентных аналитических платформ, включая инструменты скрининга с высоким содержанием и проточные цитометры. Сортировочные проточные цитометры позволяют восстанавливать обогащенные популяции живых стареющих клеток из клеточных культур или опухолей для последующего анализа (например, вестерн-блоттинг, ИФА или «омикс»). Флуоресцентный анализ также обеспечивает количественный сигнал, позволяющий более точно определить процент стареющих клеток в данном образце. Дополнительные флуоресцентные зонды, включая зонды жизнеспособности и флуорофорные антитела, могут быть легко добавлены для мультиплексированного анализа мишеней за пределами SA-β-Gal.
Подобно DDAOG, C12-FDG является флуоресцентным зондом для SA-β-Gal, но его зеленое флуоресцентное излучение перекрывается с внутренней клеточной ФП, которая возникает во время старения из-за накопления агрегатов липофусцина в клетках16. Используя дальний красный зонд DDAOG, зеленая клеточная AF может быть использована в качестве вторичного параметра для подтверждения старения17. Это повышает надежность анализа за счет использования второго маркера в дополнение к SA-β-Gal, который часто может быть ненадежным в качестве одного маркера старения18. Поскольку обнаружение эндогенной ФП в стареющих клетках является подходом без меток, это быстрый и простой способ расширить специфичность нашего анализа на основе DDAOG.
В этом протоколе мы демонстрируем использование DDAOG и AF в качестве быстрого двухпараметрического анализа проточной цитометрии для идентификации жизнеспособных опухолевых клеток TIS из культур in vitro или выделенных из обработанных лекарственными средствами опухолей, установленных у мышей (рисунок 1). Протокол использует флуорофоры, совместимые с широким спектром стандартных коммерческих анализаторов и сортировщиков проточной цитометрии (таблица 1). Возможность количественного определения процента жизнеспособных стареющих клеток с помощью стандартного анализа проточной цитометрии. При желании может быть выполнен необязательный этап иммуномаркировки для оценки интересующих антигенов клеточной поверхности одновременно со старением. Идентифицированные стареющие клетки также могут быть обогащены с использованием стандартной методологии флуоресцентно-активированной сортировки клеток (FACS).
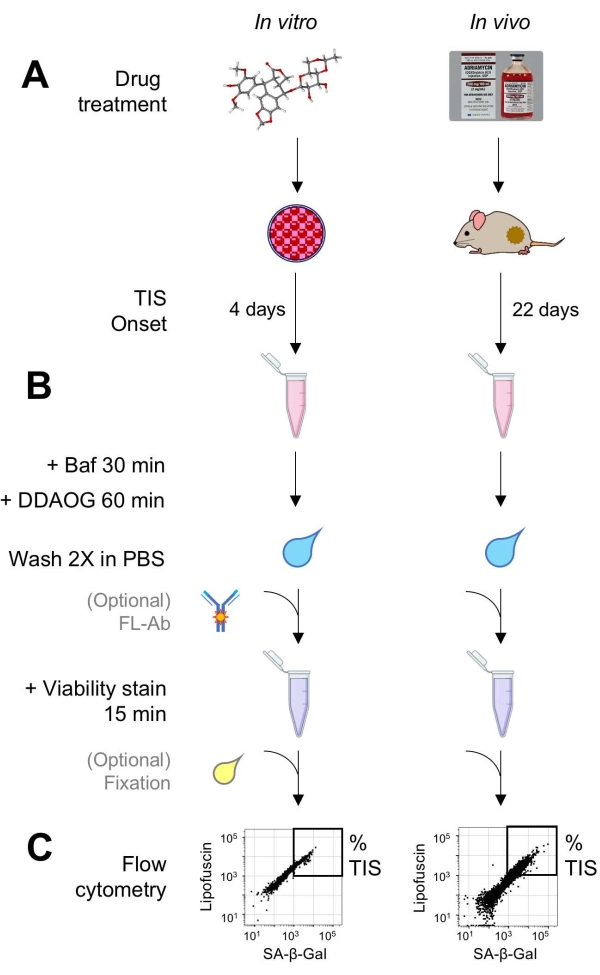
Рисунок 1: Экспериментальный рабочий процесс. Схема, обобщающая ключевые моменты анализа DDAOG. (A) Препарат, индуцирующий ТИС, добавляют к культивируемым клеткам млекопитающих или вводят мышам, несущим опухоль. Затем допускается время для начала ТИС: для клеток – 4 дня после лечения; для мышей , всего 22 дня, с тремя процедурами каждые 5 дней плюс 7 дней восстановления. Клетки собираются или опухоли диссоциируют на суспензию. (B) Образцы обрабатываются Baf для регулировки лизосомального рН для обнаружения SA-β-Gal в течение 30 минут; затем зонд DDAOG добавляется в течение 60 минут для обнаружения SA-β-Gal. Образцы промывают 2 раза в PBS, и ненадолго добавляется пятно жизнеспособности (15 мин). Необязательно образцы могут быть окрашены флуоресцентными антителами в открытых флуоресцентных каналах и/или зафиксированы для последующего анализа. (C) Образцы анализируются с использованием стандартного проточного цитометра. Жизнеспособные клетки визуализируются на точечных графиках, показывающих красный DDAOG (указывающий на SA-β-Gal) по сравнению с зеленой автофлуоресценцией (липофусцин). Затвор для определения процента клеток TIS устанавливается на основе необработанных контрольных образцов (не показан). Если используется сортировочный цитометр (FACS), клетки TIS могут быть собраны и помещены обратно в культуру для дальнейших анализов in vitro или лизированы и обработаны для анализов молекулярной биологии. Сокращения: DDAO = 9H-(1,3-дихлор-9,9-диметилакридин-2-он); DDAOG = DDAO-галактозид; TIS = старение, вызванное терапией; FL-Ab = флуорофор-конъюгированное антитело; Baf = Бафиломицин A1; SA-β-Gal = бета-галактозидаза, связанная со старением; PBS = фосфатно-буферный физиологический раствор; FACS = флуоресцентно-активированная сортировка клеток. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Флуорофор | Обнаруживает | Ex/Em (нм) | Цитометр лазерный (нм) | Детектор цитометра / полосовой фильтр (нм) |
| ДДАОГ | СА-β-Гал | 645/6601 руб. | 640 | 670 / 30 |
| Автофокусиров | Липофусцин | < 600 | 488 | 525 / 50 |
| CV450 | Жизнеспособность | 408/450 | 405 | 450 / 50 |
| ЧП | Маркер антител/поверхности | 565/578 | 561 | 582 / 15 |
Таблица 1: Оптические характеристики флуорофоров и цитометров. Спецификации цитометра, используемые в этом протоколе, перечислены для прибора с 4 лазерами и 15 детекторами излучения. DDAOG, обнаруженный при 645/660 нм, является формой зонда, расщепленного SA-β-Gal1. Неочищенный DDAOG может проявлять флуоресценцию низкого уровня при 460/610 нм, но удаляется шагами промывки в протоколе. Сокращения: DDAO = 9H-(1,3-дихлор-9,9-диметилакридин-2-он); DDAOG = DDAO-галактозид; AF = автофлуоресценция; ПЭ = фикоэритрин; SA-β-Gal = бета-галактозидаза, связанная со старением.
Protocol
Representative Results
Discussion
За последнее десятилетие или около того, проточная цитометрия стала более распространенной платформой для анализа в исследованиях рака из-за растущей популярности иммунологии опухолей, разработки более дешевых проточных цитометров и улучшения общих инструментальных средств в акаде…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Мы благодарим Центр цитометрии и антител в Чикагском университете за поддержку в области приборов для проточной цитометрии. Центр исследований животных при Чикагском университете предоставил жилье для животных.
Materials
| Bafilomycin A1 | Research Products International | B40500 | |
| Bleomycin sulfate | Cayman | 13877 | |
| Bovine serum albumin (BSA) | US Biological | A1380 | |
| Calcein Violet 450 AM viability dye | ThermoFisher Scientific | 65-0854-39 | eBioscience |
| DPP4 antibody, PE conjugate | Biolegend | 137803 | Clone H194-112 |
| Cell line: A549 human lung adenocarcinoma | American Type Culture Collection | CCL-185 | |
| Cell line: B16-F10 mouse melanoma | American Type Culture Collection | CRL-6475 | |
| Cell scraper | Corning | 3008 | |
| Cell strainers, 100 µm | Falcon | 352360 | |
| DDAO-Galactoside | Life Technologies | D6488 | |
| DMEM medium 1x | Life Technologies | 11960-069 | |
| DMSO | Sigma | D2438 | |
| DNAse I | Sigma | DN25 | |
| Doxorubicin, hydrochloride injection (USP) | Pfizer | NDC 0069-3032-20 | |
| Doxorubicin, PEGylated liposomal (USP) | Sun Pharmaceutical | NDC 47335-049-40 | |
| EDTA 0.5 M | Life Technologies | 15575-038 | |
| Etoposide | Cayman | 12092 | |
| FBS | Omega | FB-11 | |
| Fc receptor blocking reagent | Biolegend | 101320 | Anti-mouse CD16/32 |
| Flow cytometer (cell analyzer) | Becton Dickinson (BD) | Various | LSRFortessa |
| Flow cytometer (cell sorter) | Becton Dickinson (BD) | Various | FACSAria |
| GlutaMax 100x | Life Technologies | 35050061 | |
| HEPES 1 M | Lonza | BW17737 | |
| Liberase TL | Sigma | 5401020001 | Roche |
| Paraformaldehyde 16% | Electron Microscopy Sciences | 15710 | |
| Penicillin/Streptomycin 100x | Life Technologies | 15140122 | |
| Phosphate buffered saline (PBS) 1x | Corning | MT21031CV | Dulbecco's PBS (without calcium and magnesium) |
| Rainbow calibration particles, ultra kit | SpheroTech | UCRP-38-2K | 3.5-3.9 µm, 2E6/mL |
| RPMI-1640 medium 1x | Life Technologies | 11875-119 | |
| Sodium chloride 0.9% (USP) | Baxter Healthcare Corporation | 2B1324 | |
| Software for cytometer data acquisition, "FACSDiva" | Becton Dickinson (BD) | n/a | Contact BD for license |
| Software for cytometer data analysis, "FlowJo" | TreeStar | n/a | Contact TreeStar for license |
| Trypsin-EDTA 0.25% | Life Technologies | 25200-114 |
References
- Saleh, T., Tyutyunyk-Massey, L., Gewirtz, D. A. Tumor cell escape from therapy-induced senescence as a model of disease recurrence after dormancy. Cancer Research. 79 (6), 1044-1046 (2019).
- Wang, B., Kohli, J., Demaria, M. Senescent cells in cancer therapy: friends or foes. Trends in Cancer. 6 (10), 838-857 (2020).
- Prasanna, P. G., et al. Therapy-induced senescence: Opportunities to improve anticancer therapy. Journal of the National Cancer Institute. 113 (10), 1285-1298 (2021).
- Velarde, M. C., Demaria, M., Campisi, J. Senescent cells and their secretory phenotype as targets for cancer therapy. Interdisciplinary Topics in Gerontology and Geriatrics. 38, 17-27 (2013).
- Ou, H. L., et al. Cellular senescence in cancer: from mechanisms to detection. Molecular Oncology. 15 (10), 2634-2671 (2021).
- Hernandez-Segura, A., Nehme, J., Demaria, M. Hallmarks of cellular senescence. Trends in Cell Biology. 28 (6), 436-453 (2018).
- Bojko, A., Czarnecka-Herok, J., Charzynska, A., Dabrowski, M., Sikora, E. Diversity of the senescence phenotype of cancer cells treated with chemotherapeutic agents. Cells. 8 (12), 1501 (2019).
- Mikuła-Pietrasik, J., Niklas, A., Uruski, P., Tykarski, A., Książek, K. Mechanisms and significance of therapy-induced and spontaneous senescence of cancer cells. Cellular and Molecular Life Sciences. 77 (2), 213-229 (2020).
- Lee, B. Y., et al. Senescence-associated beta-galactosidase is lysosomal beta-galactosidase. Aging cell. 5 (2), 187-195 (2006).
- Itahana, K., Itahana, Y., Dimri, G. P. Colorimetric detection of senescence-associated β galactosidase. Methods in Molecular Biology. 965, 143-156 (2013).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proceedings of the National Academy of Sciences of the United States of America. 92 (20), 9363-9367 (1995).
- Debacq-Chainiaux, F., Erusalimsky, J. D., Campisi, J., Toussaint, O. Protocols to detect senescence-associated beta-galactosidase (SA-betagal) activity, a biomarker of senescent cells in culture and in vivo. Nature Protocols. 4 (12), 1798-1806 (2009).
- Noppe, G., et al. Rapid flow cytometric method for measuring senescence associated beta-galactosidase activity in human fibroblasts. Cytometry A. 75 (11), 910-916 (2009).
- Tung, C. -. H., et al. In vivo imaging of β-galactosidase activity using far red fluorescent switch. Cancer Research. 64 (5), 1579-1583 (2004).
- Gong, H., et al. beta-Galactosidase activity assay using far-red-shifted fluorescent substrate DDAOG. Analytical Biochemistry. 386 (1), 59-64 (2009).
- Terman, A., Brunk, U. T. Lipofuscin: Mechanisms of formation and increase with age. APMIS. 106 (2), 265-276 (1998).
- Georgakopoulou, E. A., et al. Specific lipofuscin staining as a novel biomarker to detect replicative and stress-induced senescence. A method applicable in cryo-preserved and archival tissues. Aging. 5 (1), 37-50 (2013).
- Wang, B., Demaria, M. The quest to define and target cellular senescence in cancer. Cancer Research. 81 (24), 6087-6089 (2021).
- Appelbe, O. K., Zhang, Q., Pelizzari, C. A., Weichselbaum, R. R., Kron, S. J. Image-guided radiotherapy targets macromolecules through altering the tumor microenvironment. Molecular Pharmaceutics. 13 (10), 3457-3467 (2016).
- Maciorowski, Z., Chattopadhyay, P. K., Jain, P. Basic multicolor flow cytometry. Current Protocols in Immunology. 117, 1-38 (2017).
- Fan, Y., Cheng, J., Zeng, H., Shao, L. Senescent cell depletion through targeting BCL-family proteins and mitochondria. Frontiers in Physiology. 11, 593630 (2020).
- Kim, K. M., et al. Identification of senescent cell surface targetable protein DPP4. Genes and Development. 31 (15), 1529-1534 (2017).
- Flor, A. C., Kron, S. J. Lipid-derived reactive aldehydes link oxidative stress to cell senescence. Cell Death Discovery. 7 (9), 2366 (2016).
- Jochems, F., et al. The Cancer SENESCopedia: A delineation of cancer cell senescence. Cell reports. 36 (4), 109441 (2021).
- Fallah, M., et al. Doxorubicin and liposomal doxorubicin induce senescence by enhancing nuclear factor kappa B and mitochondrial membrane potential. Life Sciences. 232, 116677 (2019).
- Kasper, M., Barth, K. Bleomycin and its role in inducing apoptosis and senescence in lung cells – modulating effects of caveolin-1. Current Cancer Drug Targets. 9 (3), 341-353 (2009).
- Muthuramalingam, K., Cho, M., Kim, Y. Cellular senescence and EMT crosstalk in bleomycin-induced pathogenesis of pulmonary fibrosis-an in vitro analysis. Cell Biology International. 44 (2), 477-487 (2020).
- Flor, A. C., Wolfgeher, D., Wu, D., Kron, S. J. A signature of enhanced lipid metabolism, lipid peroxidation and aldehyde stress in therapy-induced senescence. Cell Death Discovery. 3, 17075 (2017).
- Burd, C. E., et al. Monitoring tumorigenesis and senescence in vivo with a p16(INK4a)-luciferase model. Cell. 152 (1-2), 340-351 (2013).
- Liu, J. Y., et al. Cells exhibiting strong p16 (INK4a) promoter activation in vivo display features of senescence. Proceedings of the National Academy of Sciences of the United States of America. 116 (7), 2603-2611 (2019).
- Wang, L., Lankhorst, L., Bernards, R. Exploiting senescence for the treatment of cancer. Nature Reviews Cancer. 22 (6), 340-355 (2022).
- Baek, K. -. H., Ryeom, S. Detection of oncogene-induced senescence in vivo. Methods in Molecular Biology. 1534, 185-198 (2017).
- González-Gualda, E., Baker, A. G., Fruk, L., Muñoz-Espín, D. A guide to assessing cellular senescence in vitro and in vivo. The FEBS Journal. 288 (1), 56-80 (2021).

