مسبار β-galactosidase المرتبط بالشيخوخة الفلورية الحمراء البعيدة لتحديد وإثراء الخلايا السرطانية الهرمة عن طريق قياس التدفق الخلوي
Summary
يتم تقديم بروتوكول للقياس الكمي الفلوري والتدفق الخلوي للخلايا السرطانية الهرمة التي تسببها أدوية العلاج الكيميائي في زراعة الخلايا أو في نماذج أورام الفئران. تشمل الإجراءات الاختيارية التلطيخ المناعي المشترك ، وتثبيت العينات لتسهيل تحليل الدفعة الكبيرة أو النقطة الزمنية ، وإثراء الخلايا الهرمة القابلة للحياة عن طريق الفرز الخلوي للتدفق.
Abstract
الشيخوخة الخلوية هي حالة من التوقف التكاثري الناجم عن الضرر البيولوجي الذي يتراكم عادة على مدى سنوات في الخلايا المتقدمة في السن ولكنه قد يظهر أيضا بسرعة في الخلايا السرطانية كرد فعل على الضرر الناجم عن علاجات السرطان المختلفة. تعتبر شيخوخة الخلايا السرطانية بشكل عام غير مرغوب فيها ، حيث تصبح الخلايا الهرمة مقاومة للموت وتمنع مغفرة الورم مع تفاقم الورم الخبيث ومقاومة العلاج. لذلك ، فإن تحديد الخلايا السرطانية الهرمة له أهمية مستمرة لمجتمع أبحاث السرطان. توجد فحوصات شيخوخة مختلفة ، يعتمد الكثير منها على نشاط علامة الشيخوخة المعروفة ، بيتا غالاكتوزيداز المرتبطة بالشيخوخة (SA-β-Gal).
عادة ، يتم إجراء اختبار SA-β-Gal باستخدام ركيزة كروموجينية (X-Gal) على الخلايا الثابتة ، مع التعداد البطيء والذاتي للخلايا الهرمة “الزرقاء” بواسطة الفحص المجهري الضوئي. وقد مكنت المقايسات المحسنة باستخدام ركائز SA-β-Gal الفلورية نفاذة للخلايا، بما في ذلك C12-FDG (الأخضر) و DDAO-Galactoside (DDAOG؛ الأحمر الأقصى)، من تحليل الخلايا الحية وسمحت باستخدام منصات تحليل الفلورسنت عالية الإنتاجية، بما في ذلك مقاييس التدفق الخلوي. C12-FDG هو مسبار موثق جيدا ل SA-β-Gal ، لكن انبعاثاته الفلورية الخضراء تتداخل مع التألق الذاتي الخلوي الجوهري (AF) الذي ينشأ أثناء الشيخوخة بسبب تراكم مجاميع الليبوفوسين. من خلال استخدام مسبار SA-β-Gal الأحمر البعيد DDAOG ، يمكن استخدام التألق الذاتي الخلوي الأخضر كمعلمة ثانوية لتأكيد الشيخوخة ، مما يضيف موثوقية إلى الفحص. يمكن استخدام قنوات التألق المتبقية لتلطيخ صلاحية الخلية أو وضع العلامات المناعية الفلورية الاختيارية.
باستخدام قياس التدفق الخلوي ، نوضح استخدام التألق الذاتي DDAOG و lipofuscin كاختبار ثنائي المعلمات لتحديد الخلايا السرطانية الهرمة. يتم إجراء تحديد النسبة المئوية للخلايا الهرمة القابلة للحياة. إذا رغبت في ذلك ، يمكن تضمين خطوة مناعية اختيارية لتقييم مستضدات سطح الخلية ذات الأهمية. يمكن أيضا فرز الخلايا الهرمة المحددة وفرزها خلويا وجمعها لتحليلها في اتجاه مجرى النهر. يمكن تحليل الخلايا الهرمة المجمعة على الفور (على سبيل المثال ، للمقايسات المناعية أو “تحليل أوميكس”) أو مزيد من الاستزراع.
Introduction
تتراكم الخلايا الهرمة عادة في الكائنات الحية على مدى سنوات أثناء الشيخوخة البيولوجية الطبيعية ولكنها قد تتطور أيضا بسرعة في الخلايا السرطانية كرد فعل للضرر الناجم عن علاجات السرطان المختلفة ، بما في ذلك الإشعاع والعلاج الكيميائي. على الرغم من أنها لم تعد تتكاثر ، إلا أن الخلايا السرطانية الهرمة التي يسببها العلاج (TIS) قد تساهم في مقاومة العلاج وتدفع التكرار1،2،3. يمكن أن تؤدي العوامل التي تفرزها خلايا TIS إلى تفاقم الورم الخبيث عن طريق تعزيز التهرب المناعي أو ورم خبيث 4,5. تطور خلايا TIS أنماطا ظاهرية معقدة ومحددة السياق ، وملفات أيضية متغيرة ، واستجابات مناعية فريدة6،7،8. لذلك ، فإن تحديد وتوصيف الخلايا السرطانية TIS التي تسببها مناهج علاج السرطان المختلفة هو موضوع يحظى باهتمام مستمر لمجتمع أبحاث السرطان.
للكشف عن الخلايا السرطانية TIS ، تستخدم فحوصات الشيخوخة التقليدية على نطاق واسع ، وتعتمد بشكل أساسي على اكتشاف النشاط المتزايد لإنزيم علامة الشيخوخة ، بيتا غالاكتوزيداز GLB19 الليزوزومي. يسمح الكشف عند درجة حموضة ليزوزومية شبه محايدة (وليس حمضية) بالكشف المحدد عن بيتا غالاكتوزيداز المرتبط بالشيخوخة (SA-β-Gal)10. يستخدم اختبار SA-β-Gal القياسي الذي تم استخدامه لعدة عقود X-Gal (5-bromo-4-chloro-3-indolyl-β-D-galactopyranoside) ، وهو ركيزة بيتا غالاكتوزيداز زرقاء كروموجينية ، للكشف عن SA-β-Gal في الخلايا الثابتة عن طريق الفحص المجهريالضوئي 11. يسمح اختبار X-Gal بالتأكيد البصري النوعي لنظام TIS باستخدام الكواشف ومعدات المختبرات المتاحة بشكل شائع. المجهر الضوئي الأساسي المنقول هو الأجهزة الوحيدة المطلوبة لتقييم وجود الكروموجين الأزرق. ومع ذلك ، يمكن أن يفتقر إجراء تلطيخ X-Gal إلى الحساسية ، ويتطلب أحيانا أكثر من 24 ساعة حتى يتطور اللون. يتبع التلوين تسجيل ذاتي منخفض الإنتاجية للخلايا الهرمة الفردية بناء على حساب الخلايا التي تظهر مستوى معينا من شدة الكروموجين الأزرق تحت المجهر الضوئي. نظرا لأن X-Gal غير منفذ للخلية ، فإن هذا الفحص يتطلب خلايا ثابتة بالمذيبات ، والتي لا يمكن استردادها لتحليل المصب. عند العمل مع عينات محدودة من الحيوانات أو المرضى ، يمكن أن يكون هذا عيبا كبيرا.
مقايسات SA-β-Gal المحسنة باستخدام ركائز إنزيم فلورية منفذة للخلايا ، بما في ذلك C 12-FDG (5-dodecanoylaminofluorescein Di-β-D-Galactopyranoside ، أخضر) و DDAOG (9H– (1،3-ثنائي كلورو-9،9-ثنائي ميثيل أكريدين-2-واحد-7-يل) β-D-Galactopyranoside ، أحمر بعيد) ظهرت سابقا في الأدبيات12،13،14،15. يتم عرض هيكل المسبار الكيميائي والخصائص البصرية ل DDAOG في الشكل التكميلي S1. تسمح هذه المجسات الخلوية بتحليل الخلايا الحية (بدلا من الخلايا الثابتة) ، وتسهل المجسات الفلورية بدلا من المجسات الكروموجينية استخدام منصات تحليل الفلورسنت السريعة عالية الإنتاجية ، بما في ذلك أدوات الفحص عالية المحتوى ومقاييس التدفق الخلوي. تمكن مقاييس التدفق الخلوي للفرز من استعادة المجموعات المخصبة من الخلايا الهرمة الحية من مزارع الخلايا أو الأورام لتحليلها في اتجاه مجرى النهر (على سبيل المثال ، النشاف الغربي ، ELISA ، أو “omics”). يوفر تحليل التألق أيضا إشارة كمية ، مما يسمح بتحديد أكثر دقة للنسبة المئوية للخلايا الهرمة داخل عينة معينة. يمكن بسهولة إضافة مجسات فلورية إضافية ، بما في ذلك مجسات الجدوى والأجسام المضادة الموسومة بالفلوروفور ، للتحليل المتعدد للأهداف خارج SA-β-Gal.
على غرار DDAOG ، C12-FDG هو مسبار فلوري ل SA-β-Gal ، لكن انبعاثه الفلوري الأخضر يتداخل مع AF الخلوي الجوهري ، والذي ينشأ أثناء الشيخوخة بسبب تراكم مجاميع الليبوفوسين في الخلايا16. من خلال استخدام مسبار DDAOG الأحمر البعيد ، يمكن استخدام التركيز البؤري التلقائي الخلوي الأخضر كمعلمة ثانوية لتأكيد الشيخوخة17. يعمل هذا على تحسين موثوقية الفحص باستخدام علامة ثانية بالإضافة إلى SA-β-Gal ، والتي غالبا ما تكون غير موثوقة كعلامة واحدة للشيخوخة18. نظرا لأن اكتشاف الرجفان الأذيني الداخلي في الخلايا الهرمة هو نهج خال من الملصقات ، فهو طريقة سريعة وبسيطة لتوسيع خصوصية الفحص المستند إلى DDAOG.
في هذا البروتوكول ، نوضح استخدام DDAOG و AF كاختبار سريع لقياس التدفق الخلوي ثنائي المعلمات لتحديد الخلايا السرطانية TIS القابلة للحياة من الثقافات المختبرية أو المعزولة عن الأورام المعالجة بالعقاقير الموجودة في الفئران (الشكل 1). يستخدم البروتوكول الفلوروفورات المتوافقة مع مجموعة واسعة من أجهزة تحليل وفرز التدفق الخلوي التجارية القياسية (الجدول 1). يتم تمكين تحديد النسبة المئوية للخلايا الهرمة القابلة للحياة باستخدام تحليل قياس التدفق الخلوي القياسي. إذا رغبت في ذلك ، يمكن إجراء خطوة مناعية اختيارية لتقييم مستضدات سطح الخلية ذات الأهمية بالتزامن مع الشيخوخة. يمكن أيضا إثراء الخلايا الهرمة المحددة باستخدام منهجية فرز الخلايا المنشطة بالفلورة (FACS).
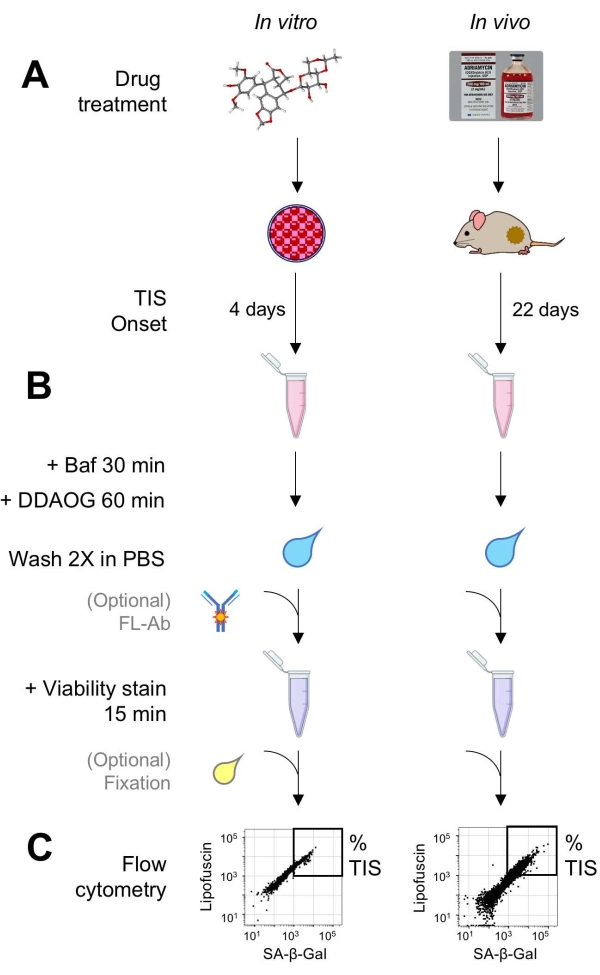
الشكل 1: سير العمل التجريبي. رسم تخطيطي يلخص النقاط الرئيسية لفحص DDAOG. (أ) يضاف دواء يحفز TIS إلى خلايا الثدييات المستزرعة أو يعطى للفئران الحاملة للورم. ثم يسمح الوقت لبداية TIS: للخلايا ، 4 أيام بعد العلاج. للفئران ، إجمالي 22 يوما ، مع ثلاثة علاجات كل 5 أيام بالإضافة إلى 7 أيام للتعافي. يتم حصاد الخلايا أو فصل الأورام إلى تعليق. (ب) تعامل العينات ب Baf لضبط الأس الهيدروجيني للجسيمات الليزوزومية للكشف عن SA-β-Gal لمدة 30 دقيقة ؛ بعد ذلك ، يتم إضافة مسبار DDAOG لمدة 60 دقيقة للكشف عن SA-β-Gal. يتم غسل العينات 2x في PBS ، ويتم إضافة بقعة صلاحية لفترة وجيزة (15 دقيقة). اختياريا ، يمكن تلطيخ العينات بالأجسام المضادة الفلورية في قنوات مضان مفتوحة و / أو ثابتة لتحليلها لاحقا. (ج) تحلل العينات باستخدام مقياس التدفق الخلوي القياسي. يتم تصور الخلايا القابلة للحياة في مخططات نقطية تظهر DDAOG الأحمر (يشير إلى SA-β-Gal) مقابل التألق الذاتي الأخضر (lipofuscin). يتم إنشاء بوابة لتحديد النسبة المئوية لخلايا TIS بناء على عينات التحكم غير المعالجة (غير معروضة). إذا تم استخدام مقياس الفرز الخلوي (FACS) ، فيمكن جمع خلايا TIS ووضعها مرة أخرى في المزرعة لمزيد من المقايسات في المختبر أو تحليلها ومعالجتها لمقايسات البيولوجيا الجزيئية. الاختصارات: DDAO = 9H- (1،3-ثنائي كلورو-9،9-ثنائي ميثيل أكريدين-2-واحد) ؛ DDAOG = DDAO-غالاكتوسيد ؛ TIS = الشيخوخة الناجمة عن العلاج ؛ FL-Ab = الأجسام المضادة المترافقة بالفلوروفور ؛ باف = بافيلوميسين A1 ؛ SA-β-Gal = بيتا غالاكتوزيداز المرتبط بالشيخوخة ؛ PBS = محلول ملحي مخزن بالفوسفات ؛ FACS = فرز الخلايا المنشط بالتألق. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
| فلوروفور | الكشف عن | السابق/م (نانومتر) | ليزر مقياس الخلايا (نانومتر) | كاشف مقياس الخلايا / مرشح تمرير النطاق (نانومتر) |
| داوج | SA-β-Gal | 645/6601 | 640 | 670 / 30 |
| أ ف | ليبوفوسين | < 600 | 488 | 525 / 50 |
| CV450 | صلاحيه | 408/450 | 405 | 450 / 50 |
| بيه | الجسم المضاد / علامة السطح | 565/578 | 561 | 582 / 15 |
الجدول 1: المواصفات البصرية للفلوروفورات ومقياس الخلايا. يتم سرد مواصفات مقياس الخلايا المستخدمة في هذا البروتوكول لجهاز يحتوي على ما مجموعه 4 ليزر و 15 كاشفا للانبعاثات. DDAOG المكتشف عند 645/660 نانومتر هو شكل المسبار المشقوق بواسطة SA-β-Gal1. يمكن أن يظهر DDAOG غير المشقوق مضانا منخفض المستوى عند 460/610 نانومتر ولكن يتم إزالته عن طريق خطوات الغسيل في البروتوكول. الاختصارات: DDAO = 9H- (1،3-ثنائي كلورو-9،9-ثنائي ميثيل أكريدين-2-واحد) ؛ DDAOG = DDAO-غالاكتوسيد ؛ AF = التألق الذاتي ؛ PE = فيكوريثرين ؛ SA-β-Gal = بيتا غالاكتوزيداز المرتبط بالشيخوخة.
Protocol
Representative Results
Discussion
على مدى العقد الماضي أو نحو ذلك ، أصبح قياس التدفق الخلوي منصة فحص أكثر شيوعا في أبحاث السرطان بسبب الشعبية الناشئة لعلم المناعة السرطاني ، وتطوير مقاييس التدفق الخلوي منخفضة التكلفة ، وتحسين مرافق الأجهزة المشتركة في المؤسسات الأكاديمية. أصبحت المقايسات متعددة الألوان قياسية الآن ، حيث…
Disclosures
The authors have nothing to disclose.
Acknowledgements
نشكر المرفق الأساسي لقياس الخلايا والأجسام المضادة في جامعة شيكاغو على الدعم في أجهزة قياس التدفق الخلوي. قدم مركز أبحاث الحيوان في جامعة شيكاغو مساكن للحيوانات.
Materials
| Bafilomycin A1 | Research Products International | B40500 | |
| Bleomycin sulfate | Cayman | 13877 | |
| Bovine serum albumin (BSA) | US Biological | A1380 | |
| Calcein Violet 450 AM viability dye | ThermoFisher Scientific | 65-0854-39 | eBioscience |
| DPP4 antibody, PE conjugate | Biolegend | 137803 | Clone H194-112 |
| Cell line: A549 human lung adenocarcinoma | American Type Culture Collection | CCL-185 | |
| Cell line: B16-F10 mouse melanoma | American Type Culture Collection | CRL-6475 | |
| Cell scraper | Corning | 3008 | |
| Cell strainers, 100 µm | Falcon | 352360 | |
| DDAO-Galactoside | Life Technologies | D6488 | |
| DMEM medium 1x | Life Technologies | 11960-069 | |
| DMSO | Sigma | D2438 | |
| DNAse I | Sigma | DN25 | |
| Doxorubicin, hydrochloride injection (USP) | Pfizer | NDC 0069-3032-20 | |
| Doxorubicin, PEGylated liposomal (USP) | Sun Pharmaceutical | NDC 47335-049-40 | |
| EDTA 0.5 M | Life Technologies | 15575-038 | |
| Etoposide | Cayman | 12092 | |
| FBS | Omega | FB-11 | |
| Fc receptor blocking reagent | Biolegend | 101320 | Anti-mouse CD16/32 |
| Flow cytometer (cell analyzer) | Becton Dickinson (BD) | Various | LSRFortessa |
| Flow cytometer (cell sorter) | Becton Dickinson (BD) | Various | FACSAria |
| GlutaMax 100x | Life Technologies | 35050061 | |
| HEPES 1 M | Lonza | BW17737 | |
| Liberase TL | Sigma | 5401020001 | Roche |
| Paraformaldehyde 16% | Electron Microscopy Sciences | 15710 | |
| Penicillin/Streptomycin 100x | Life Technologies | 15140122 | |
| Phosphate buffered saline (PBS) 1x | Corning | MT21031CV | Dulbecco's PBS (without calcium and magnesium) |
| Rainbow calibration particles, ultra kit | SpheroTech | UCRP-38-2K | 3.5-3.9 µm, 2E6/mL |
| RPMI-1640 medium 1x | Life Technologies | 11875-119 | |
| Sodium chloride 0.9% (USP) | Baxter Healthcare Corporation | 2B1324 | |
| Software for cytometer data acquisition, "FACSDiva" | Becton Dickinson (BD) | n/a | Contact BD for license |
| Software for cytometer data analysis, "FlowJo" | TreeStar | n/a | Contact TreeStar for license |
| Trypsin-EDTA 0.25% | Life Technologies | 25200-114 |
References
- Saleh, T., Tyutyunyk-Massey, L., Gewirtz, D. A. Tumor cell escape from therapy-induced senescence as a model of disease recurrence after dormancy. Cancer Research. 79 (6), 1044-1046 (2019).
- Wang, B., Kohli, J., Demaria, M. Senescent cells in cancer therapy: friends or foes. Trends in Cancer. 6 (10), 838-857 (2020).
- Prasanna, P. G., et al. Therapy-induced senescence: Opportunities to improve anticancer therapy. Journal of the National Cancer Institute. 113 (10), 1285-1298 (2021).
- Velarde, M. C., Demaria, M., Campisi, J. Senescent cells and their secretory phenotype as targets for cancer therapy. Interdisciplinary Topics in Gerontology and Geriatrics. 38, 17-27 (2013).
- Ou, H. L., et al. Cellular senescence in cancer: from mechanisms to detection. Molecular Oncology. 15 (10), 2634-2671 (2021).
- Hernandez-Segura, A., Nehme, J., Demaria, M. Hallmarks of cellular senescence. Trends in Cell Biology. 28 (6), 436-453 (2018).
- Bojko, A., Czarnecka-Herok, J., Charzynska, A., Dabrowski, M., Sikora, E. Diversity of the senescence phenotype of cancer cells treated with chemotherapeutic agents. Cells. 8 (12), 1501 (2019).
- Mikuła-Pietrasik, J., Niklas, A., Uruski, P., Tykarski, A., Książek, K. Mechanisms and significance of therapy-induced and spontaneous senescence of cancer cells. Cellular and Molecular Life Sciences. 77 (2), 213-229 (2020).
- Lee, B. Y., et al. Senescence-associated beta-galactosidase is lysosomal beta-galactosidase. Aging cell. 5 (2), 187-195 (2006).
- Itahana, K., Itahana, Y., Dimri, G. P. Colorimetric detection of senescence-associated β galactosidase. Methods in Molecular Biology. 965, 143-156 (2013).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proceedings of the National Academy of Sciences of the United States of America. 92 (20), 9363-9367 (1995).
- Debacq-Chainiaux, F., Erusalimsky, J. D., Campisi, J., Toussaint, O. Protocols to detect senescence-associated beta-galactosidase (SA-betagal) activity, a biomarker of senescent cells in culture and in vivo. Nature Protocols. 4 (12), 1798-1806 (2009).
- Noppe, G., et al. Rapid flow cytometric method for measuring senescence associated beta-galactosidase activity in human fibroblasts. Cytometry A. 75 (11), 910-916 (2009).
- Tung, C. -. H., et al. In vivo imaging of β-galactosidase activity using far red fluorescent switch. Cancer Research. 64 (5), 1579-1583 (2004).
- Gong, H., et al. beta-Galactosidase activity assay using far-red-shifted fluorescent substrate DDAOG. Analytical Biochemistry. 386 (1), 59-64 (2009).
- Terman, A., Brunk, U. T. Lipofuscin: Mechanisms of formation and increase with age. APMIS. 106 (2), 265-276 (1998).
- Georgakopoulou, E. A., et al. Specific lipofuscin staining as a novel biomarker to detect replicative and stress-induced senescence. A method applicable in cryo-preserved and archival tissues. Aging. 5 (1), 37-50 (2013).
- Wang, B., Demaria, M. The quest to define and target cellular senescence in cancer. Cancer Research. 81 (24), 6087-6089 (2021).
- Appelbe, O. K., Zhang, Q., Pelizzari, C. A., Weichselbaum, R. R., Kron, S. J. Image-guided radiotherapy targets macromolecules through altering the tumor microenvironment. Molecular Pharmaceutics. 13 (10), 3457-3467 (2016).
- Maciorowski, Z., Chattopadhyay, P. K., Jain, P. Basic multicolor flow cytometry. Current Protocols in Immunology. 117, 1-38 (2017).
- Fan, Y., Cheng, J., Zeng, H., Shao, L. Senescent cell depletion through targeting BCL-family proteins and mitochondria. Frontiers in Physiology. 11, 593630 (2020).
- Kim, K. M., et al. Identification of senescent cell surface targetable protein DPP4. Genes and Development. 31 (15), 1529-1534 (2017).
- Flor, A. C., Kron, S. J. Lipid-derived reactive aldehydes link oxidative stress to cell senescence. Cell Death Discovery. 7 (9), 2366 (2016).
- Jochems, F., et al. The Cancer SENESCopedia: A delineation of cancer cell senescence. Cell reports. 36 (4), 109441 (2021).
- Fallah, M., et al. Doxorubicin and liposomal doxorubicin induce senescence by enhancing nuclear factor kappa B and mitochondrial membrane potential. Life Sciences. 232, 116677 (2019).
- Kasper, M., Barth, K. Bleomycin and its role in inducing apoptosis and senescence in lung cells – modulating effects of caveolin-1. Current Cancer Drug Targets. 9 (3), 341-353 (2009).
- Muthuramalingam, K., Cho, M., Kim, Y. Cellular senescence and EMT crosstalk in bleomycin-induced pathogenesis of pulmonary fibrosis-an in vitro analysis. Cell Biology International. 44 (2), 477-487 (2020).
- Flor, A. C., Wolfgeher, D., Wu, D., Kron, S. J. A signature of enhanced lipid metabolism, lipid peroxidation and aldehyde stress in therapy-induced senescence. Cell Death Discovery. 3, 17075 (2017).
- Burd, C. E., et al. Monitoring tumorigenesis and senescence in vivo with a p16(INK4a)-luciferase model. Cell. 152 (1-2), 340-351 (2013).
- Liu, J. Y., et al. Cells exhibiting strong p16 (INK4a) promoter activation in vivo display features of senescence. Proceedings of the National Academy of Sciences of the United States of America. 116 (7), 2603-2611 (2019).
- Wang, L., Lankhorst, L., Bernards, R. Exploiting senescence for the treatment of cancer. Nature Reviews Cancer. 22 (6), 340-355 (2022).
- Baek, K. -. H., Ryeom, S. Detection of oncogene-induced senescence in vivo. Methods in Molecular Biology. 1534, 185-198 (2017).
- González-Gualda, E., Baker, A. G., Fruk, L., Muñoz-Espín, D. A guide to assessing cellular senescence in vitro and in vivo. The FEBS Journal. 288 (1), 56-80 (2021).

