Långt-röd fluorescerande åldrande-associerad β-galaktosidassond för identifiering och anrikning av åldrande tumörceller genom flödescytometri
Summary
Ett protokoll för fluorescerande, flödescytometrisk kvantifiering av åldrande cancerceller inducerade av kemoterapiläkemedel i cellodling eller i murina tumörmodeller presenteras. Valfria procedurer inkluderar samimmunfärgning, provfixering för att underlätta analys av stora satser eller tidpunkter och anrikning av livskraftiga åldrande celler genom flödescytometrisk sortering.
Abstract
Cellulär åldrande är ett tillstånd av proliferativ arrestering inducerad av biologisk skada som normalt uppstår under år i åldrande celler men kan också dyka upp snabbt i tumörceller som ett svar på skador som induceras av olika cancerbehandlingar. Tumörcells åldrande anses i allmänhet vara oönskat, eftersom åldrande celler blir resistenta mot döden och blockerar tumörremission samtidigt som tumörmalignitet och behandlingsresistens förvärras. Därför är identifieringen av åldrande tumörceller av pågående intresse för cancerforskarsamhället. Olika åldrandeanalyser finns, många baserade på aktiviteten hos den välkända åldrande markören, senescence-associerad beta-galaktosidas (SA-β-Gal).
Vanligtvis utförs SA-β-Gal-analysen med användning av ett kromogent substrat (X-Gal) på fasta celler, med långsam och subjektiv uppräkning av “blå” senescenta celler genom ljusmikroskopi. Förbättrade analyser med cellpermeant, fluorescerande SA-β-Gal-substrat, inklusive C12-FDG (grön) och DDAO-Galactoside (DDAOG; långt röd), har möjliggjort analys av levande celler och möjliggjort användning av fluorescerande analysplattformar med hög genomströmning, inklusive flödescytometrar. C12-FDG är en väldokumenterad sond för SA-β-Gal, men dess gröna fluorescerande emission överlappar med inneboende cellulär autofluorescens (AF) som uppstår under åldrande på grund av ackumulering av lipofuscinaggregat. Genom att använda den fjärrröda SA-β-Gal-sonden DDAOG kan grön cellulär autofluorescens användas som en sekundär parameter för att bekräfta åldrande, vilket ger tillförlitlighet till analysen. De återstående fluorescenskanalerna kan användas för cellviabilitetsfärgning eller valfri fluorescerande immunmärkning.
Med hjälp av flödescytometri demonstrerar vi användningen av DDAOG och lipofuscin autofluorescens som en dubbelparameteranalys för identifiering av åldrande tumörceller. Kvantifiering av andelen livskraftiga senescenta celler utförs. Om så önskas kan ett valfritt immunmärkningssteg inkluderas för att utvärdera cellyteantigener av intresse. Identifierade senescenta celler kan också flödescytometriskt sorteras och samlas in för nedströmsanalys. Uppsamlade åldrande celler kan omedelbart lyseras (t.ex. för immunanalyser eller “omics-analys”) eller odlas ytterligare.
Introduction
Senescenta celler ackumuleras normalt i organismer under år under normalt biologiskt åldrande men kan också utvecklas snabbt i tumörceller som ett svar på skador som induceras av olika cancerbehandlingar, inklusive strålning och kemoterapi. Även om de inte längre sprider sig kan terapiinducerade senescenta (TIS) tumörceller bidra till behandlingsresistens och driva återfall 1,2,3. Faktorer som utsöndras av TIS-celler kan förvärra tumörmalignitet genom att främja immunflykt eller metastasering 4,5. TIS-celler utvecklar komplexa, kontextspecifika fenotyper, förändrade metaboliska profiler och unika immunsvar 6,7,8. Därför är identifiering och karakterisering av TIS-tumörceller inducerade av olika cancerbehandlingsmetoder ett ämne av pågående intresse för cancerforskningssamhället.
För att detektera TIS-tumörceller används konventionella åldrandeanalyser i stor utsträckning, främst baserat på att detektera ökad aktivitet hos åldrandemarkörenzymet, den lysosomala beta-galaktosidasen GLB19. Detektion vid ett nästan neutralt (snarare än surt) lysosomalt pH möjliggör specifik detektion av åldrande-associerat beta-galaktosidas (SA-β-Gal)10. En standard SA-β-Gal-analys som har använts i flera decennier använder X-Gal (5-brom-4-klor-3-indolyl-β-D-galaktopyranosid), ett blått kromogent beta-galaktosidassubstrat, för att detektera SA-β-Gal i fasta celler med ljusmikroskopi11. X-Gal-analysen möjliggör kvalitativ visuell bekräftelse av TIS med hjälp av allmänt tillgängliga reagenser och laboratorieutrustning. Ett grundläggande överfört ljusmikroskop är den enda instrumentering som krävs för att utvärdera närvaron av det blå kromogenet. X-Gal-färgningsproceduren kan dock sakna känslighet, vilket ibland kräver mer än 24 timmar för att färgen ska utvecklas. Färgning följs av låg genomströmning, subjektiv poängsättning av enskilda senescenta celler baserat på att räkna cellerna som uppvisar en viss intensitetsnivå av den blå kromogenen under ett ljusmikroskop. Eftersom X-Gal är cellogenomtränglig kräver denna analys lösningsmedelsfixerade celler, som inte kan återvinnas för nedströmsanalys. När man arbetar med begränsade prover från djur eller patienter kan detta vara en stor nackdel.
Förbättrade SA-β-Gal-analyser med cellpermeant, fluorescerande enzymsubstrat, inklusive C 12-FDG (5-dodecanoylaminofluorescein Di-β-D-Galactopyranoside, grön) och DDAOG (9H-(1,3-diklor-9,9-dimetylakridin-2-en-7-yl) β-D-Galactopyranoside, långt röd) har tidigare förekommit i litteraturen12,13,14,15. DDAOG:s kemiska sondstruktur och optiska egenskaper visas i kompletterande figur S1. Dessa cellpermeanta sonder möjliggör analys av levande (snarare än fasta) celler, och fluorescerande snarare än kromogena sonder underlättar användningen av snabba fluorescerande analysplattformar med hög genomströmning, inklusive screeninginstrument med högt innehåll och flödescytometrar. Sorteringsflödescytometrar möjliggör återhämtning av berikade populationer av levande åldrande celler från cellkulturer eller tumörer för nedströmsanalys (t.ex. western blotting, ELISA eller ‘omics). Fluorescensanalys ger också en kvantitativ signal, vilket möjliggör mer exakt bestämning av andelen åldrande celler i ett givet prov. Ytterligare fluorescerande sonder, inklusive viabilitetssonder och fluoroformärkta antikroppar, kan lätt läggas till för multiplexerad analys av mål utöver SA-β-Gal.
I likhet med DDAOG är C12-FDG en fluorescerande sond för SA-β-Gal, men dess gröna fluorescerande utsläpp överlappar med inneboende cellulär AF, som uppstår under åldrande på grund av ackumulering av lipofuscinaggregat i celler16. Genom att använda den fjärrröda DDAOG-sonden kan grön cellulär AF användas som en sekundär parameter för att bekräfta åldrande17. Detta förbättrar analysens tillförlitlighet genom att använda en andra markör utöver SA-β-Gal, som ofta kan vara opålitlig som en enda markör för åldrande18. Eftersom detektion av endogen AF i åldrande celler är ett etikettfritt tillvägagångssätt är det ett snabbt och enkelt sätt att utöka specificiteten hos vår DDAOG-baserade analys.
I detta protokoll demonstrerar vi användningen av DDAOG och AF som en snabb, dubbelparameterflödescytometrianalys för identifiering av livskraftiga TIS-tumörceller från in vitro-kulturer eller isolerade från läkemedelsbehandlade tumörer etablerade hos möss (Figur 1). Protokollet använder fluoroforer som är kompatibla med ett brett spektrum av vanliga kommersiella flödescytometrianalysatorer och sorterare (tabell 1). Kvantifiering av procentandelen livskraftiga senescenta celler med hjälp av standardflödescytometrianalys är aktiverad. Om så önskas kan ett valfritt immunmärkningssteg utföras för att utvärdera cellyteantigener av intresse samtidigt med åldrande. Identifierade senescenta celler kan också berikas med hjälp av standard fluorescensaktiverad cellsorteringsmetodik (FACS).
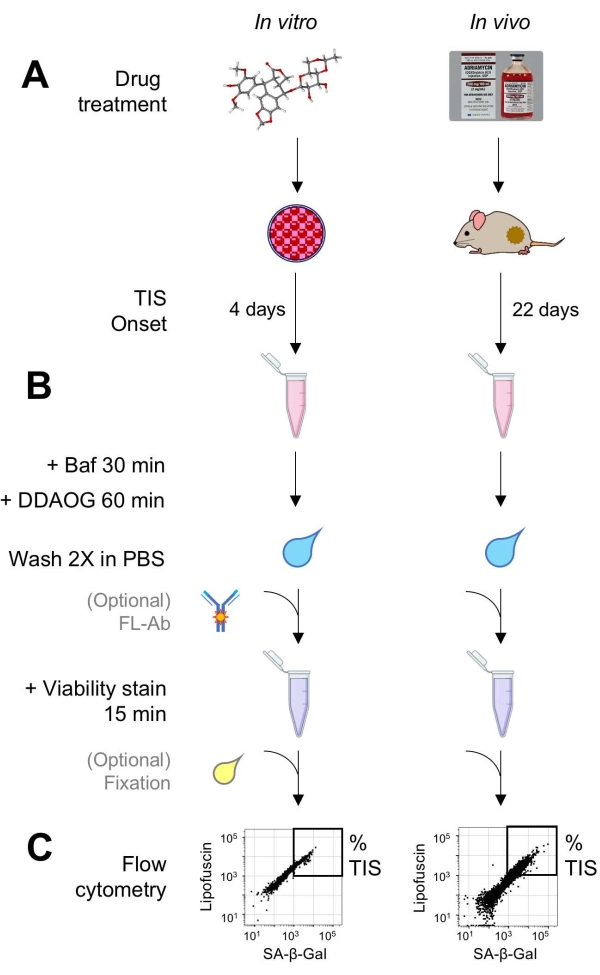
Bild 1: Experimentellt arbetsflöde. Ett schema som sammanfattar viktiga punkter i DDAOG-analysen. (A) Ett TIS-inducerande läkemedel tillsätts till däggdjursodlade celler eller administreras till tumörbärande möss. Tid tillåts sedan för uppkomsten av TIS: för celler, 4 dagar efter behandling; för möss, totalt 22 dagar, med tre behandlingar var 5: e dag plus 7 dagars återhämtning. Celler skördas eller tumörer dissocieras i suspension. B) Proverna behandlas med Baf för att justera lysosomalt pH för detektion av SA-β-Gal i 30 minuter. Sedan läggs DDAOG-sonden till i 60 minuter för att detektera SA-β-Gal. Proverna tvättas 2x i PBS, och en viabilitetsfläck tillsätts kort (15 min). Eventuellt kan prover färgas med fluorescerande antikroppar i öppna fluorescenskanaler och/eller fixeras för senare analys. (C) Proverna analyseras med hjälp av en standardflödescytometer. Livskraftiga celler visualiseras i punktdiagram som visar röd DDAOG (indikerar SA-β-Gal) kontra grön autofluorescens (lipofuscin). En grind för att bestämma procentandelen TIS-celler upprättas baserat på obehandlade kontrollprover (visas inte). Om en sorteringscytometer (FACS) används kan TIS-celler samlas in och placeras tillbaka i odling för ytterligare in vitro-analyser eller lyseras och bearbetas för molekylärbiologiska analyser. Förkortningar: DDAO = 9H-(1,3-diklor-9,9-dimetylakridin-2-on); DDAOG = DDAO-Galaktosid; TIS = terapiinducerad åldrande; FL-Ab = fluoroforkonjugerad antikropp; Baf = Bafilomycin A1; SA-β-Gal = åldrande-associerad beta-galaktosidas; PBS = fosfatbuffrad saltlösning; FACS = fluorescensaktiverad cellsortering. Klicka här för att se en större version av denna siffra.
| Fluorofor | Upptäcker | Ex/Em (nm) | Cytometerlaser (nm) | Cytometerdetektor / bandpassfilter (nm) |
| DDAOG | SA-β-Gal | 645/6601 | 640 | 670 / 30 |
| AF | Lipofuscin | < 600 | 488 | 525 / 50 |
| CV450 | Livsduglighet | 408/450 | 405 | 450 / 50 |
| PE | Antikropps-/ytmarkör | 565/578 | 561 | 582 / 15 |
Tabell 1: Optiska specifikationer för fluoroforer och cytometer. Cytometerspecifikationer som används i detta protokoll listas för ett instrument med totalt 4 lasrar och 15 emissionsdetektorer. DDAOG detekterad vid 645/660 nm är formen av sonden klyvd av SA-β-Gal1. Uncleaved DDAOG kan uppvisa låg fluorescens vid 460/610 nm men avlägsnas genom tvättsteg i protokollet. Förkortningar: DDAO = 9H-(1,3-diklor-9,9-dimetylakridin-2-on); DDAOG = DDAO-Galaktosid; AF = autofluorescens; PE = phycoerythrin; SA-β-Gal = åldrande-associerad beta-galaktosidas.
Protocol
Representative Results
Discussion
Under det senaste decenniet eller så har flödescytometri blivit en vanligare analysplattform inom cancerforskning på grund av tumörimmunologins framväxande popularitet, utvecklingen av billigare flödescytometrar och förbättringen av delade instrumenteringsanläggningar vid akademiska institutioner. Flerfärgade analyser är nu standard, eftersom de flesta nyare instrument är utrustade med violetta, blågröna och röda till långt röda optiska arrays. Således är detta DDAOG-protokoll sannolikt kompatibelt med…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Vi tackar Cytometry and Antibody Core Facility vid University of Chicago för stöd för flödescytometriinstrumentation. Animal Research Center vid University of Chicago tillhandahöll djurbostäder.
Materials
| Bafilomycin A1 | Research Products International | B40500 | |
| Bleomycin sulfate | Cayman | 13877 | |
| Bovine serum albumin (BSA) | US Biological | A1380 | |
| Calcein Violet 450 AM viability dye | ThermoFisher Scientific | 65-0854-39 | eBioscience |
| DPP4 antibody, PE conjugate | Biolegend | 137803 | Clone H194-112 |
| Cell line: A549 human lung adenocarcinoma | American Type Culture Collection | CCL-185 | |
| Cell line: B16-F10 mouse melanoma | American Type Culture Collection | CRL-6475 | |
| Cell scraper | Corning | 3008 | |
| Cell strainers, 100 µm | Falcon | 352360 | |
| DDAO-Galactoside | Life Technologies | D6488 | |
| DMEM medium 1x | Life Technologies | 11960-069 | |
| DMSO | Sigma | D2438 | |
| DNAse I | Sigma | DN25 | |
| Doxorubicin, hydrochloride injection (USP) | Pfizer | NDC 0069-3032-20 | |
| Doxorubicin, PEGylated liposomal (USP) | Sun Pharmaceutical | NDC 47335-049-40 | |
| EDTA 0.5 M | Life Technologies | 15575-038 | |
| Etoposide | Cayman | 12092 | |
| FBS | Omega | FB-11 | |
| Fc receptor blocking reagent | Biolegend | 101320 | Anti-mouse CD16/32 |
| Flow cytometer (cell analyzer) | Becton Dickinson (BD) | Various | LSRFortessa |
| Flow cytometer (cell sorter) | Becton Dickinson (BD) | Various | FACSAria |
| GlutaMax 100x | Life Technologies | 35050061 | |
| HEPES 1 M | Lonza | BW17737 | |
| Liberase TL | Sigma | 5401020001 | Roche |
| Paraformaldehyde 16% | Electron Microscopy Sciences | 15710 | |
| Penicillin/Streptomycin 100x | Life Technologies | 15140122 | |
| Phosphate buffered saline (PBS) 1x | Corning | MT21031CV | Dulbecco's PBS (without calcium and magnesium) |
| Rainbow calibration particles, ultra kit | SpheroTech | UCRP-38-2K | 3.5-3.9 µm, 2E6/mL |
| RPMI-1640 medium 1x | Life Technologies | 11875-119 | |
| Sodium chloride 0.9% (USP) | Baxter Healthcare Corporation | 2B1324 | |
| Software for cytometer data acquisition, "FACSDiva" | Becton Dickinson (BD) | n/a | Contact BD for license |
| Software for cytometer data analysis, "FlowJo" | TreeStar | n/a | Contact TreeStar for license |
| Trypsin-EDTA 0.25% | Life Technologies | 25200-114 |
References
- Saleh, T., Tyutyunyk-Massey, L., Gewirtz, D. A. Tumor cell escape from therapy-induced senescence as a model of disease recurrence after dormancy. Cancer Research. 79 (6), 1044-1046 (2019).
- Wang, B., Kohli, J., Demaria, M. Senescent cells in cancer therapy: friends or foes. Trends in Cancer. 6 (10), 838-857 (2020).
- Prasanna, P. G., et al. Therapy-induced senescence: Opportunities to improve anticancer therapy. Journal of the National Cancer Institute. 113 (10), 1285-1298 (2021).
- Velarde, M. C., Demaria, M., Campisi, J. Senescent cells and their secretory phenotype as targets for cancer therapy. Interdisciplinary Topics in Gerontology and Geriatrics. 38, 17-27 (2013).
- Ou, H. L., et al. Cellular senescence in cancer: from mechanisms to detection. Molecular Oncology. 15 (10), 2634-2671 (2021).
- Hernandez-Segura, A., Nehme, J., Demaria, M. Hallmarks of cellular senescence. Trends in Cell Biology. 28 (6), 436-453 (2018).
- Bojko, A., Czarnecka-Herok, J., Charzynska, A., Dabrowski, M., Sikora, E. Diversity of the senescence phenotype of cancer cells treated with chemotherapeutic agents. Cells. 8 (12), 1501 (2019).
- Mikuła-Pietrasik, J., Niklas, A., Uruski, P., Tykarski, A., Książek, K. Mechanisms and significance of therapy-induced and spontaneous senescence of cancer cells. Cellular and Molecular Life Sciences. 77 (2), 213-229 (2020).
- Lee, B. Y., et al. Senescence-associated beta-galactosidase is lysosomal beta-galactosidase. Aging cell. 5 (2), 187-195 (2006).
- Itahana, K., Itahana, Y., Dimri, G. P. Colorimetric detection of senescence-associated β galactosidase. Methods in Molecular Biology. 965, 143-156 (2013).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proceedings of the National Academy of Sciences of the United States of America. 92 (20), 9363-9367 (1995).
- Debacq-Chainiaux, F., Erusalimsky, J. D., Campisi, J., Toussaint, O. Protocols to detect senescence-associated beta-galactosidase (SA-betagal) activity, a biomarker of senescent cells in culture and in vivo. Nature Protocols. 4 (12), 1798-1806 (2009).
- Noppe, G., et al. Rapid flow cytometric method for measuring senescence associated beta-galactosidase activity in human fibroblasts. Cytometry A. 75 (11), 910-916 (2009).
- Tung, C. -. H., et al. In vivo imaging of β-galactosidase activity using far red fluorescent switch. Cancer Research. 64 (5), 1579-1583 (2004).
- Gong, H., et al. beta-Galactosidase activity assay using far-red-shifted fluorescent substrate DDAOG. Analytical Biochemistry. 386 (1), 59-64 (2009).
- Terman, A., Brunk, U. T. Lipofuscin: Mechanisms of formation and increase with age. APMIS. 106 (2), 265-276 (1998).
- Georgakopoulou, E. A., et al. Specific lipofuscin staining as a novel biomarker to detect replicative and stress-induced senescence. A method applicable in cryo-preserved and archival tissues. Aging. 5 (1), 37-50 (2013).
- Wang, B., Demaria, M. The quest to define and target cellular senescence in cancer. Cancer Research. 81 (24), 6087-6089 (2021).
- Appelbe, O. K., Zhang, Q., Pelizzari, C. A., Weichselbaum, R. R., Kron, S. J. Image-guided radiotherapy targets macromolecules through altering the tumor microenvironment. Molecular Pharmaceutics. 13 (10), 3457-3467 (2016).
- Maciorowski, Z., Chattopadhyay, P. K., Jain, P. Basic multicolor flow cytometry. Current Protocols in Immunology. 117, 1-38 (2017).
- Fan, Y., Cheng, J., Zeng, H., Shao, L. Senescent cell depletion through targeting BCL-family proteins and mitochondria. Frontiers in Physiology. 11, 593630 (2020).
- Kim, K. M., et al. Identification of senescent cell surface targetable protein DPP4. Genes and Development. 31 (15), 1529-1534 (2017).
- Flor, A. C., Kron, S. J. Lipid-derived reactive aldehydes link oxidative stress to cell senescence. Cell Death Discovery. 7 (9), 2366 (2016).
- Jochems, F., et al. The Cancer SENESCopedia: A delineation of cancer cell senescence. Cell reports. 36 (4), 109441 (2021).
- Fallah, M., et al. Doxorubicin and liposomal doxorubicin induce senescence by enhancing nuclear factor kappa B and mitochondrial membrane potential. Life Sciences. 232, 116677 (2019).
- Kasper, M., Barth, K. Bleomycin and its role in inducing apoptosis and senescence in lung cells – modulating effects of caveolin-1. Current Cancer Drug Targets. 9 (3), 341-353 (2009).
- Muthuramalingam, K., Cho, M., Kim, Y. Cellular senescence and EMT crosstalk in bleomycin-induced pathogenesis of pulmonary fibrosis-an in vitro analysis. Cell Biology International. 44 (2), 477-487 (2020).
- Flor, A. C., Wolfgeher, D., Wu, D., Kron, S. J. A signature of enhanced lipid metabolism, lipid peroxidation and aldehyde stress in therapy-induced senescence. Cell Death Discovery. 3, 17075 (2017).
- Burd, C. E., et al. Monitoring tumorigenesis and senescence in vivo with a p16(INK4a)-luciferase model. Cell. 152 (1-2), 340-351 (2013).
- Liu, J. Y., et al. Cells exhibiting strong p16 (INK4a) promoter activation in vivo display features of senescence. Proceedings of the National Academy of Sciences of the United States of America. 116 (7), 2603-2611 (2019).
- Wang, L., Lankhorst, L., Bernards, R. Exploiting senescence for the treatment of cancer. Nature Reviews Cancer. 22 (6), 340-355 (2022).
- Baek, K. -. H., Ryeom, S. Detection of oncogene-induced senescence in vivo. Methods in Molecular Biology. 1534, 185-198 (2017).
- González-Gualda, E., Baker, A. G., Fruk, L., Muñoz-Espín, D. A guide to assessing cellular senescence in vitro and in vivo. The FEBS Journal. 288 (1), 56-80 (2021).

