Sonda de β-galactosidasa asociada a senescencia fluorescente de color rojo lejano para la identificación y el enriquecimiento de células tumorales senescentes mediante citometría de flujo
Summary
Se presenta un protocolo para la cuantificación citométrica de flujo fluorescente de células cancerosas senescentes inducidas por fármacos de quimioterapia en cultivo celular o en modelos tumorales murinos. Los procedimientos opcionales incluyen la co-inmunotinción, la fijación de muestras para facilitar el análisis de lotes grandes o puntos de tiempo, y el enriquecimiento de células senescentes viables mediante clasificación citométrica de flujo.
Abstract
La senescencia celular es un estado de detención proliferativa inducido por daño biológico que normalmente se acumula durante años en las células envejecidas, pero también puede emerger rápidamente en las células tumorales como respuesta al daño inducido por diversos tratamientos contra el cáncer. La senescencia de las células tumorales generalmente se considera indeseable, ya que las células senescentes se vuelven resistentes a la muerte y bloquean la remisión tumoral al tiempo que exacerban la malignidad tumoral y la resistencia al tratamiento. Por lo tanto, la identificación de células tumorales senescentes es de interés continuo para la comunidad de investigación del cáncer. Existen varios ensayos de senescencia, muchos basados en la actividad del conocido marcador de senescencia, beta-galactosidasa asociada a senescencia (SA-β-Gal).
Típicamente, el ensayo SA-β-Gal se realiza utilizando un sustrato cromogénico (X-Gal) en células fijas, con la enumeración lenta y subjetiva de células senescentes “azules” por microscopía óptica. Los ensayos mejorados que utilizan sustratos SA-β-Gal fluorescentes permeantes a las células, incluidos C12-FDG (verde) y DDAO-Galactósido (DDAOG; rojo lejano), han permitido el análisis de células vivas y han permitido el uso de plataformas de análisis fluorescentes de alto rendimiento, incluidos citómetros de flujo. C12-FDG es una sonda bien documentada para SA-β-Gal, pero su emisión fluorescente verde se superpone con la autofluorescencia celular intrínseca (FA) que surge durante la senescencia debido a la acumulación de agregados de lipofuscina. Al utilizar la sonda SA-β-Gal DDAOG de color rojo lejano, la autofluorescencia celular verde se puede usar como parámetro secundario para confirmar la senescencia, agregando confiabilidad al ensayo. Los canales de fluorescencia restantes se pueden utilizar para la tinción de viabilidad celular o el inmunomarcaje fluorescente opcional.
Usando citometría de flujo, demostramos el uso de DDAOG y autofluorescencia de lipofuscina como un ensayo de doble parámetro para la identificación de células tumorales senescentes. Se realiza la cuantificación del porcentaje de células senescentes viables. Si se desea, se puede incluir un paso opcional de inmunomarcaje para evaluar los antígenos de la superficie celular de interés. Las células senescentes identificadas también se pueden clasificar citométricamente y recolectar para el análisis posterior. Las células senescentes recolectadas pueden ser inmediatamente lisadas (por ejemplo, para inmunoensayos o análisis ómico) o cultivadas adicionalmente.
Introduction
Las células senescentes normalmente se acumulan en los organismos durante años durante el envejecimiento biológico normal, pero también pueden desarrollarse rápidamente en las células tumorales como respuesta al daño inducido por diversos tratamientos contra el cáncer, incluida la radiación y la quimioterapia. Aunque ya no proliferan, las células tumorales senescentes inducidas por el tratamiento (TIS) pueden contribuir a la resistencia al tratamiento y conducir a la recurrencia 1,2,3. Los factores secretados por las células TIS pueden exacerbar la malignidad tumoral al promover la evasión inmune o la metástasis 4,5. Las células TIS desarrollan fenotipos complejos y específicos del contexto, perfiles metabólicos alterados y respuestas inmunes únicas 6,7,8. Por lo tanto, la identificación y caracterización de las células tumorales TIS inducidas por diversos enfoques de tratamiento del cáncer es un tema de interés continuo para la comunidad de investigación del cáncer.
Para detectar células tumorales TIS, los ensayos convencionales de senescencia son ampliamente utilizados, basados principalmente en la detección de una mayor actividad de la enzima marcador de senescencia, la beta-galactosidasa lisosomal GLB19. La detección a un pH lisosomal casi neutro (en lugar de ácido) permite la detección específica de beta-galactosidasa asociada a senescencia (SA-β-Gal)10. Un ensayo estándar de SA-β-Gal que se ha utilizado durante varias décadas utiliza X-Gal (5-bromo-4-cloro-3-indolil-β-D-galactopiranosido), un sustrato de beta-galactosidasa cromogénica azul, para detectar SA-β-Gal en células fijas por microscopía óptica11. El ensayo X-Gal permite la confirmación visual cualitativa de TIS utilizando reactivos y equipos de laboratorio comúnmente disponibles. Un microscopio básico de luz transmitida es la única instrumentación necesaria para evaluar la presencia del cromógeno azul. Sin embargo, el procedimiento de tinción X-Gal puede carecer de sensibilidad, a veces requiere más de 24 h para que se desarrolle el color. La tinción es seguida por una puntuación subjetiva de bajo rendimiento de las células senescentes individuales basada en el recuento de las células que exhiben algún nivel de intensidad del cromógeno azul bajo un microscopio óptico. Como X-Gal es impermeable a las células, este ensayo requiere células fijas con disolvente, que no se pueden recuperar para el análisis posterior. Cuando se trabaja con muestras limitadas de animales o pacientes, esto puede ser un gran inconveniente.
Ensayos mejorados de SA-β-Gal utilizando sustratos enzimáticos fluorescentes permeantes a las células, incluyendo C 12-FDG (5-dodecanoylaminofluorescein Di-β-D-Galactopyranoside, verde) y DDAOG (9H-(1,3-dichloro-9,9-dimethylacridin-2-one-7-yl) β-D-Galactopyranoside, far-red) han aparecido previamente en la literatura12,13,14,15. La estructura de la sonda química y las características ópticas de DDAOG se muestran en la figura suplementaria S1. Estas sondas permisas de células permiten el análisis de células vivas (en lugar de fijas), y las sondas fluorescentes en lugar de cromogénicas facilitan el uso de plataformas de análisis fluorescentes rápidas de alto rendimiento, incluidos instrumentos de detección de alto contenido y citómetros de flujo. Los citómetros de flujo de clasificación permiten la recuperación de poblaciones enriquecidas de células senescentes vivas de cultivos celulares o tumores para el análisis posterior (por ejemplo, western blotting, ELISA o ‘ómicas). El análisis de fluorescencia también proporciona una señal cuantitativa, lo que permite una determinación más precisa del porcentaje de células senescentes dentro de una muestra dada. Se pueden agregar fácilmente sondas fluorescentes adicionales, incluidas sondas de viabilidad y anticuerpos marcados con fluoróforos, para el análisis multiplexado de objetivos más allá de SA-β-Gal.
Similar a DDAOG, C12-FDG es una sonda fluorescente para SA-β-Gal, pero su emisión fluorescente verde se superpone con AF celular intrínseca, que surge durante la senescencia debido a la acumulación de agregados de lipofuscina en las células16. Al utilizar la sonda DDAOG de color rojo lejano, el AF celular verde se puede usar como parámetro secundario para confirmar la senescencia17. Esto mejora la fiabilidad del ensayo mediante el uso de un segundo marcador además de SA-β-Gal, que a menudo puede ser poco fiable como marcador único para la senescencia18. Como la detección de FA endógena en células senescentes es un enfoque sin etiquetas, es una forma rápida y sencilla de ampliar la especificidad de nuestro ensayo basado en DDAOG.
En este protocolo, demostramos el uso de DDAOG y FA como un ensayo rápido de citometría de flujo de doble parámetro para la identificación de células tumorales TIS viables de cultivos in vitro o aisladas de tumores tratados con fármacos establecidos en ratones (Figura 1). El protocolo utiliza fluoróforos compatibles con una amplia gama de analizadores y clasificadores de citometría de flujo comerciales estándar (Tabla 1). Se habilita la cuantificación del porcentaje de células senescentes viables mediante el análisis de citometría de flujo estándar. Si se desea, se puede realizar un paso opcional de inmunomarcaje para evaluar los antígenos de la superficie celular de interés simultáneamente con la senescencia. Las células senescentes identificadas también pueden enriquecerse utilizando la metodología estándar de clasificación celular activada por fluorescencia (FACS).
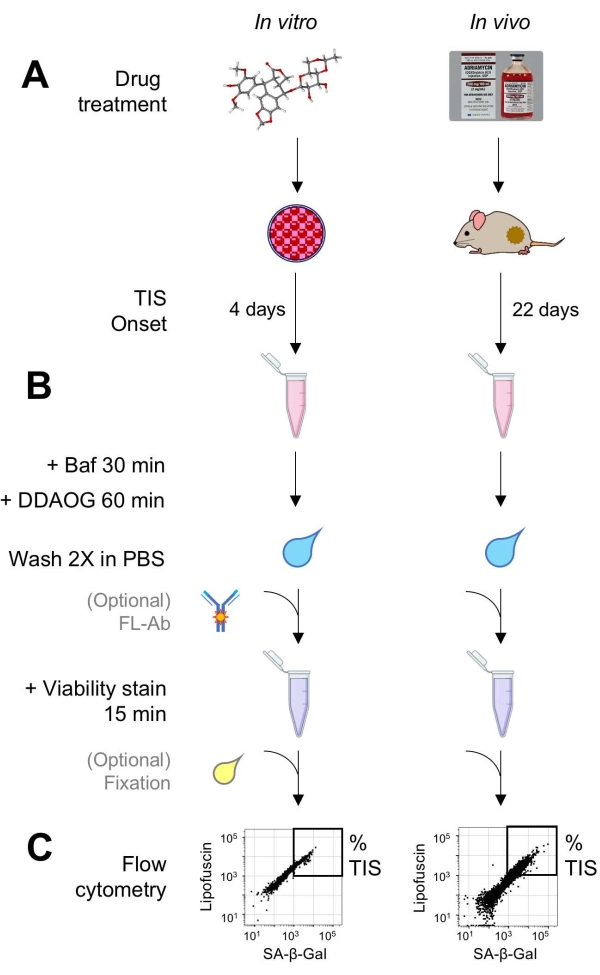
Figura 1: Flujo de trabajo experimental. Un esquema que resume los puntos clave del ensayo DDAOG. (A) Se agrega un fármaco inductor de SIS a las células cultivadas en mamíferos o se administra a ratones portadores de tumores. Luego se permite tiempo para el inicio de TIS: para las células, 4 días después del tratamiento; para ratones, 22 días en total, con tres tratamientos cada 5 días más 7 días de recuperación. Las células se cosechan o los tumores se disocian en suspensión. (B) Las muestras se tratan con Baf para ajustar el pH lisosomal para la detección de SA-β-Gal durante 30 minutos; luego, se agrega una sonda DDAOG durante 60 minutos para detectar SA-β-Gal. Las muestras se lavan 2 veces en PBS, y se agrega brevemente una tinción de viabilidad (15 min). Opcionalmente, las muestras pueden teñirse con anticuerpos fluorescentes en canales de fluorescencia abiertos y/o fijarse para su posterior análisis. (C) Las muestras se analizan utilizando un citómetro de flujo estándar. Las células viables se visualizan en diagramas de puntos que muestran DDAOG rojo (que indica SA-β-Gal) versus autofluorescencia verde (lipofuscina). Se establece una puerta para determinar el porcentaje de células TIS en función de las muestras de control no tratadas (no mostradas). Si se utiliza un citómetro de clasificación (FACS), las células TIS se pueden recolectar y volver a colocar en cultivo para ensayos in vitro adicionales o lisarse y procesarse para ensayos de biología molecular. Abreviaturas: DDAO = 9H-(1,3-dicloro-9,9-dimetilacridina-2-ona); DDAOG = DDAO-Galactósido; TIS = senescencia inducida por terapia; FL-Ab = anticuerpo conjugado con fluoróforos; Baf = Bafilomicina A1; SA-β-Gal = beta-galactosidasa asociada a senescencia; PBS = solución salina tamponada con fosfato; FACS = clasificación celular activada por fluorescencia. Haga clic aquí para ver una versión más grande de esta figura.
| Fluoróforo | Detecta | Ex/Em (nm) | Citómetro láser (nm) | Detector de citómetro / filtro de paso de banda (nm) |
| DDAOG | SA-β-Gal | 645/6601 | 640 | 670 / 30 |
| AF | Lipofuscina | < 600 | 488 | 525 / 50 |
| CV450 | Viabilidad | 408/450 | 405 | 450 / 50 |
| PEI | Marcador de anticuerpos/superficie | 565/578 | 561 | 582 / 15 |
Tabla 1: Especificaciones ópticas de fluoróforos y citómetros. Las especificaciones del citómetro utilizadas en este protocolo se enumeran para un instrumento con un total de 4 láseres y 15 detectores de emisión. DDAOG detectado a 645/660 nm es la forma de la sonda escindida por SA-β-Gal1. Uncleaved DDAOG puede exhibir fluorescencia de bajo nivel a 460/610 nm, pero se elimina mediante pasos de lavado en el protocolo. Abreviaturas: DDAO = 9H-(1,3-dicloro-9,9-dimetilacridina-2-ona); DDAOG = DDAO-Galactósido; FA = autofluorescencia; PE = ficoeritrina; SA-β-Gal = beta-galactosidasa asociada a senescencia.
Protocol
Representative Results
Discussion
Durante la última década más o menos, la citometría de flujo se ha convertido en una plataforma de ensayo más común en la investigación del cáncer debido a la popularidad emergente de la inmunología tumoral, el desarrollo de citómetros de flujo de menor costo y la mejora de las instalaciones de instrumentación compartidas en las instituciones académicas. Los ensayos multicolor ahora son estándar, ya que la mayoría de los instrumentos más nuevos están equipados con matrices ópticas violetas, azul-verde y …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Agradecemos a la Cytometry and Antibody Core Facility de la Universidad de Chicago por su apoyo en la instrumentación de citometría de flujo. El Centro de Investigación Animal de la Universidad de Chicago proporcionó alojamiento para animales.
Materials
| Bafilomycin A1 | Research Products International | B40500 | |
| Bleomycin sulfate | Cayman | 13877 | |
| Bovine serum albumin (BSA) | US Biological | A1380 | |
| Calcein Violet 450 AM viability dye | ThermoFisher Scientific | 65-0854-39 | eBioscience |
| DPP4 antibody, PE conjugate | Biolegend | 137803 | Clone H194-112 |
| Cell line: A549 human lung adenocarcinoma | American Type Culture Collection | CCL-185 | |
| Cell line: B16-F10 mouse melanoma | American Type Culture Collection | CRL-6475 | |
| Cell scraper | Corning | 3008 | |
| Cell strainers, 100 µm | Falcon | 352360 | |
| DDAO-Galactoside | Life Technologies | D6488 | |
| DMEM medium 1x | Life Technologies | 11960-069 | |
| DMSO | Sigma | D2438 | |
| DNAse I | Sigma | DN25 | |
| Doxorubicin, hydrochloride injection (USP) | Pfizer | NDC 0069-3032-20 | |
| Doxorubicin, PEGylated liposomal (USP) | Sun Pharmaceutical | NDC 47335-049-40 | |
| EDTA 0.5 M | Life Technologies | 15575-038 | |
| Etoposide | Cayman | 12092 | |
| FBS | Omega | FB-11 | |
| Fc receptor blocking reagent | Biolegend | 101320 | Anti-mouse CD16/32 |
| Flow cytometer (cell analyzer) | Becton Dickinson (BD) | Various | LSRFortessa |
| Flow cytometer (cell sorter) | Becton Dickinson (BD) | Various | FACSAria |
| GlutaMax 100x | Life Technologies | 35050061 | |
| HEPES 1 M | Lonza | BW17737 | |
| Liberase TL | Sigma | 5401020001 | Roche |
| Paraformaldehyde 16% | Electron Microscopy Sciences | 15710 | |
| Penicillin/Streptomycin 100x | Life Technologies | 15140122 | |
| Phosphate buffered saline (PBS) 1x | Corning | MT21031CV | Dulbecco's PBS (without calcium and magnesium) |
| Rainbow calibration particles, ultra kit | SpheroTech | UCRP-38-2K | 3.5-3.9 µm, 2E6/mL |
| RPMI-1640 medium 1x | Life Technologies | 11875-119 | |
| Sodium chloride 0.9% (USP) | Baxter Healthcare Corporation | 2B1324 | |
| Software for cytometer data acquisition, "FACSDiva" | Becton Dickinson (BD) | n/a | Contact BD for license |
| Software for cytometer data analysis, "FlowJo" | TreeStar | n/a | Contact TreeStar for license |
| Trypsin-EDTA 0.25% | Life Technologies | 25200-114 |
References
- Saleh, T., Tyutyunyk-Massey, L., Gewirtz, D. A. Tumor cell escape from therapy-induced senescence as a model of disease recurrence after dormancy. Cancer Research. 79 (6), 1044-1046 (2019).
- Wang, B., Kohli, J., Demaria, M. Senescent cells in cancer therapy: friends or foes. Trends in Cancer. 6 (10), 838-857 (2020).
- Prasanna, P. G., et al. Therapy-induced senescence: Opportunities to improve anticancer therapy. Journal of the National Cancer Institute. 113 (10), 1285-1298 (2021).
- Velarde, M. C., Demaria, M., Campisi, J. Senescent cells and their secretory phenotype as targets for cancer therapy. Interdisciplinary Topics in Gerontology and Geriatrics. 38, 17-27 (2013).
- Ou, H. L., et al. Cellular senescence in cancer: from mechanisms to detection. Molecular Oncology. 15 (10), 2634-2671 (2021).
- Hernandez-Segura, A., Nehme, J., Demaria, M. Hallmarks of cellular senescence. Trends in Cell Biology. 28 (6), 436-453 (2018).
- Bojko, A., Czarnecka-Herok, J., Charzynska, A., Dabrowski, M., Sikora, E. Diversity of the senescence phenotype of cancer cells treated with chemotherapeutic agents. Cells. 8 (12), 1501 (2019).
- Mikuła-Pietrasik, J., Niklas, A., Uruski, P., Tykarski, A., Książek, K. Mechanisms and significance of therapy-induced and spontaneous senescence of cancer cells. Cellular and Molecular Life Sciences. 77 (2), 213-229 (2020).
- Lee, B. Y., et al. Senescence-associated beta-galactosidase is lysosomal beta-galactosidase. Aging cell. 5 (2), 187-195 (2006).
- Itahana, K., Itahana, Y., Dimri, G. P. Colorimetric detection of senescence-associated β galactosidase. Methods in Molecular Biology. 965, 143-156 (2013).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proceedings of the National Academy of Sciences of the United States of America. 92 (20), 9363-9367 (1995).
- Debacq-Chainiaux, F., Erusalimsky, J. D., Campisi, J., Toussaint, O. Protocols to detect senescence-associated beta-galactosidase (SA-betagal) activity, a biomarker of senescent cells in culture and in vivo. Nature Protocols. 4 (12), 1798-1806 (2009).
- Noppe, G., et al. Rapid flow cytometric method for measuring senescence associated beta-galactosidase activity in human fibroblasts. Cytometry A. 75 (11), 910-916 (2009).
- Tung, C. -. H., et al. In vivo imaging of β-galactosidase activity using far red fluorescent switch. Cancer Research. 64 (5), 1579-1583 (2004).
- Gong, H., et al. beta-Galactosidase activity assay using far-red-shifted fluorescent substrate DDAOG. Analytical Biochemistry. 386 (1), 59-64 (2009).
- Terman, A., Brunk, U. T. Lipofuscin: Mechanisms of formation and increase with age. APMIS. 106 (2), 265-276 (1998).
- Georgakopoulou, E. A., et al. Specific lipofuscin staining as a novel biomarker to detect replicative and stress-induced senescence. A method applicable in cryo-preserved and archival tissues. Aging. 5 (1), 37-50 (2013).
- Wang, B., Demaria, M. The quest to define and target cellular senescence in cancer. Cancer Research. 81 (24), 6087-6089 (2021).
- Appelbe, O. K., Zhang, Q., Pelizzari, C. A., Weichselbaum, R. R., Kron, S. J. Image-guided radiotherapy targets macromolecules through altering the tumor microenvironment. Molecular Pharmaceutics. 13 (10), 3457-3467 (2016).
- Maciorowski, Z., Chattopadhyay, P. K., Jain, P. Basic multicolor flow cytometry. Current Protocols in Immunology. 117, 1-38 (2017).
- Fan, Y., Cheng, J., Zeng, H., Shao, L. Senescent cell depletion through targeting BCL-family proteins and mitochondria. Frontiers in Physiology. 11, 593630 (2020).
- Kim, K. M., et al. Identification of senescent cell surface targetable protein DPP4. Genes and Development. 31 (15), 1529-1534 (2017).
- Flor, A. C., Kron, S. J. Lipid-derived reactive aldehydes link oxidative stress to cell senescence. Cell Death Discovery. 7 (9), 2366 (2016).
- Jochems, F., et al. The Cancer SENESCopedia: A delineation of cancer cell senescence. Cell reports. 36 (4), 109441 (2021).
- Fallah, M., et al. Doxorubicin and liposomal doxorubicin induce senescence by enhancing nuclear factor kappa B and mitochondrial membrane potential. Life Sciences. 232, 116677 (2019).
- Kasper, M., Barth, K. Bleomycin and its role in inducing apoptosis and senescence in lung cells – modulating effects of caveolin-1. Current Cancer Drug Targets. 9 (3), 341-353 (2009).
- Muthuramalingam, K., Cho, M., Kim, Y. Cellular senescence and EMT crosstalk in bleomycin-induced pathogenesis of pulmonary fibrosis-an in vitro analysis. Cell Biology International. 44 (2), 477-487 (2020).
- Flor, A. C., Wolfgeher, D., Wu, D., Kron, S. J. A signature of enhanced lipid metabolism, lipid peroxidation and aldehyde stress in therapy-induced senescence. Cell Death Discovery. 3, 17075 (2017).
- Burd, C. E., et al. Monitoring tumorigenesis and senescence in vivo with a p16(INK4a)-luciferase model. Cell. 152 (1-2), 340-351 (2013).
- Liu, J. Y., et al. Cells exhibiting strong p16 (INK4a) promoter activation in vivo display features of senescence. Proceedings of the National Academy of Sciences of the United States of America. 116 (7), 2603-2611 (2019).
- Wang, L., Lankhorst, L., Bernards, R. Exploiting senescence for the treatment of cancer. Nature Reviews Cancer. 22 (6), 340-355 (2022).
- Baek, K. -. H., Ryeom, S. Detection of oncogene-induced senescence in vivo. Methods in Molecular Biology. 1534, 185-198 (2017).
- González-Gualda, E., Baker, A. G., Fruk, L., Muñoz-Espín, D. A guide to assessing cellular senescence in vitro and in vivo. The FEBS Journal. 288 (1), 56-80 (2021).

