وضع أقطاب تحفيز خارج الجمجمة وقياس تدفق الدم الدماغي والمجالات الكهربائية داخل الجمجمة في الفئران المخدرة
Summary
وصفنا بروتوكولا لتقييم منحنيات الاستجابة للجرعة للتحفيز خارج الجمجمة من حيث قياسات المجال الكهربائي للدماغ وتدفق الدم الدماغي ذي الصلة. نظرا لأن هذا البروتوكول يتضمن وضع قطب كهربائي غازي في الدماغ ، فهناك حاجة إلى تخدير عام ، مع تفضيل التنفس التلقائي بدلا من التنفس المتحكم فيه.
Abstract
يعد الكشف عن استجابات تدفق الدم الدماغي (CBF) لأشكال مختلفة من التنشيط العصبي أمرا بالغ الأهمية لفهم وظيفة الدماغ الديناميكية والاختلافات في إمداد الدماغ بالركيزة. تصف هذه الورقة بروتوكولا لقياس استجابات CBF لتحفيز التيار المتردد عبر الجمجمة (tACS). يتم تقدير منحنيات الاستجابة للجرعة من كل من تغير CBF الذي يحدث مع tACS (mA) ومن المجال الكهربائي داخل الجمجمة (mV / mm). نحن نقدر المجال الكهربائي داخل الجمجمة بناء على السعات المختلفة التي تقاس بواسطة الأقطاب الزجاجية الدقيقة داخل كل جانب من جوانب الدماغ. في هذه الورقة ، نصف الإعداد التجريبي ، والذي يتضمن استخدام مجسات دوبلر بالليزر الثنائية (LD) أو تصوير البقع بالليزر (LSI) لقياس CBF. نتيجة لذلك ، يتطلب هذا الإعداد تخديرا لوضع القطب واستقراره. نقدم علاقة بين استجابة CBF والتيار كدالة للعمر ، مما يدل على استجابة أكبر بكثير في التيارات الأعلى (1.5 مللي أمبير و 2.0 مللي أمبير) في الضابطة الصغيرة (12-14 أسبوعا) مقارنة بالحيوانات الأكبر سنا (28-32 أسبوعا) (p < 0.005 فرق). نظهر أيضا استجابة كبيرة ل CBF عند شدة المجال الكهربائي <5 مللي فولت / مم ، وهو اعتبار مهم للدراسات البشرية النهائية. تتأثر استجابات CBF هذه أيضا بشدة باستخدام التخدير مقارنة بالحيوانات المستيقظة ، والتحكم في التنفس (أي التنبيب مقابل التنفس التلقائي) ، والعوامل الجهازية (أي CO2) ، والتوصيل الموضعي داخل الأوعية الدموية ، والذي يتم بوساطة الخلايا المحيطة والخلايا البطانية. وبالمثل ، قد تحد تقنيات التصوير / التسجيل الأكثر تفصيلا من حجم المجال من الدماغ بأكمله إلى منطقة صغيرة فقط. نصف استخدام الأقطاب الكهربائية خارج الجمجمة لتطبيق تحفيز tACS ، بما في ذلك تصميمات الأقطاب الكهربائية محلية الصنع والتجارية للقوارض ، والقياس المتزامن ل CBF والمجال الكهربائي داخل الجمجمة باستخدام أقطاب تسجيل DC الزجاجية الثنائية ، وطرق التصوير. نحن نطبق حاليا هذه التقنيات لتنفيذ تنسيق الحلقة المغلقة لزيادة CBF في النماذج الحيوانية لمرض الزهايمر والسكتة الدماغية.
Introduction
التحفيز الكهربائي عبر الجمجمة (tES ؛ مع تحفيز الموجات الجيبية ، tACS) هو نهج شائع وخارجي وغير جراحي للتعديل العصبي للدماغ 1,2. في السابق ، افترضنا أنه في جرعات معينة ، قد يزيد tES (وخاصة tACS) من تدفق الدم الدماغي (CBF) في مناطق الدماغ الأساسية3. علاوة على ذلك ، قد توجد علاقة بين الجرعة والاستجابة بين التيار الخارجي المطبق أو المجال الكهربائي داخل الجمجمة واستجابات CBF الناتجة. ومع ذلك ، فقد ركزت معظم بروتوكولات التحفيز السريري على أقصى مستوى مريح للبشرة من التحفيز (أي ~ 2 مللي أمبير) لفترات زمنية محددة (أي 30-45 دقيقة) كبروتوكول علاج 4,5. في القوارض ، من الممكن استخدام أقطاب دماغية غازية خارج الجمجمة يتم تطبيقها مباشرة على الجمجمة للتحقيق في المجالات الكهربائية في الدماغ التي يسببها tES6. ومن ثم، فإن الهدف من هذا النهج هو تحديد آثار شدة الترددات المضادة للمركبات عند الترددات ذات الصلة على تغيرات معامل الاستخلاص المتردد من حيث العلاقة بين الجرعة والاستجابة. يعتمد منحنى الاستجابة للجرعة هذا على قياسات مباشرة للعلامات الحيوية الفسيولوجية قصيرة المدى ل CBF فيما يتعلق بالمجال الكهربائي المفروض على الدماغ3. لقد أظهرنا سابقا أنه ، في السعات الأكبر ، عادة خارج نطاق المجالات الكهربائية داخل الدماغ التي يسببها tACS سريريا ، هناك علاقة شبه خطية بين المجال الكهربائي المستحث و CBF في القشرة3. ومع ذلك ، قد يكون التحفيز في المجال الأصغر (أي شدة 1-5 مللي فولت / مم) أكثر ملاءمة وجدوى للاستخدام في البشر. ومن ثم ، قمنا بتعديل تقنياتنا للكشف عن تغييرات CBF الأصغر.
تصف هذه الورقة بروتوكولا لتحليل تأثيرات التيارات الجيبية المتناوبة لشدة المجال السفلي tES (tACS) على CBF (أي تيار 0.5-2.0 مللي أمبير ، مجال كهربائي 1-5 مللي فولت / مم) ، والتي يمكن تحملها بواسطة القوارض المستيقظة5. يتضمن هذا البروتوكول استخدام تصوير بقع ليزر جديد أثناء tACS ، بالإضافة إلى أقطاب زجاجية مزدوجة داخل الجمجمة ، لتحديد كل من انتشار tACS النشط داخل الدماغ (كما يراقبه CBF) وشدة المجال الكهربائي داخل الجمجمة ، والتي تظهر كرسم تخطيطي وصورة تجريبية فعلية (الشكل 1). هناك العديد من الآثار الفسيولوجية المحتملة ل tES داخل الدماغ ، بما في ذلك التعديل العصبي المباشر ، واللدونة العصبية ، وتنشيط الخلايا النجمية 7,8. على الرغم من قياس CBF باستخدام tDCS 9,10 ، إلا أن هذه القياسات كانت بطيئة وغير مباشرة وغير كافية لتقييم وظيفة الاستجابة للجرعة في الدماغ. لذلك ، باستخدام المؤشرات الحيوية المناسبة قصيرة المدى (أي CBF ، المجالات الكهربائية) وتسلسل التشغيل / الإيقاف السريع ل tACS ، يمكننا الآن تقدير وظيفة الاستجابة للجرعة بشكل أكثر دقة. علاوة على ذلك ، يمكننا تطبيق تقنيات مختلفة لقياس CBF ، بما في ذلك كل من مجسات دوبلر بالليزر البؤرية (LD) وتصوير البقع بالليزر (LSI) مع مناطق اهتمام محددة.
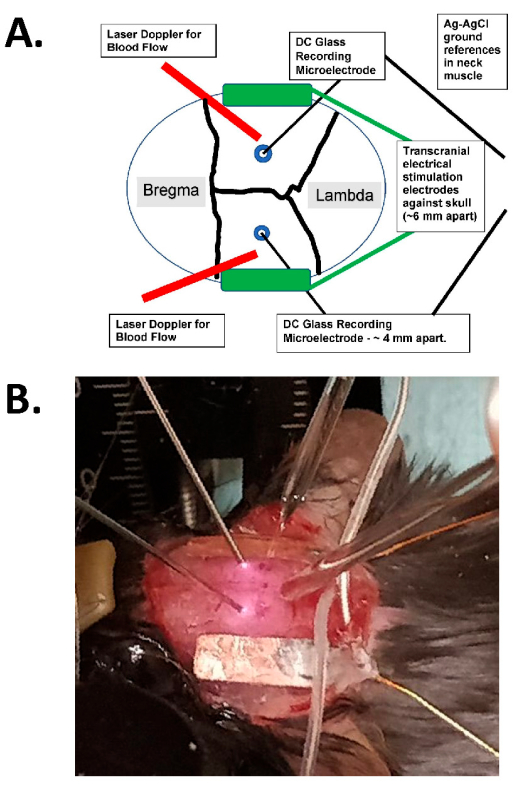
الشكل 1: مخطط التحفيز عبر الجمجمة ومثال فوتوغرافي. أ: رسم تخطيطي لإعداد التحفيز عبر الجمجمة. يوضح الشكل جمجمة فأر بها خيوط إكليلية وسهمية. يتم وضع الأقطاب الكهربائية عبر الجمجمة بشكل جانبي ومتماثل على الجمجمة ويتم تركيبها بالغراء الجراحي ومعجون موصل بين الأقطاب الكهربائية والجمجمة. يتم توصيل هذه الأقطاب بجهاز تحفيز تيار ثابت متوافق مع الإنسان ، والذي يمكنه تحديد تردد التحفيز وسعته ومدته. لتقييم المجالات الكهربائية داخل الجمجمة ، يتم وضع أقطاب زجاجية ثنائية (~ 2 MΩ) في القشرة الدماغية (أي في غضون 1 مم من الجانب الداخلي للجمجمة من خلال ثقوب لدغ صغيرة) ، ويتم إغلاقها بالزيت المعدني ولها أسباب AgCl في عضلة الرقبة (كما هو موضح كأسلاك أكبر في المركز مدفونة في أنسجة الرقبة تحت الجلد). يتم توصيل هذه الأقطاب الزجاجية بمكبر للتيار المستمر ، ويتم تسجيل مخرجاتها من خلال محول رقمي بأربع قنوات على الأقل. كما يتم وضع مجسات دوبلر بالليزر الثنائية على الجمجمة للتسجيلات. يتم تصوير الجمجمة بأكملها أيضا إما بجهاز تصوير بقع الليزر أو كاميرا مبردة عالية الدقة (على الأقل 1024 × 1024 بكسل ، عمق 12-14 بت بكسل) للكشف عن الإشارة الضوئية الجوهرية. عادة ما يتم اختيار تردد الهيموغلوبين متساوي البستيست (أي 562 نانومتر) للإضاءة لتصوير تدفق الدم. (ب) صورة مقربة لتجربة فعلية ، تظهر مجسات دوبلر الليزرية الثنائية (إلى اليسار) ، والأقطاب الدقيقة (الثنائية) داخل الجمجمة التي تسجل الأقطاب الدقيقة الموضوعة من خلال ثقوب الأزيز ، ومع تحفيز الأقطاب الكهربائية tACS بشكل جانبي. اختصار: tACS = تحفيز التيار المتناوب عبر الجمجمة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
كطريقة لتقييم الآليات ، يمكننا أيضا استجواب التفاعلات مع العمليات الفسيولوجية الأخرى التي تغير أيضا CBF ، مثل إزالة الاستقطاب الناجم عن الانتشار K + 11. علاوة على ذلك ، بدلا من الجلسات المجدولة في أوقات منتظمة ، من الممكن أيضا تطوير نظام حلقة مغلقة يعتمد على مؤشرات حيوية إضافية لمجموعة متنوعة من الأمراض ، كما تم اقتراحه لعلاج الصرع12 (أي أجهزة Neuropace السريرية). على سبيل المثال ، يعتمد تحفيز الدماغ ذو الحلقة المغلقة لمرض باركنسون عادة على إمكانات المجال المحلي الجوهرية غير الطبيعية (LFPs) الجوهرية لهذا المرض في حالة عدم وجود الدوبامين الكافي (عادة LFPs β النطاق) 13.
Protocol
Representative Results
Discussion
يركز هذا البروتوكول على القياس المخدر في الجسم الحي لاستجابة CBF كعلامة حيوية لتقدير استجابة الدماغ ل tES14. تشمل المؤشرات الحيوية طويلة المدى لاستجابة tES تأثيرات العلاج النسيجي ، مثل الوقاية أو التغيرات في تكوين لوحة الأميلويد (أي مع تحفيز جاما عند 40 هرتز في العديد من نماذج …
Disclosures
The authors have nothing to disclose.
Acknowledgements
تم دعم هذه الدراسة من خلال المنح التالية (إلى D.A.T.): NIA RO1 AG074999 و NIA R21AG051103 و VA I21RX002223 و VA I21 BX003023.
Materials
| Alcohol pads | HenryShein | 112-6131 | |
| Baby mineral oil | Johnson & Johnson | ||
| BD 1 mL syringe | Becton Dikinson | REF 305699 | |
| C3 Flat Surface Electrodes | Neuronexus | ||
| C57BI mice | from NIH colonies | ||
| Copper skull electrods | In house preparation | ||
| Digidata 1440, Clampex | Axon Instruments | ||
| Dumont #5 forceps | FST | #5 | |
| Dumont #7 forceps curved | Dumont | RS-5047 | |
| Eye ointment | Major | LubiFresh P.M. NDC-0904-6488-38 | |
| Flaming/Brown micropipette puller | Sutter instrument Co. | Model P-87 | |
| Forceps 11.5 cm slight curve serrated | Roboz | RS-8254 | |
| Intramedic needle 23 G | Becton Dikinson | REF 427565 | |
| KCl 1 M | In house preparation | ||
| Laser Doppler Probes | Moor Instruments | 0.46 mm laser doppler probes | |
| Laser Speckle Imaging Device | RWD | RFLSI-ZW | |
| Micro curette 13 cm | FST | 10080-05 | |
| Micro Dissecting Scissors, 11.5 cm | Roboz | RS-5914 | |
| Mouse anesthesia fixation | Stoelting | ||
| Neuroconn-DS | Neurocare | DC-Stimulator Plus | |
| PhysioSuite Monitoring | Kent Scientific | ||
| Q-tips | Fisherbrand | 22363167 | |
| Saline 0.9% NaCl solution | Baxter | 281322 | |
| Sensicam QE | PCO Instruments | ||
| Software | Axon Instruments Clampex | ||
| Surgical glue | Covetrus | 31477 | |
| Surgical tape | 3M Transpore | T9784 |
References
- Bestmann, S., Walsh, V. Transcranial electrical stimulation. Current Biology. 27 (23), R1258-R1262 (2017).
- Bikson, M., et al. Rigor and reproducibility in research with transcranial electrical stimulation: An NIMH-sponsored workshop. Brain Stimulation. 11 (3), 465-480 (2018).
- Turner, D. A., Degan, S., Galeffi, F., Schmidt, S., Peterchev, A. V. Rapid, dose-dependent enhancement of cerebral blood flow by transcranial AC stimulation in mouse. Brain Stimulation. 14 (1), 80-87 (2020).
- Shah, S., Chhatbar, P. Y., Feld, J. A., Feng, W. Integrating tDCS into routine inpatient rehabilitation practice to boost post-stroke recovery. Brain Stimulation. 13 (4), 953-954 (2020).
- Voroslakos, M., et al. Direct effects of transcranial electric stimulation on brain circuits in rats and humans. Nature Communications. 9 (1), 483 (2018).
- Alekseichuk, I., Mantell, K., Shirinpour, S., Opitz, A. Comparative modeling of transcranial magnetic and electric stimulation in mouse, monkey, and human. Neuroimage. 194, 136-148 (2019).
- Tavakoli, A. V., Yun, K. Transcranial alternating current stimulation (tACS) mechanisms and protocols. Frontiers in Cellular Neuroscience. 11, 214 (2017).
- Yavari, F., Jamil, A., Mosayebi Samani, M., Vidor, L. P., Nitsche, M. A. Basic and functional effects of transcranial electrical stimulation (tES)-An introduction. Neuroscience and Biobehavioral Reviews. 85, 81-92 (2018).
- Wachter, D., et al. Transcranial direct current stimulation induces polarity-specific changes of cortical blood perfusion in the rat. Experimental Neurology. 227 (2), 322-327 (2011).
- Han, C. H., et al. Hemodynamic responses in rat brain during transcranial direct current stimulation: A functional near-infrared spectroscopy study. Biomedical Optics Express. 5 (6), 1812-1821 (2014).
- Ayata, C., Lauritzen, M. Spreading depression, spreading depolarizations, and the cerebral vasculature. Physiological Reviews. 95 (3), 953-993 (2015).
- Berenyi, A., Belluscio, M., Mao, D., Buzsaki, G. Closed-loop control of epilepsy by transcranial electrical stimulation. Science. 337 (6095), 735-737 (2012).
- Hoang, K. B., Cassar, I. R., Grill, W. M., Turner, D. A. Biomarkers and stimulation algorithms for adaptive brain stimulation. Frontiers in Neuroscience. 11, 564 (2017).
- Turner, D., A, D. S., Hoffmann, U., Galleffi, F., Colton, C. A. CVN-AD Alzheimer’s mice show premature reduction in neurovascular coupling in response to spreading depression and anoxia compared to aged controls. Alzheimer’s and Dementia. 17 (7), 1109-1120 (2021).
- Colton, C. A., et al. mNos2 deletion and human NOS2 replacement in Alzheimer disease models. Journal of Neuropathology and Experimental Neurology. 73 (8), 752-769 (2014).
- Castano-Prat, P., et al. Altered slow (<1 Hz) and fast (beta and gamma) neocortical oscillations in the 3xTg-AD mouse model of Alzheimer’s disease under anesthesia. Neurobiology of Aging. 79, 142-151 (2019).
- Etter, G., et al. Optogenetic gamma stimulation rescues memory impairments in an Alzheimer’s disease mouse model. Nature Communications. 10 (1), 5322 (2019).
- Iaccarino, H. F., et al. Gamma frequency entrainment attenuates amyloid load and modifies microglia. Nature. 540 (7632), 230-235 (2016).
- Martorell, A. J., et al. Multi-sensory gamma stimulation ameliorates Alzheimer’s-associated pathology and improves cognition. Cell. 177 (2), 256-271 (2019).
- Dawson, J., et al. Vagus nerve stimulation paired with rehabilitation for upper limb motor function after ischaemic stroke (VNS-REHAB): A randomised, blinded, pivotal, device trial. Lancet. 397 (10284), 1545-1553 (2021).
- Hacker, M. L., et al. Deep brain stimulation in early-stage Parkinson disease: Five-year outcomes. Neurology. 95 (4), e393-e401 (2020).
- Duun-Henriksen, J., et al. A new era in electroencephalographic monitoring? Subscalp devices for ultra-long-term recordings. Epilepsia. 61 (9), 1805-1817 (2020).
- Haneef, Z., et al. Sub-scalp electroencephalography: A next-generation technique to study human neurophysiology. Clinical Neurophysiology. 141, 77-87 (2022).

