Colocação de eletrodos estimuladores extracranianos e mensuração do fluxo sanguíneo cerebral e campos elétricos intracranianos em camundongos anestesiados
Summary
Descrevemos um protocolo para avaliação de curvas dose-resposta para estimulação extracraniana em termos de medidas de campo elétrico cerebral e um biomarcador relevante de fluxo sanguíneo cerebral. Como esse protocolo envolve a colocação invasiva de eletrodos no cérebro, a anestesia geral é necessária, com respiração espontânea preferida em vez de respiração controlada.
Abstract
A detecção de respostas do fluxo sanguíneo cerebral (FSC) a várias formas de ativação neuronal é crítica para a compreensão da função cerebral dinâmica e das variações no fornecimento de substrato para o cérebro. Este trabalho descreve um protocolo para medir as respostas do FSC à estimulação transcraniana por corrente alternada (tACS). As curvas dose-resposta são estimadas tanto a partir da alteração do FSC ocorrida com a tACS (mA) quanto do campo elétrico intracraniano (mV/mm). Estimamos o campo elétrico intracraniano com base nas diferentes amplitudes medidas por microeletrodos de vidro dentro de cada lado do cérebro. Neste trabalho, descrevemos o arranjo experimental, que envolve o uso de sondas bilaterais com laser Doppler (LD) ou laser speckle imaging (LSI) para medir o FSC; Como resultado, essa configuração requer anestesia para a colocação e estabilidade do eletrodo. Apresentamos uma correlação entre a resposta do FSC e a corrente em função da idade, mostrando uma resposta significativamente maior em correntes mais altas (1,5 mA e 2,0 mA) em animais controles jovens (12-14 semanas) em comparação com animais mais velhos (28-32 semanas) (p < diferença de 0,005). Também demonstramos uma resposta significativa do FSC em intensidades de campo elétrico <5 mV/mm, o que é uma consideração importante para estudos em humanos eventuais. Essas respostas do FSC também são fortemente influenciadas pelo uso de anestesia em comparação com animais acordados, pelo controle da respiração (i.e., respiração intubada vs. espontânea), fatores sistêmicos (i.e., CO2) e condução local dentro dos vasos sanguíneos, que é mediada por pericitos e células endoteliais. Da mesma forma, técnicas de imagem/gravação mais detalhadas podem limitar o tamanho do campo de todo o cérebro a apenas uma pequena região. Descrevemos o uso de eletrodos extracranianos para a aplicação da estimulação tACS, incluindo desenhos de eletrodos caseiros e comerciais para roedores, a medição concomitante do FSC e do campo elétrico intracraniano usando eletrodos de gravação DC de vidro bilateral e as abordagens de imagem. Atualmente, estamos aplicando essas técnicas para implementar um formato de circuito fechado para aumentar a FBC em modelos animais de doença de Alzheimer e acidente vascular cerebral.
Introduction
A estimulação elétrica transcraniana (tES; com estimulação por onda senoidal, tACS) é uma abordagem comum, externa e não invasiva da neuromodulação cerebral 1,2. Previamente, levantamos a hipótese de que, em determinadas doses, a tES (e particularmente a tACS) poderia aumentar o fluxo sanguíneo cerebral (FSC) nas regiões cerebraissubjacentes 3. Além disso, pode existir uma relação dose-resposta entre a corrente externa aplicada ou o campo elétrico intracraniano e as respostas resultantes do FSC. No entanto, a maioria dos protocolos de estimulação clínica tem focado em um nível máximo de estimulação confortável da pele (i.e., ~ 2 mA) por períodos de tempo programados (i.e., 30-45 min) como um protocolo de tratamento 4,5. Em roedores, é possível utilizar eletrodos cerebrais extracranianos invasivos aplicados diretamente no crânio para investigar os campos elétricos no cérebro induzidos pelaEET6. Assim, o objetivo desta abordagem é determinar os efeitos da intensidade da tACS em frequências relevantes sobre as mudanças do FSC em termos da relação dose-resposta. Essa curva dose-resposta baseia-se em um biomarcador fisiológico de curto prazo – medidas diretas do FSC – em relação ao campo elétrico imposto ao cérebro3. Mostramos anteriormente que, em amplitudes maiores, tipicamente além da faixa de campos elétricos dentro do cérebro induzidos clinicamente pela tACS, existe uma correlação quase linear entre o campo elétrico induzido e o FSC no córtex3. No entanto, a estimulação de campo menor (ou seja, intensidade de 1-5 mV/mm) pode ser mais relevante e viável para uso em humanos; portanto, modificamos nossas técnicas para detectar alterações menores no FSC.
Este trabalho descreve um protocolo para analisar os efeitos das correntes senoidais alternadas de tES de menor intensidade de campo (tACS) sobre o FSC (isto é, corrente de 0,5-2,0 mA, campo elétrico de 1-5 mV/mm), que pode ser tolerado por roedores acordados5. Esse protocolo envolve o uso de novas imagens de laser speckle durante a tACS, bem como eletrodos de vidro intracraniano duplos, para determinar tanto a disseminação de tACS ativa dentro do cérebro (como monitorado pelo FSC) quanto a intensidade do campo elétrico intracraniano, que é mostrado tanto como um diagrama quanto como uma fotografia experimental real (Figura 1). Existem muitos efeitos fisiológicos possíveis da EETt no cérebro, incluindo modulação neuronal direta, plasticidade neural e ativação de astrócitos 7,8. Embora o FSC tenha sido medido com ETCC 9,10, essas medidas foram lentas, indiretas e insuficientes para avaliar a função dose-resposta no cérebro. Portanto, usando biomarcadores apropriados de curto prazo (i.e., FSC, campos elétricos) e sequências rápidas de liga/desliga de tACS, podemos agora estimar a função dose-resposta com mais precisão. Além disso, podemos aplicar diferentes técnicas para medir o FSC, incluindo sondas focais laser Doppler (LD) e laser speckle imaging (LSI) com regiões de interesse definidas.
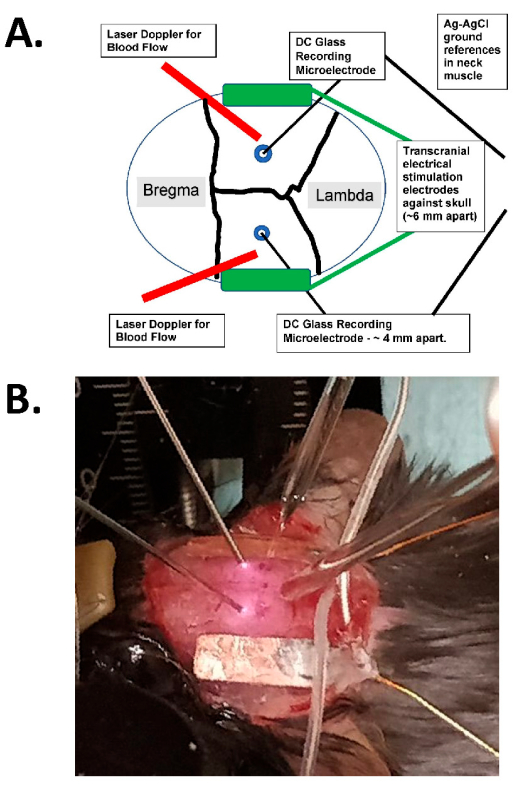
Figura 1: Diagrama de estimulação transcraniana e exemplo fotográfico. (A) Diagrama do setup da estimulação transcraniana. O diagrama mostra um crânio de camundongo com pontos coronais e sagitais. Os eletrodos transcranianos são colocados lateral e simetricamente sobre o crânio e são montados com cola cirúrgica e pasta condutora entre os eletrodos e o crânio. Esses eletrodos são conectados a um dispositivo de estimulação de corrente constante compatível com humanos, que pode especificar a frequência, amplitude e duração da estimulação. Para a avaliação dos campos elétricos intracranianos, eletrodos de vidro bilaterais (~2 MΩ) são colocados no córtex cerebral (ou seja, dentro de 1 mm da face interna do crânio através de pequenos orifícios de rebarba), e estes são selados com óleo mineral e têm base de AgCl no músculo do pescoço (mostrados como fios maiores no centro enterrados no tecido cervical subcutâneo). Estes eletrodos de vidro são conectados a um amplificador DC, e suas saídas são gravadas através de um digitalizador com pelo menos quatro canais. Sondas laser Doppler bilaterais também são colocadas no crânio para registros. Todo o crânio também é fotografado com um dispositivo de imagem a laser speckle ou uma câmera resfriada de alta resolução (pelo menos 1.024 x 1.024 pixels, 12-14 bits de profundidade de pixel) para detecção de sinal óptico intrínseco. A frequência isosbestic da hemoglobina é tipicamente escolhida (isto é, 562 nm) para iluminação para imagens do fluxo sanguíneo. (B) Imagem em close-up de um experimento real, mostrando as sondas laser Doppler bilaterais (à esquerda), os microeletrodos de gravação de vidro intracraniano (bilateral) colocados através dos orifícios da broca e com os eletrodos estimuladores de tACS lateralmente. Abreviação: tACS = estimulação transcraniana por corrente alternada. Clique aqui para ver uma versão maior desta figura.
Como forma de avaliar os mecanismos, também podemos interrogar interações com outros processos fisiológicos que também alteram o FSC, como a despolarização disseminada induzida por K+11. Além disso, em vez de sessões agendadas em horários regulares, também é possível desenvolver um sistema de circuito fechado baseado em biomarcadores adicionais para uma variedade de doenças, como tem sido proposto para o tratamento da epilepsia12 (i.e., dispositivos clínicos Neuropace). Por exemplo, a estimulação cerebral em circuito fechado para a doença de Parkinson é comumente baseada nos potenciais de campo local (LFPs) intrínsecos e anormais intrínsecos a essa doença na ausência de dopamina suficiente (tipicamente LFPs de banda β)13.
Protocol
Representative Results
Discussion
Este protocolo concentra-se na medida in vivo e anestesiada da resposta do FSC como um biomarcador para estimar a resposta cerebral à tES14. Biomarcadores de longo prazo da resposta à tES incluem efeitos histológicos do tratamento, como a prevenção ou alterações na formação de placa amiloide (isto é, com estimulação gama a 40 Hz em vários modelos de DA)16,17,18,19,<…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este estudo foi apoiado pelos seguintes subsídios (para D.A.T.): NIA RO1 AG074999, NIA R21AG051103, VA I21RX002223 e VA I21 BX003023.
Materials
| Alcohol pads | HenryShein | 112-6131 | |
| Baby mineral oil | Johnson & Johnson | ||
| BD 1 mL syringe | Becton Dikinson | REF 305699 | |
| C3 Flat Surface Electrodes | Neuronexus | ||
| C57BI mice | from NIH colonies | ||
| Copper skull electrods | In house preparation | ||
| Digidata 1440, Clampex | Axon Instruments | ||
| Dumont #5 forceps | FST | #5 | |
| Dumont #7 forceps curved | Dumont | RS-5047 | |
| Eye ointment | Major | LubiFresh P.M. NDC-0904-6488-38 | |
| Flaming/Brown micropipette puller | Sutter instrument Co. | Model P-87 | |
| Forceps 11.5 cm slight curve serrated | Roboz | RS-8254 | |
| Intramedic needle 23 G | Becton Dikinson | REF 427565 | |
| KCl 1 M | In house preparation | ||
| Laser Doppler Probes | Moor Instruments | 0.46 mm laser doppler probes | |
| Laser Speckle Imaging Device | RWD | RFLSI-ZW | |
| Micro curette 13 cm | FST | 10080-05 | |
| Micro Dissecting Scissors, 11.5 cm | Roboz | RS-5914 | |
| Mouse anesthesia fixation | Stoelting | ||
| Neuroconn-DS | Neurocare | DC-Stimulator Plus | |
| PhysioSuite Monitoring | Kent Scientific | ||
| Q-tips | Fisherbrand | 22363167 | |
| Saline 0.9% NaCl solution | Baxter | 281322 | |
| Sensicam QE | PCO Instruments | ||
| Software | Axon Instruments Clampex | ||
| Surgical glue | Covetrus | 31477 | |
| Surgical tape | 3M Transpore | T9784 |
References
- Bestmann, S., Walsh, V. Transcranial electrical stimulation. Current Biology. 27 (23), R1258-R1262 (2017).
- Bikson, M., et al. Rigor and reproducibility in research with transcranial electrical stimulation: An NIMH-sponsored workshop. Brain Stimulation. 11 (3), 465-480 (2018).
- Turner, D. A., Degan, S., Galeffi, F., Schmidt, S., Peterchev, A. V. Rapid, dose-dependent enhancement of cerebral blood flow by transcranial AC stimulation in mouse. Brain Stimulation. 14 (1), 80-87 (2020).
- Shah, S., Chhatbar, P. Y., Feld, J. A., Feng, W. Integrating tDCS into routine inpatient rehabilitation practice to boost post-stroke recovery. Brain Stimulation. 13 (4), 953-954 (2020).
- Voroslakos, M., et al. Direct effects of transcranial electric stimulation on brain circuits in rats and humans. Nature Communications. 9 (1), 483 (2018).
- Alekseichuk, I., Mantell, K., Shirinpour, S., Opitz, A. Comparative modeling of transcranial magnetic and electric stimulation in mouse, monkey, and human. Neuroimage. 194, 136-148 (2019).
- Tavakoli, A. V., Yun, K. Transcranial alternating current stimulation (tACS) mechanisms and protocols. Frontiers in Cellular Neuroscience. 11, 214 (2017).
- Yavari, F., Jamil, A., Mosayebi Samani, M., Vidor, L. P., Nitsche, M. A. Basic and functional effects of transcranial electrical stimulation (tES)-An introduction. Neuroscience and Biobehavioral Reviews. 85, 81-92 (2018).
- Wachter, D., et al. Transcranial direct current stimulation induces polarity-specific changes of cortical blood perfusion in the rat. Experimental Neurology. 227 (2), 322-327 (2011).
- Han, C. H., et al. Hemodynamic responses in rat brain during transcranial direct current stimulation: A functional near-infrared spectroscopy study. Biomedical Optics Express. 5 (6), 1812-1821 (2014).
- Ayata, C., Lauritzen, M. Spreading depression, spreading depolarizations, and the cerebral vasculature. Physiological Reviews. 95 (3), 953-993 (2015).
- Berenyi, A., Belluscio, M., Mao, D., Buzsaki, G. Closed-loop control of epilepsy by transcranial electrical stimulation. Science. 337 (6095), 735-737 (2012).
- Hoang, K. B., Cassar, I. R., Grill, W. M., Turner, D. A. Biomarkers and stimulation algorithms for adaptive brain stimulation. Frontiers in Neuroscience. 11, 564 (2017).
- Turner, D., A, D. S., Hoffmann, U., Galleffi, F., Colton, C. A. CVN-AD Alzheimer’s mice show premature reduction in neurovascular coupling in response to spreading depression and anoxia compared to aged controls. Alzheimer’s and Dementia. 17 (7), 1109-1120 (2021).
- Colton, C. A., et al. mNos2 deletion and human NOS2 replacement in Alzheimer disease models. Journal of Neuropathology and Experimental Neurology. 73 (8), 752-769 (2014).
- Castano-Prat, P., et al. Altered slow (<1 Hz) and fast (beta and gamma) neocortical oscillations in the 3xTg-AD mouse model of Alzheimer’s disease under anesthesia. Neurobiology of Aging. 79, 142-151 (2019).
- Etter, G., et al. Optogenetic gamma stimulation rescues memory impairments in an Alzheimer’s disease mouse model. Nature Communications. 10 (1), 5322 (2019).
- Iaccarino, H. F., et al. Gamma frequency entrainment attenuates amyloid load and modifies microglia. Nature. 540 (7632), 230-235 (2016).
- Martorell, A. J., et al. Multi-sensory gamma stimulation ameliorates Alzheimer’s-associated pathology and improves cognition. Cell. 177 (2), 256-271 (2019).
- Dawson, J., et al. Vagus nerve stimulation paired with rehabilitation for upper limb motor function after ischaemic stroke (VNS-REHAB): A randomised, blinded, pivotal, device trial. Lancet. 397 (10284), 1545-1553 (2021).
- Hacker, M. L., et al. Deep brain stimulation in early-stage Parkinson disease: Five-year outcomes. Neurology. 95 (4), e393-e401 (2020).
- Duun-Henriksen, J., et al. A new era in electroencephalographic monitoring? Subscalp devices for ultra-long-term recordings. Epilepsia. 61 (9), 1805-1817 (2020).
- Haneef, Z., et al. Sub-scalp electroencephalography: A next-generation technique to study human neurophysiology. Clinical Neurophysiology. 141, 77-87 (2022).

