In vitro Chemisch in kaart brengen van G-quadruplex DNA-structuren door Bis-3-Chloropiperidines
Summary
Bis-3-chloorpiperidines (B-CeP’s) zijn nuttige chemische sondes om G-quadruplex-structuren in DNA-sjablonen in vitro te identificeren en te karakteriseren. Dit protocol beschrijft de procedure voor het uitvoeren van tastende reacties met B-CeP’s en het oplossen van reactieproducten door middel van polyacrylamidegelelektroforese met hoge resolutie.
Abstract
G-quadruplexen (G4’s) zijn biologisch relevante, niet-canonieke DNA-structuren die een belangrijke rol spelen bij genexpressie en ziekten en belangrijke therapeutische doelen vertegenwoordigen. Toegankelijke methoden zijn vereist voor de in vitro karakterisering van DNA binnen potentiële G-quadruplexvormende sequenties (PQS’s). B-CeP’s zijn een klasse van alkylerende middelen die hebben bewezen nuttige chemische sondes te zijn voor onderzoek naar de hogere-orde structuur van nucleïnezuren. Dit artikel beschrijft een nieuwe chemische mapping-test die gebruik maakt van de specifieke reactiviteit van B-CeP’s met de N7van guanines, gevolgd door directe strengsplitsing bij de gealkyleerde G’s.
Namelijk, om G4-vouwen te onderscheiden van ongevouwen DNA-vormen, gebruiken we B-CeP 1 om het trombinebindende aptameer (TBA) te onderzoeken, een 15-mer DNA dat in staat is om de G4-rangschikking aan te nemen. Reactie van B-CeP-reagerende guanines met B-CeP 1 levert producten op die kunnen worden opgelost door polyacrylamidegelelektroforese met hoge resolutie (PAGE) op het niveau van één nucleotide door individuele alkyleringsadducten en DNA-strengsplitsing bij de gealkyleerde guanines te lokaliseren. Het in kaart brengen met behulp van B-CeP’s is een eenvoudig en krachtig hulpmiddel voor de in vitro karakterisering van G-quadruplex-vormende DNA-sequenties, waardoor de precieze locatie van guanines die betrokken zijn bij de vorming van G-tetrads mogelijk wordt.
Introduction
Naast de typische Watson-Crick dubbele helix, kunnen nucleïnezuren verschillende secundaire structuren aannemen, zoals de alternatieve G-quadruplex (G4) vorm, vanwege hun guaninerijke sequenties. De G4-structuur is gebaseerd op de vorming van vlakke tetrameren, G-tetrads genaamd, waarin vier guanines op elkaar inwerken via Hoogsteen-waterstofbruggen. G-tetrads worden gestapeld en verder gestabiliseerd door monovalente kationen die worden gecoördineerd in het midden van de guaninekern (Figuur 1)1.
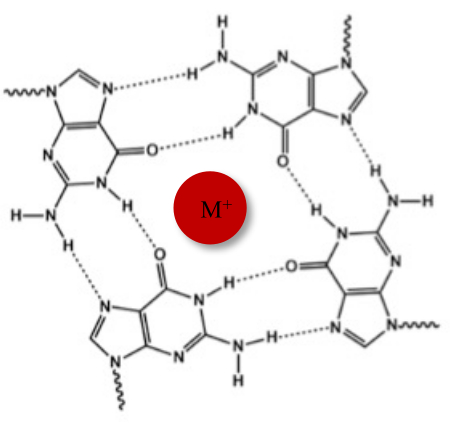
Figuur 1: Schematische weergave van een G-quadruplex structuur. (A) Schematische weergave van een G-tetrad. De vlakke array wordt gestabiliseerd door Hoogsteen basenparen en door een centraal kation (M+). Klik hier om een grotere versie van deze figuur te bekijken.
Sequenties met vier of meer runs van ten minste twee opeenvolgende guaninenucleotiden zijn potentiële G-quadruplex-vormende sequenties (PQS’s) die zich in G-quadruplexstructuren kunnen vouwen. PQS’s bevinden zich in veel verschillende cellulaire contexten, zoals op telomeren, genpromotors, ribosomaal DNA en recombinatieplaatsen, en zijn betrokken bij de regulatie van veel biologische processen. Daarom is de identificatie en experimentele validatie van G4’s in het menselijk genoom, die momenteel voornamelijk wordt uitgevoerd door middel van computationele hulpmiddelen, een biologisch relevante kwestie3. Om computationele voorspellingen te ondersteunen of onvoorspelbare G4-structuren te detecteren, wordt hier een toegankelijke methode getoond op basis van chemische mapping om de G4-formatie in een DNA-sjabloon te identificeren, waardoor de nauwkeurige identificatie van guanines die de G-tetrad-structuur vormen, mogelijk wordt.
De gerapporteerde chemische mapping-test maakt gebruik van de verschillende reactiviteit van bis-3-chloorpiperidines (B-CeP’s) met guanines na de vorming van G4-structuren. Vanwege hun hoge reactiviteit met nucleofielen 4,5,6,7,8,9 zijn B-CeP’s nucleïnezuuralkylerende middelen met het vermogen om zeer efficiënt te reageren met de N 7-positie van guaninenucleotiden10. Alkylering wordt gevolgd door depurinatie en strengsplitsing in enkel- en dubbelstrengs DNA-constructen. Integendeel, guanines die betrokken zijn bij de vorming van de G-tetrads in G4-opstellingen zijn ongevoelig voor B-CeP-alkylering, aangezien de N7-positie van guanines betrokken is bij de Hoogsteen-waterstofbruggen. Deze specifieke reactiviteit van B-CeP’s maakt niet alleen de detectie van G4-structuren mogelijk, maar ook de identificatie van de guanines die de tetrad(s) vormen, zoals ze kunnen worden afgeleid uit hun relatieve bescherming tegen alkylering in vergelijking met guanines in enkel- en dubbelstrengs DNA.
Het chemische mapping-protocol wordt hier gerapporteerd met behulp van B-CeP 1 (Figuur 2A) als een sonde voor de karakterisering van trombine-bindend aptameer (TBA), een 15-mer DNA dat in staat is om de G4-rangschikking aan te nemen in aanwezigheid van kaliumkationen11,12. De G4-opstelling van TBA (G4-TBA) wordt rechtstreeks vergeleken met twee controles, namelijk TBA in de enkelstrengsvorm (ssTBA) en TBA gegloeid tot zijn complementaire sequentie om het dubbelstrengs construct (dsTBA) te vormen (tabel 1). Producten van sonderingsreacties worden opgelost door polyacrylamidegelelektroforese met hoge resolutie (PAGE) op het niveau van één nucleotide door individuele alkyleringsadducten en DNA-strengsplitsing bij de gealkyleerde guanines te lokaliseren. Visualisatie op de gel wordt mogelijk gemaakt door conjugatie van het TBA-oligonucleotide met een fluorofoor aan het 3′-uiteinde (tabel 1). Dit protocol laat zien hoe TBA in zijn verschillende conformaties (G4 en controles) moet worden gevouwen en hoe sonderreacties kunnen worden uitgevoerd met B-CeP’s gevolgd door PAGE.
Protocol
Representative Results
Discussion
G-quadruplexen zijn nucleïnezuur secundaire structuren die zich doorgaans vouwen binnen guaninerijke DNA-sequenties en zijn belangrijke onderzoeksdoelen vanwege hun associatie met genetische controle en ziekten. Chemische kartering door B-CeP’s is een nuttig protocol voor de karakterisering van DNA G4’s, dat kan worden gebruikt om de guaninebasen te identificeren die betrokken zijn bij de vorming van G-tetrads onder fysiologische zoutomstandigheden.
De chemische sonde die in dit protocol word…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dit werk werd ondersteund door het Departement Farmaceutische en Farmacologische Wetenschappen, Universiteit van Padova (PRIDJ-BIRD2019).
Materials
| Acrylamide/bis-acrylamide solution 40% | Applichem | A3658 | R45-46-20/21-25-36/38-43-48/23/ 24/25-62 |
| Ammonium per-sulfate (APS) | Sigma Aldrich | A7460 | |
| Analytical balance | Mettler Toledo | ||
| Autoclave | pbi international | ||
| Boric acid | Sigma Aldrich | B0252 | |
| Bromophenol blue Brilliant blue R | Sigma Aldrich | B0149 | |
| di-Sodium hydrogen phosphate dodecahydrate | Fluka | 71649 | |
| DMSO | Sigma Aldrich | 276855 | |
| DNA oligonucleotides | Integrated DNA Technologies | synthesis of custom sequences | |
| EDTA disodium | Sigma Aldrich | E5134 | |
| Formamide | Fluka | 40248 | H351-360D-373 |
| Gel imager | GE Healtcare | STORM B40 | |
| Glycerol | Sigma Aldrich | G5516 | |
| Micro tubes 0.5 mL | Sarstedt | 72.704 | |
| Potassium Chloride | Sigma Aldrich | P9541 | |
| Sequencing apparatus | Biometra | Model S2 | |
| Silanization solution I | Fluka | 85126 | H225, 314, 318, 336, 304, 400, 410 |
| Sodium phosphate monobasic | Carlo Erba | 480086 | |
| Speedvac concentrator | Thermo Scientific | Savant DNA 120 | |
| TEMED | Fluka | 87689 | R11-21/22-23-34 |
| Tris-HCl | MERCK | 1.08387.2500 | |
| Urea | Sigma Aldrich | 51456 | |
| UV-Vis spectrophotometer | Thermo Scientific | Nanodrop 1000 |
References
- Davis, J. T. G-quartets 40 years later: from 5′-GMP to molecular biology and supramolecular chemistry. Angewandte Chemie. 43 (6), 668-698 (2004).
- Varshney, D., Spiegel, J., Zyner, K., Tannahill, D., Balasubramanian, S. The regulation and functions of DNA and RNA G-quadruplexes. Nature Reviews Molecular Cell Biology. 21 (8), 459-474 (2020).
- Chambers, V. S., et al. High-throughput sequencing of DNA G-quadruplex structures in the human genome. Nature Biotechnology. 33 (8), 877-881 (2015).
- Zuravka, I., Sosic, A., Gatto, B., Gottlich, R. Synthesis and evaluation of a bis-3-chloropiperidine derivative incorporating an anthraquinone pharmacophore. Bioorganic & Medicinal Chemistry Letters. 25 (20), 4606-4609 (2015).
- Zuravka, I., Roesmann, R., Sosic, A., Gottlich, R., Gatto, B. Bis-3-chloropiperidines containing bridging lysine linkers: Influence of side chain structure on DNA alkylating activity. Bioorganic & Medicinal Chemistry. 23 (6), 1241-1250 (2015).
- Zuravka, I., et al. Synthesis and DNA cleavage activity of bis-3-chloropiperidines as alkylating agents. ChemMedChem. 9 (9), 2178-2185 (2014).
- Sosic, A., Gottlich, R., Fabris, D., Gatto, B. B-CePs as cross-linking probes for the investigation of RNA higher-order structure. Nucleic Acids Research. 49 (12), 6660-6672 (2021).
- Sosic, A., et al. Bis-3-chloropiperidines targeting TAR RNA as a novel strategy to impair the HIV-1 nucleocapsid protein. Molecules. 26 (7), 1874 (2021).
- Sosic, A., et al. In vitro evaluation of bis-3-chloropiperidines as RNA modulators targeting TAR and TAR-protein interaction. International Journal of Molecular Sciences. 23 (2), 582 (2022).
- Sosic, A., et al. Direct and topoisomerase II mediated DNA damage by bis-3-chloropiperidines: The importance of being an earnest G. ChemMedChem. 12 (17), 1471-1479 (2017).
- Bock, L. C., Griffin, L. C., Latham, J. A., Vermaas, E. H., Toole, J. J. Selection of single-stranded DNA molecules that bind and inhibit human thrombin. Nature. 355 (6360), 564-566 (1992).
- Paborsky, L. R., McCurdy, S. N., Griffin, L. C., Toole, J. J., Leung, L. L. The single-stranded DNA aptamer-binding site of human thrombin. The Journal of Biological Chemistry. 268 (28), 20808-20811 (1993).
- Carraro, C., et al. Behind the mirror: chirality tunes the reactivity and cytotoxicity of chloropiperidines as potential anticancer agents. ACS Medicinal Chemistry Letters. 10 (4), 552-557 (2019).
- Carraro, C., et al. Appended aromatic moieties in flexible bis-3-chloropiperidines confer tropism against pancreatic cancer cells. ChemMedChem. 16 (5), 860-868 (2021).
- Kypr, J., Kejnovska, I., Renciuk, D., Vorlickova, M. Circular dichroism and conformational polymorphism of DNA. Nucleic Acids Research. 37 (6), 1713-1725 (2009).
- Onel, B., Wu, G., Sun, D., Lin, C., Yang, D. Electrophoretic mobility shift assay and dimethyl sulfate footprinting for characterization of G-quadruplexes and G-quadruplex-protein complexes. Methods in Molecular Biology. 2035, 201-222 (2019).

