Diseño y construcción de un microscopio de fluorescencia de lámina de luz personalizable de un solo objetivo para la visualización de redes de citoesqueletos
Summary
Este protocolo describe en detalle cómo construir un microscopio de fluorescencia de hoja de luz de un solo objetivo y su uso para visualizar redes de citoesqueletos.
Abstract
Los compuestos de citoesqueletos reconstituidos han surgido como un valioso sistema modelo para el estudio de la materia blanda fuera de equilibrio. La captura fiel de la dinámica de estas densas redes 3D requiere el corte óptico, que a menudo se asocia con los microscopios confocales de fluorescencia. Sin embargo, los desarrollos recientes en microscopía de fluorescencia de lámina de luz (LSFM) la han establecido como una alternativa rentable y, a veces, superior. Para que LSFM sea accesible para los investigadores de citoesqueletos menos familiarizados con la óptica, presentamos una guía paso a paso para principiantes sobre la construcción de un microscopio de fluorescencia de lámina de luz versátil a partir de componentes estándar. Para permitir el montaje de muestras con muestras de portaobjetos tradicionales, este LSFM sigue el diseño de hoja de luz de un solo objetivo (SOLS), que utiliza un solo objetivo tanto para la excitación como para la recolección de emisiones. Describimos la función de cada componente del SOLS con suficiente detalle para permitir a los lectores modificar la instrumentación y diseñarla para que se ajuste a sus necesidades específicas. Finalmente, demostramos el uso de este instrumento SOLS personalizado mediante la visualización de ásteres en redes de microtúbulos impulsadas por kinesina.
Introduction
La microscopía de fluorescencia de lámina de luz (LSFM) representa una familia de técnicas de imágenes de fluorescencia de alta resolución en las que la luz de excitación se moldea en una lámina 1,2, incluida la microscopía de iluminación de plano selectivo (SPIM), la excitación plana alineada confocal (SCAPE) y la microscopía de plano oblicuo (OPM)3,4,5,6,7. A diferencia de otras modalidades de microscopía, como la epifluorescencia, la microscopía de fluorescencia de reflexión interna total (TIRFM) o la microscopía confocal, la fototoxicidad es mínima en la LSFM y las muestras se pueden obtener en escalas de tiempo más largas, ya que solo se ilumina el plano de la muestra que se está fotografiando activamente 8,9,10. Por lo tanto, las técnicas LSFM son extremadamente útiles para obtener imágenes de muestras 3D durante períodos de tiempo prolongados, especialmente incluso aquellas demasiado gruesas para las técnicas de microscopía confocal. Debido a estas razones, desde su desarrollo original en 2004, la LSFM se ha convertido en la técnica de imagen elegida por muchos fisiólogos, biólogos del desarrollo y neurocientíficos para la visualización de organismos completos como embriones vivos de pez cebra y Drosophila 3,4,6,11 . En estas últimas dos décadas, las ventajas de la LSFM se han aprovechado para visualizar la estructura y la dinámica a escalas progresivamente más pequeñas, incluyendo las escalas tisulares11,12, celulares y subcelulares, tanto in vivo como in vitro 13,14,15,17.
A pesar de los informes de casos de uso exitosos en la literatura, el alto costo de los sistemas comerciales de LSFM (~0,25 millones de dólares en el momento de escribir este artículo)18,19 impide el uso generalizado de la técnica. Para hacer de las construcciones de bricolaje una alternativa factible para los investigadores, se han publicado múltiples guías de construcción 8,13,20,21, incluido el esfuerzo de acceso abierto OpenSPIM 22. Sin embargo, hasta la fecha, los investigadores con una experiencia mínima en óptica solo pueden utilizar diseños anteriores de LSFM, que son incompatibles con las muestras tradicionales montadas en portaobjetos (Figura 1A). La reciente implementación de un solo objetivo, hoja de luz (SOLS) utiliza un solo objetivo tanto para la excitación como para la detección (Figura 1C), superando así la limitación relacionada con la compatibilidad 5,6,8,13,20. Sin embargo, el costo de la versatilidad del diseño de SOLS es un aumento sustancial en la complejidad de la construcción debido a la necesidad de dos objetivos adicionales para transmitir, desinclinar y volver a crear imágenes del plano del objeto en la cámara para obtener imágenes (Figura 1D). Para facilitar el acceso a las complejas configuraciones de estilo SOLS, este artículo presenta una guía paso a paso sobre el diseño, la construcción, el proceso de alineación y el uso de un sistema SOLS compatible con diapositivas, que sería útil para los investigadores con conocimientos de solo un curso de óptica de nivel básico.
Aunque el protocolo en sí es conciso, los lectores deben consultar otros recursos durante los pasos de preparación para obtener más información sobre partes particulares del diseño o consideraciones de hardware. Sin embargo, si un lector tiene la intención de seguir las especificaciones de este diseño, es posible que no sea necesario comprender cómo seleccionar componentes ópticos particulares.
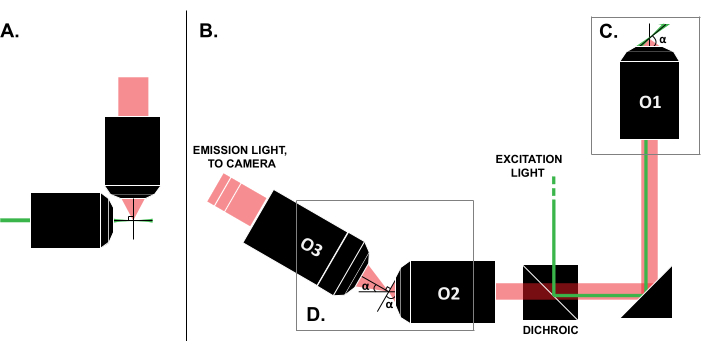
Figura 1: Características de las diferentes configuraciones de LSFM. (A) La configuración con dos objetivos ortogonales comunes en los primeros diseños de LSFM. En esta configuración, se utiliza un tubo capilar o un cilindro de gel para contener la muestra, lo que no es compatible con las técnicas tradicionales de montaje de portaobjetos. (B) Un esquema de un diseño de lámina de luz SOLS que muestre lo siguiente: (C) el objetivo único utilizado para la excitación y la recolección de emisiones en el plano de muestra (O1); esto permite montar una corredera tradicional en la parte superior, y (D) el sistema de objetivo de relé en la ruta de emisión SOLS. El O2 recoge la luz de emisión y desamplía la imagen. O3 toma imágenes del avión con el ángulo de inclinación correcto en el sensor de la cámara. Abreviaturas: LSFM = microscopía de fluorescencia de lámina de luz; SOLS = hoja de luz de un solo objetivo; O1-O3 = objetivos. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
Dos detalles importantes con respecto a este protocolo son el costo total del sistema y el tiempo esperado de construcción y alineación. Aunque el costo exacto es variable, podemos estimar cómodamente que el costo in toto de este SOLS o un sistema de bricolaje similar estaría en el rango de $ 85,000 USD. Observamos que esta estimación tiene en cuenta el precio de venta al público de todos los componentes, por lo que este precio global puede reducirse considerablemente si se obtienen componentes usados. En términos de tiempo de construcción, sería razonable esperar que un usuario con poca experiencia en óptica construya y alinee todo este sistema SOLS en 1-2 meses, siempre que todos los componentes estén disponibles y listos. A pesar de la longitud y complejidad del protocolo, creemos que la cantidad de detalles en el manuscrito escrito, junto con el protocolo de video, debería hacer que este protocolo sea sencillo y rápido de seguir.
Hay dos pasos críticos en este protocolo. En primer lugar, la colocación del galvo determina la colocación de muchas lentes, ya que forma parte de tres pares de lentes 4f separados. Es crucial que el galvo esté conjugado con los planos focales posteriores de O1 y O2 y centrado correctamente para garantizar un escaneo invariante de inclinación. En segundo lugar, la calidad de la imagen es extremadamente sensible a la alineación de O2 y O3 entre sí. Aquí, se debe tener cuidado para garantizar que, en primer lugar, el ángulo de alineación de O3 a O2 coincida con la inclinación de la lámina de luz de excitación, proporcionando así una iluminación plana máxima a través del campo de visión inclinado de manera similar. En segundo lugar, el O3 debe colocarse a la distancia axial correcta para mantener un campo de visión plano con un área lo más grande posible. En tercer lugar, el O3 debe colocarse a la distancia lateral correcta del O2 para maximizar la señal que pasa a través de la interfaz O2-O3.
En cuanto al campo de visión utilizable, este sistema logró un campo plano y fiable con una iluminación constante en un área de 80 μm x 80 μm. Esta área es más pequeña que el campo de visión máximo proporcionado por la cámara, por lo que el campo de visión utilizable se indica mediante el cuadro amarillo de la Figura 13. En términos de poder de resolución, este sistema logró una distancia mínima resoluble de 432 nm a lo largo del eje x y 421 nm a lo largo del eje y, que se midió encontrando el promedio sigma x e y de los ajustes gaussianos a las funciones de dispersión puntual (PSF) en el campo de visión bueno y multiplicándolo por dos. Observamos que este sistema no se optimizó en términos de su NA total, lo que significa que hay margen de mejora significativa si los usuarios desean un poder de resolución superior al que logró este sistema. Hay una multitud de opciones de objetivos compatibles para este tipo de construcción de SOLS, muchas de las cuales contribuirían a una mayor resolución del sistema, pero con los inconvenientes de un costo más alto, un campo de visión más pequeño o técnicas de alineación más complicadas en la interfaz del relé 8,11,13,20. Por otra parte, si los usuarios desean un campo de visión más grande, la incorporación de un segundo galvo para permitir el escaneo 2D lograría este objetivo, pero requeriría que se integraran ópticas y mecánicas de control adicionales en el diseño32. Hemos proporcionado más detalles sobre las modificaciones al sistema en nuestra página web, junto con enlaces a otros recursos útiles sobre el proceso de diseño23.
Más allá de mejorar los componentes específicos para este diseño en particular, sería muy factible agregar otras técnicas o modalidades de microscopía de alta resolución a esta construcción. Una de esas mejoras sería incorporar iluminación de múltiples longitudes de onda, lo que implicaría alinear láseres de excitación adicionales con la ruta de excitación original8. Además, debido a que este tipo de diseño SOLS deja la muestra accesible, agregar funciones adicionales al microscopio, que incluyen, entre otras, pinzas ópticas, microfluídica y reometría, es relativamente sencillo 2,33.
En comparación con la miríada de guías de hojas de luz que se han publicado, este protocolo proporciona instrucciones a un nivel de comprensión que puede resultar útil para un usuario sin experiencia significativa en óptica. Al hacer que una construcción SOLS fácil de usar con capacidades tradicionales de montaje de portaobjetos de muestra sea accesible a un público más amplio, esperamos permitir una expansión aún mayor de las aplicaciones de la investigación basada en SOLS en todos los campos en los que el instrumento se ha utilizado o podría utilizarse. Incluso con las aplicaciones de los instrumentos SOLS creciendo rápidamente en número 2,34,35, creemos que muchos beneficios y usos de los instrumentos tipo SOLS aún permanecen inexplorados y expresamos entusiasmo por las posibilidades de este tipo de instrumento en el futuro.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este trabajo fue apoyado por el Premio RUI de la Fundación Nacional de Ciencias (NSF) (DMR-2203791) a J.S. Estamos agradecidos por la orientación proporcionada por el Dr. Bin Yang y el Dr. Manish Kumar durante el proceso de alineación. Jenny Ross y K. Alice Lindsay por las instrucciones de preparación para los motores de kinesina.
Materials
| 1" Plano-Concave Lens f = -50 mm | Thorlabs | LC1715-A-ML | For alignment laser Estimated Cost: $49.5 |
| 1" Achromatic Doublet f = 100 mm (x3) | Thorlabs | AC254-100-A-ML | L2, L4 and alignment laser Estimated Cost: $342.42 |
| 1" Achromatic Doublet f = 125 mm | Thorlabs | AC254-125-A-ML | SL2 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 150 mm | Thorlabs | AC254-150-A-ML | L3 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 150 mm | Thorlabs | AC254-150-A-ML | TL2 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 45 mm | Thorlabs | AC254-045-A-ML | L1 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 75 mm | Thorlabs | AC254-075-A-ML | SL1 Estimated Cost: $114.14 |
| 1" Cylindrical Lens f = 100 mm | Thorlabs | LJ1567RM | CL3 Estimated Cost: $117.62 |
| 1" Cylindrical Lens f = 200 mm | Thorlabs | LJ1653RM | CL2 Estimated Cost: $111.22 |
| 1" Cylindrical Lens f = 50 mm | Thorlabs | LJ1695RM | CL1 Estimated Cost: $117.62 |
| 1" Mounted Pinhole, 30 µm Pinhole Diameter | Thorlabs | P30K | Estimated Cost: $77.08 |
| 1" Silver Mirror (x3) | Thorlabs | PF10-03-P01 | M1, M2, one for alignment Estimated Cost: $168.78 |
| 2" Elliptical Mirror | Thorlabs | PFE20-P01 | M3 Estimated Cost: $179.98 |
| 2" Post Holder (x11) | Thorlabs | PH2 | For custom laser mount, ND wheel, safety screens Estimated Cost: $98.45 |
| 2" Posts (x47) | Thorlabs | TR2 | For custom laser mount and optical components Estimated Cost: $277.3 |
| 3" Posts (x4) | Thorlabs | TR3 | For M3 supports and other mounts Estimated Cost: $24.6 |
| 3" Post Holder (x4) | Thorlabs | PH3 | Estimated Cost: $38.48 |
| 30 to 60 mm Cage Adapter | Thorlabs | LCP33 | To mount O1 Estimated Cost: $45.42 |
| 30mm Cage Filter Wheel | Thorlabs | CFW6 | To mount ND filters Estimated Cost: $172.36 |
| 30mm Cage Plate (x6) | Thorlabs | CP33 | To build alignment cage and alignment laser Estimated Cost: $114.54 |
| 30mm Right-Angle Kinematic Mirror Mount (x3) | Thorlabs | KCB1 | To mount M1 and M2 and for alignment laser Estimated Cost: $463.95 |
| 4" Post Holder (x30) | Thorlabs | PH4 | Estimated Cost: $320.1 |
| 561 nm Laser and Power Supply | Opto Engine LLC | MGL-FN-561-100mW | Excitation laser Estimated Cost: $6000 |
| 60mm Cage Plate (x2) | Thorlabs | LCP01 | To mount TL1 and M3 mount Estimated Cost: $88.52 |
| 60mm Right-Angle Kinematic Mirror Mount | Thorlabs | KCB2 | To mount M3 Estimated Cost: $187.26 |
| 90° Flip Mount | Thorlabs | TRF90 | For alignment laser Estimated Cost: $95.5 |
| Adapter with External C-Mount Threads and Internal SM1 Threads | Thorlabs | SM1A9 | To connect lens tube to camera Estimated Cost: $20.96 |
| Adapter with External SM1 Threads and Internal C-Mount Threads | Thorlabs | SM1A10 | To connect tube lens to lens mount Estimated Cost: $21.82 |
| Adapter with External SM1 Threads and Internal M25 Threads (x2) | Thorlabs | SM1A12 | To mount O1 and O2 Estimated Cost: $47.06 |
| Adapter with External SM1 Threads and Internal M26 Threads | Thorlabs | SM1A27 | To mount O3 Estimated Cost: $22.38 |
| Alignment Disk | Thorlabs | SM1A7 | Estimated Cost: $20.45 |
| Alignment Laser | BISKEE | https://www.amazon.com/Tactical-Presentation-Teaching-Interactive-Adjustable/dp/B09B1VXPNM Estimated Cost: $16.98 |
|
| Autoluorescent Plastic Slide, Red | Chroma | 92001 | Estimated Cost: $20 |
| Beam Shutter | Thorlabs | SM1SH1 | To block laser light Estimated Cost: $65.8 |
| Cage Rotation Mount (x3) | Thorlabs | CRM1T | To mount CL1-3 Estimated Cost: $282.15 |
| Cage System Rods 1" (x8) | Thorlabs | ER1 | To mount M3 and O1 Estimated Cost: $44.8 |
| Cage System Rods 3" (x2) | Thorlabs | ER3 | To mount O3 Estimated Cost: $14.28 |
| Cage System Rods 4" (x4) | Thorlabs | ER4 | To mount slit Estimated Cost: $30.76 |
| Cage System Rods 8" (x2) | Thorlabs | ER8 | For tube lens alignment Estimated Cost: $25.3 |
| Cage System Rods 12" (x8) | Thorlabs | ER12 | For alignment cage Estimated Cost: $145.36 |
| Camera | Andor | Zyla 4.2 sCMOS | Estimated Cost: ~$14,000 |
| Clamping Fork (x35) | Thorlabs | CF125 | To clamp down post mounts Estimated Cost: $338.8 |
| Cover Glass, 22 x 22 mm | Corning | 2850-22 | For slide samples Estimated Cost: $265 |
| Dichroic | AVR | DI01-R405/488/561/635-25×36 | To split exciation/emission paths Estimated Cost: $965 |
| Dovetail Translation Stage | Thorlabs | DT12 | To translate pinhole Estimated Cost: $90.55 |
| Emission Filter | Thorlabs | FELHO600 | Estimated Cost: $140.99 |
| Frosted Glass Alignment Disk (x2) | Thorlabs | DG10-1500-H1 | For alignment cage and intermediate plane Estimated Cost: $75.14 |
| Function Generator | Hewlett-Packard | HP 33120A 15 MHz | To control galvo Estimated Cost: $900 |
| Galvanometer – 1D Large Beam Diameter System | Thorlabs | GVS011 | Estimated Cost: $1715.78 |
| Galvanometer Power Supply | Siglent | SPD3303C | Estimated Cost: $300 |
| Gelrite | Research Products International | G35020-100.0 | Gellan gum for 3D bead sample Estimated Cost: $68.25 |
| FIJI Software | Open-source | Download from https://imagej.net/software/fiji/downloads Estimated Cost: Free |
|
| Hot Plate/ Stirrer | Corning | 6795-220 | For preparing sample solutions Estimated Cost: $550 |
| K-Cube Brushed Motor Controller | Thorlabs | KDC101 | Drives Z825B Estimated Cost: $757.51 |
| Kinematic Mount | Thorlabs | KM100S | To mount dichroic Estimated Cost: $92.01 |
| Kinesis Software | Thorlabs | Download from https://www.thorlabs.com/newgrouppage9.cfm?objectgroup_id=10285 Estimated Cost: Free |
|
| Laser Light Blocker | Thorlabs | LB1 | For ND filter reflections Estimated Cost: $57.65 |
| Laser Mount | custom made | 3D printed Estimated Cost: N/A |
|
| Laser Safety Screen (x2) | Thorlabs | TPS4 | For blocking stray laser light Estimated Cost: $92.02 |
| Laser Scanning Tube Lens | Thorlabs | TTL200MP | TL1 Estimated Cost: $1491 |
| Lens Mount (x10) | Thorlabs | LMR1 | To mount all lens and extra alignment mirror. Estimated Cost: $164.7 |
| Magnetic Ruler | Thorlabs | BHM4 | To check alignment Estimated Cost: $52.74 |
| Micro-Manager Software | Open-source | Download from https://micro-manager.org/Download_Micro-Manager_Latest_Release Estimated Cost: Free |
|
| Microscope Slides | Thermo Fisher Scientific | 12550400 | For slide samples Estimated Cost: $123.9 |
| Microscope Stage | ASI | FTP-2000 with custom parts | To fine-translate samples Estimated Cost: ~$16,000 |
| Mini Vortex Mixer | VWR | 10153-688 | For sample preparation Estimated Cost: $152.64 |
| Motorized Actuator | Thorlabs | Z825B | To fine-translate M1 Estimated Cost: $729.07 |
| Mounted Standard Iris (x2) | Thorlabs | ID20 | At least 2 for alignment Estimated Cost: $118.02 |
| ND Filter Set | Thorlabs | NDK01 | To reduce excitation intensity Estimated Cost: $726.73 |
| Objective Lens 1 | Nikon | Plan Apo 60X/ 1.20 WI | O1 Estimated Cost: ~$15,000 |
| Objective Lens 2 | Nikon | TU Plan Fluor 100X/0.90 | O2 Estimated Cost: ~$6,000 |
| Objective Lens 3 | Mitutoyo | Plan Apo HR 50X/0.75 | O3 Estimated Cost: ~$6,800 |
| OPM Deskewing Software | Open-source | For image processing. Download from https://github.com/QI2lab/OPM Estimated Cost: Free |
|
| Photodiode Power Sensor | Thorlabs | S121C | For measuring laser intensity Estimated Cost: $379.68 |
| Positive Grid Distortion Target | Thorlabs | R1L3S3P | Brightfield alignment Estimated Cost: $267.87 |
| Power Meter Digital Console | Thorlabs | PM100D | For measuring laser intensity Estimated Cost: $1245.48 |
| Rhodamine 6G | Thermo Scientific | J62315.14 | For fluorescent coated slide sample Estimated Cost: $27.7 |
| Right-Angle Clamp for Posts | Thorlabs | RA90 | For M3 support and flip down mirror Estimated Cost: $32.46 |
| RMS-Threaded Cage Plate (x2) | Thorlabs | CP42 | For alignment laser Estimated Cost: $70.56 |
| Shear Plate 2.5-5.0 mm | Thorlabs | SI050P | Estimated Cost: $182.85 |
| Shear Plate 5.0-10.0 mm | Thorlabs | SI100P | Estimated Cost: $201.47 |
| Shear Plate 10.0-25.4 mm | Thorlabs | SI254P | Estimated Cost: $236.42 |
| Shear Plate Viewing Screen | Thorlabs | SIVS | Estimated Cost: $337.74 |
| Shearing Interferometer with 1-3 mm Plate | Thorlabs | SI035 | For checking collimation Estimated Cost: $465.85 |
| Slip-On Post Collar (x35) | Thorlabs | R2 | To maintain post height Estimated Cost: $208.25 |
| Slit | Thorlabs | VA100 | Estimated Cost: $294.64 |
| Slotted Lens Tube, 3" | Thorlabs | SM1L30C | For alignment laser Estimated Cost: $77.45 |
| Square Mirror, 1 x 1" | https://www.amazon.com/Small-Square-Mirror-Pieces-Mosaic/dp/B07FBNMDC1/ref=asc_df_B07FBNMDC1/?tag=hyprod-20&linkCode=df0&hva did=642191768069&hvpos=&hvne tw=g&hvrand=1336734911900437 4691&hvpone=&hvptwo=&hvqmt= &hvdev=c&hvdvcmdl=&hvlocint=& hvlocphy=9031212&hvtargid=pla-1 943952718742&gclid=Cj0KCQiA6L yfBhC3ARIsAG4gkF_AYBpn5EdGL q3mc-RU-nanT5vM4ac9r3-obbzqJoWKPkIPIJU6e1caAjWmEA Lw_wcB&th=1 Estimated Cost: $14.76 |
||
| Stackable Lens Tube 1/2" (x3) | Thorlabs | SM1L05 | To mount CL1-3 Estimated Cost: $40.86 |
| Stackable Lens Tube 1" | Thorlabs | SM1L10 | To mount O3 Estimated Cost: $15.41 |
| Stackable Lens Tube 2" (x2) | Thorlabs | SM1L20 | For camera path Estimated Cost: $35.7 |
| Studded Pedestal Base Adapter (x37) | Thorlabs | BE1 | To attach post mounts to table Estimated Cost: $400.71 |
| Translating Lens Mount (x3) | Thorlabs | LM1XY | To fine-translate pinhole, O2 and O3 Estimated Cost: $441 |
| Translation Stage with Standard Micrometer (x2) | Thorlabs | PT1/M | TS1-2 Estimated Cost: $647.54 |
| Travel Manual Translation Stage | Thorlabs | CT1A | O3 cage translation mount Estimated Cost: $497.3 |
| Tube Lens | Nikon | MXA20696 | TL3 Estimated Cost: $359 |
| White Mounted LED | Thorlabs | MNWHL4 | Brightfield light source Estimated Cost: $171.28 |
| TOTAL ESTIMATED COST: $84,858.98 | |||
| The authors note that many parts were bought used. Here, we have attempted to reflect the retail price of all items, so the total cost can be greatly reduced by buying particular items used, especially the more expensive ones. | |||
| OPTIONAL COMPONENTS | |||
| Grasshopper3 USB3 | FLIR | GS3-U3-23S6C-C | For diagnostic checks during alignment. Acquisiton camera can be used instead, but requires realignment afterwards. Estimated Cost: $1089 |
References
- Girkin, J. M., Carvalho, M. T. The light-sheet microscopy revolution. Journal Optics. 20 (5), 053002 (2018).
- You, R., McGorty, R. Light sheet fluorescence microscopy illuminating soft matter. Frontiers in Physics. 9, 760834 (2021).
- Fuchs, E., Jaffe, J. S., Long, R. A., Azam, F. Thin laser light sheet microscope for microbial oceanography. Optics Express. 10 (2), 145-154 (2002).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Dunsby, C. Optically sectioned imaging by oblique plane microscopy. Optics Express. 16 (25), 20306-20316 (2008).
- Bouchard, M. B., et al. Swept confocally-aligned planar excitation (SCAPE) microscopy for high-speed volumetric imaging of behaving organisms. Nature Photonics. 9 (2), 113-119 (2015).
- Smith, C. W., Botcherby, E. J., Wilson, T. Resolution of oblique-plane images in sectioning microscopy. Optics Express. 19 (3), 2662-2669 (2011).
- Yang, B., et al. Epi-illumination SPIM for volumetric imaging with high spatial-temporal resolution. Nature Methods. 16 (6), 501-504 (2019).
- Wu, Y., et al. Simultaneous multiview capture and fusion improves spatial resolution in wide-field and light-sheet microscopy. Optica. 3 (8), 897-910 (2016).
- Sahasrabudhe, A., Vittal, V., Ghose, A. Peeping in on the cytoskeleton: Light microscopy approaches to actin and microtubule organization. Current Science. 105 (11), 1562-1570 (2013).
- Kumar, M., Kishore, S., Nasenbeny, J., McLean, D. L., Kozorovitskiy, Y. Integrated one- and two-photon scanned oblique plane illumination (SOPi) microscopy for rapid volumetric imaging. Optics Express. 26 (10), 13027-13041 (2018).
- Kim, J., et al. Oblique-plane single-molecule localization microscopy for tissues and small intact animals. Nature Methods. 16 (9), 853-857 (2019).
- Sapoznik, E., et al. A versatile oblique plane microscope for large-scale and high-resolution imaging of subcellular dynamics. eLife. 9, e57681 (2020).
- Bernardello, M., Marsal, M., Gualda, E. J., Loza-Alvarez, P. Light-sheet fluorescence microscopy for the in vivo study of microtubule dynamics in the zebrafish embryo. Biomedical Optics Express. 12 (10), 6237-6254 (2021).
- Shelden, E. A., Colburn, Z. T., Jones, J. C. R. Focusing super resolution on the cytoskeleton. F1000Res. 5, (2016).
- Wulstein, D. M., Regan, K. E., Garamella, J., McGorty, R. J., Robertson-Anderson, R. M. Topology-dependent anomalous dynamics of ring and linear DNA are sensitive to cytoskeleton crosslinking. Science Advances. 5 (12), (2019).
- Sheung, J. Y., Garamella, J., Kahl, S. K., Lee, B. Y., McGorty, R. J., Robertson-Anderson, R. M. Motor-driven advection competes with crowding to drive spatiotemporally heterogeneous transport in cytoskeleton composites. Frontiers in Physics. 10, 1055441 (2022).
- Zeiss Lightsheet 7. Light-Sheet Multiview Imaging of Living and Cleared Specimens. Zeiss Available from: https://www.zeiss.com/microscopy/en/products/light-microscopes/light-sheet-microscopes/lightsheet-7.html (2023)
- Zeiss Lattice Lightsheet 7. Long-Term Volumetric Imaging of Living Cells. Zeiss Available from: https://www.zeiss.com/microscopy/en/products/light-microscopes/light-sheet-microscopes/lattice-lightsheet-7.html (2023)
- Kumar, M., Kishore, S., McLean, D. L., Kozorovitskiy, Y. Crossbill: An open access single objective light-sheet microscopy platform. bioRxiv. , (2021).
- Olarte, O. E., Andilla, J., Gualda, E. J., Loza-Alvarez, P. Light-sheet microscopy: A tutorial. Advances in Optics and Photonics. 10 (1), 111-179 (2018).
- Pitrone, P. G., et al. OpenSPIM: An open-access light-sheet microscopy platform. Nature Methods. 10 (7), 598-599 (2013).
- Single Objective Light Sheet Microscope (SOLS) Guide. Sheung Lab Available from: https://sites.google.com/view/sheunglab/microscopy/single-objective-light-microscope-sols (2023)
- Lamb, J. R., Ward, E. N., Kaminski, C. F. Open-source software package for on-the-fly deskewing and live viewing of volumetric lightsheet microscopy data. Biomedical Optics Express. 14 (2), 834-845 (2023).
- . Harvard University. Mitchison Lab Available from: https://mitchison.hms.harvard.edu/home (2023)
- Watkins, S. C., St. Croix, C. M. Light sheet imaging comes of age. Journal of Cell Biology. 217 (5), 1567-1569 (2018).
- Ndlec, F. J., Surrey, T., Maggs, A. C., Leibler, S. Self-organization of microtubules and motors. Nature. 389 (6648), 305-308 (1997).
- Sanchez, T., Chen, D. T. N., DeCamp, S. J., Heymann, M., Dogic, Z. Spontaneous motion in hierarchically assembled active matter. Nature. 491 (7424), 431-434 (2012).
- Berezney, J., Goode, B. L., Fraden, S., Dogic, Z. Extensile to contractile transition in active microtubule-actin composites generates layered asters with programmable lifetimes. Proceedings of the National Academy of Sciences of the United States of America. 119 (5), e2115895119 (2022).
- Kim, K., et al. Isomorphic coalescence of aster cores formed in vitro from microtubules and kinesin motors. Physical Biology. 13 (5), 056002 (2016).
- Millett-Sikking, A., et al. . High NA single-objective lightsheet. , (2019).
- Bourgenot, C., Saunter, C. D., Taylor, J. M., Girkin, J. M., Love, G. D. 3D adaptive optics in a light sheet microscope. Optics Express. 20 (12), 13252-13261 (2012).
- Bernardello, M., Gualda, E. J., Loza-Alvarez, P. Modular multimodal platform for classical and high throughput light sheet microscopy. Scientific Reports. 12 (1), 1969 (2022).
- Crombez, S., Leclerc, P., Ray, C., Ducros, N. Computational hyperspectral light-sheet microscopy. Optics Express. 30 (4), 4856-4866 (2022).

