تصنيع الخلايا التائية لمستقبلات المستضد الخيمري على معالج خلوي آلي
Summary
توضح هذه المقالة بالتفصيل عملية تصنيع الخلايا التائية لمستقبلات المستضد الخيمري للاستخدام السريري ، وتحديدا باستخدام معالج خلوي آلي قادر على إجراء نقل فيروسي وزراعة الخلايا التائية. نحن نقدم توصيات ونصف المزالق التي يجب مراعاتها أثناء تطوير العملية وتنفيذ تجربة سريرية في مرحلة مبكرة.
Abstract
تمثل الخلايا التائية لمستقبلات المستضد الخيمري (CAR) نهجا علاجيا مناعيا واعدا لعلاج مختلف الأمراض الخبيثة وغير الخبيثة. الخلايا التائية ذات مستقبلات المستضدات الوهمية هي خلايا تائية معدلة وراثيا تعبر عن بروتين خيمري يتعرف على هدف سطح الخلية ويرتبط به، مما يؤدي إلى قتل الخلية المستهدفة. طرق تصنيع الخلايا التائية ذات مستقبلات المستضدات الوهمية التقليدية كثيفة العمالة ومكلفة وقد تحمل خطر التلوث. يسمح CliniMACS Prodigy ، وهو معالج خلوي آلي ، بتصنيع منتجات العلاج بالخلايا على نطاق سريري في نظام مغلق ، مما يقلل من مخاطر التلوث. تحدث المعالجة بشكل شبه تلقائي تحت سيطرة الكمبيوتر وبالتالي تقلل من المشاركة البشرية في العملية ، مما يوفر الوقت ويقلل من التباين والأخطاء.
تصف هذه المخطوطة والفيديو عملية نقل الخلايا التائية (TCT) لتصنيع الخلايا التائية ذات مستقبلات المستضدات الوهمية باستخدام هذا المعالج. تتضمن عملية TCT إثراء الخلايا التائية CD4 + / CD8 + ، والتنشيط ، والتحويل باستخدام ناقل فيروسي ، والتوسع ، والحصاد. باستخدام مصفوفة الأنشطة، وهي وظيفة تسمح بطلب هذه الخطوات وتوقيتها، يمكن تخصيص عملية TCT على نطاق واسع. نحن نقدم جولة تفصيلية لتصنيع الخلايا التائية ذات مستقبلات المستضدات الوهمية وفقا لممارسات التصنيع الجيدة الحالية (cGMP) ونناقش اختبار الإطلاق المطلوب والتجارب قبل السريرية التي ستدعم تطبيق الدواء الجديد البحثي (IND). نوضح جدوى ومناقشة مزايا وعيوب استخدام عملية شبه أوتوماتيكية لتصنيع الخلايا التائية ذات مستقبلات المستضدات الوهمية السريرية. أخيرا ، وصفنا تجربة سريرية مستمرة بدأها الباحث والتي تستهدف الأورام الخبيثة في الخلايا البائية لدى الأطفال [NCT05480449] كمثال على كيفية تطبيق عملية التصنيع هذه في بيئة سريرية.
Introduction
أظهر النقل بالتبني للخلايا التائية المهندسة للتعبير عن مستقبلات المستضد الخيمري (CAR) فعالية ملحوظة في علاج المرضى الذين يعانون من الأورام الخبيثة في الخلايا البائيةالمقاومة للحرارة 1،2،3،4،5. ومع ذلك ، فإن طرق التصنيع التقليدية للخلايا التائية ذات مستقبلات المستضدات الوهمية كثيفة العمالة وتستغرق وقتا طويلا وتتطلب فنيين مدربين تدريبا عاليا لتنفيذ خطوات متخصصة للغاية. على سبيل المثال ، تتضمن عملية التصنيع التقليدية لمنتج الخلايا التائية ذات مستقبلات المستضدات الوهمية ذاتية المنشأ الطرد المركزي المتدرج الكثافة أو الشطف أو الفصل المغناطيسي لإثراء الخلايا التائية والتنشيط والتحويل باستخدام ناقل فيروسي في دورق معقم ، والتوسع في مفاعل حيوي قبل الحصاد والتركيب. ظهرت أنظمة مختلفة مؤخرا تهدف إلى أتمتة هذه العملية جزئيا. على سبيل المثال ، Miltenyi CliniMACS Prodigy (المشار إليه فيما يلي باسم “المعالج”) هو جهاز معالجة خلايا آلي يمكنه تنفيذ العديد من هذه الخطوات بطريقة آلية6،7،8،9. تم تقديم مناقشة متعمقة لطرق تصنيع CAR-T التقليدية والآلية في مقالة مراجعةحديثة 10.
يعتمد المعالج على وظائف CliniMACS Plus ، وهو جهاز طبي معتمد من إدارة الغذاء والدواء الأمريكية (FDA) لمعالجة الخلايا السلفية المكونة للدم. يشتمل المعالج على وحدة زراعة الخلايا التي تسمح بالغسيل الآلي للخلايا وتجزئتها وزراعتها (الشكل 1). عملية نقل الخلايا التائية (TCT) هي برنامج محدد مسبقا داخل جهاز المعالج يكرر إلى حد كبير التصنيع اليدوي للخلايا التائية ذات مستقبلات المستضدات الوهمية. يسمح TCT بمعالجة الخلايا القابلة للتخصيص باستخدام واجهة مستخدم رسومية (“مصفوفة النشاط” ، الشكل 2). نظرا لأن المعالج يقوم بأتمتة العديد من الخطوات ويدمج وظائف أجهزة متعددة في جهاز واحد ، فإنه يتطلب تدريبا أقل ومهارات متخصصة في استكشاف الأخطاء وإصلاحها من التقنيين. نظرا لأن جميع الخطوات يتم تنفيذها داخل مجموعة أنابيب مغلقة تستخدم مرة واحدة ، فقد يتم تشغيل المعالج في مرافق ذات بنية تحتية أقل صرامة لمعالجة الهواء مما يمكن اعتباره مقبولا لعملية التصنيع المفتوحة. على سبيل المثال ، نقوم بتشغيل المعالج في منشأة معتمدة من فئة ISO 8 (يمكن مقارنتها بدرجة الاتحاد الأوروبي C).
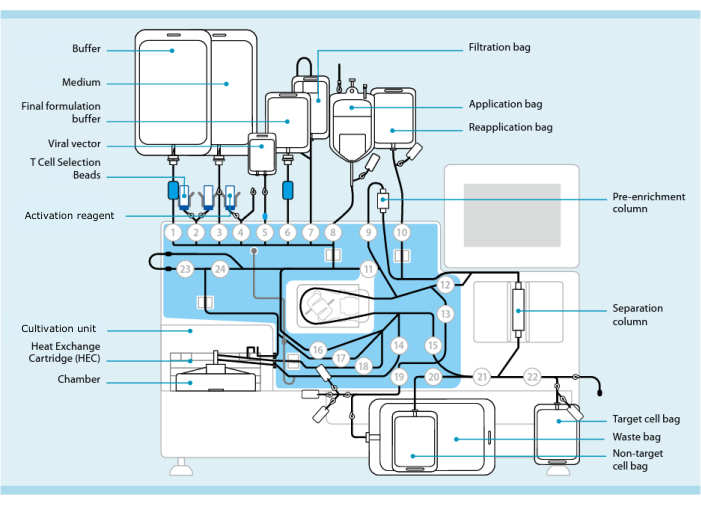
الشكل 1: تصنيع الخلايا التائية ذات مستقبلات المستضدات الوهمية باستخدام نظام نقل الخلايا التائية. يظهر المعالج مع مجموعة الأنابيب المثبتة. تسمح مجموعة الأنابيب بتوصيل مكونات أخرى مثل الأكياس التي تحتوي على مخزن مؤقت للمعالجة ووسط استزراع وناقل عدسي عن طريق اللحام المعقم. بمجرد إضافة منتج فصادة الكريات البيض إلى كيس التطبيق ، يمكن تمييزه بخرز اختيار الخلايا التائية ، وتمريره عبر عمود الفصل ، ثم نقله إلى كيس إعادة التطبيق. ثم يتم توجيه الخلايا المختارة إلى وحدة الزراعة الخاصة بأداة الاستزراع وتنشيطها باستخدام كاشف التنشيط (انظر جدول المواد). يتم جمع المنتج النهائي في كيس الخلية المستهدفة. طوال العملية ، من الممكن إزالة العينات لمراقبة الجودة بشكل معقم. تمثل الأرقام الرمادية داخل الدوائر الصمامات المرقمة على المعالج التي توجه مسار السائل عبر مجموعة الأنابيب. مستنسخة بإذن من 11. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
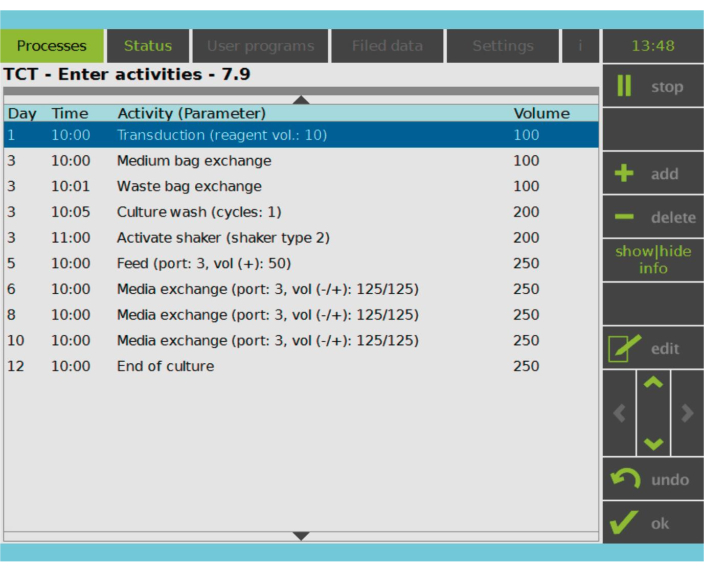
الشكل 2: مصفوفة النشاط. بعد اختيار الخلايا التائية وتنشيطها ، يصبح ما تبقى من عملية تصنيع الخلايا التائية ذات مستقبلات المستضدات الوهمية قابلا للتخصيص بالكامل. يمكن إضافة الأنشطة أو حذفها وجدولتها لليوم والوقت المناسبين ، ويمكن تحديد حجم الثقافة بعد النشاط (Volume). على سبيل المثال ، تم تكوين نشاط النقل ليبدأ في الساعة 10:00 صباحا في اليوم الأول ، وتم تعيين حجم الثقافة في نهاية النشاط على أنه 100 مل. يمكن تحرير مصفوفة النشاط طوال فترة الزراعة. يمكن مراقبة حالة العملية على الشاشة المدمجة لجهاز المعالجة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الهدف من هذه المخطوطة هو توفير جولة مفصلة لتصنيع الخلايا التائية ذات مستقبلات المستضدات الوهمية باستخدام المعالج بالإضافة إلى تقديم إرشادات حول اختبار إطلاق المنتج والمنتج الذي من المحتمل أن يكون مطلوبا من قبل المنظمين للموافقة على تطبيق دواء جديد بحثي (IND). يبقى البروتوكول المقدم قريبا من النهج الموصى به للبائع وهو البروتوكول الأساسي ل IND 28617 ، والذي يتم تقييمه حاليا في المرحلة الأولى / الثانية من التجارب السريرية التي بدأها باحث واحد. تهدف هذه التجربة إلى تحديد سلامة وفعالية استخدام هذا المعالج لتصنيع خلايا CAR-T ذاتية المنشأ موجهة بالبشر CD19 للمرضى الذين يعانون من سرطان الدم الليمفاوي الحاد للخلايا البائية (B-ALL) أو سرطان الغدد الليمفاوية B-lineage (B-Lly) [NCT05480449]. بدأت التجربة في سبتمبر 2022 ومن المقرر أن تسجل ما يصل إلى 89 مريضا تتراوح أعمارهم بين 0-29 عاما مع B-ALL أو B-Lly. نبلغ عن بعض نتائج التصنيع من التجربة في المخطوطة.
نود أن نشير إلى أنه على الرغم من تقديم المخطوطة كبروتوكول مع خطوات يجب اتباعها ، إلا أنه يجب اعتبارها نقطة انطلاق للآخرين للبدء في تحسين عملية تصنيع الخلايا التائية ذات مستقبلات المستضدات الوهمية الخاصة بهم. وتشمل قائمة غير شاملة بالاختلافات المحتملة في البروتوكول المقدم ما يلي: استخدام الخلايا التائية الطازجة بدلا من الخلايا التائية المحفوظة بالتبريد كمواد أولية؛ واستخدام الخلايا التائية الطازجة بدلا من الخلايا التائية المحفوظة بالتبريد كمواد أولية؛ واستخدام الخلايا التائية الطازجة بدلا من الخلايا التائية المحفوظة بالتبريد كمواد أولية؛ واستخدام الخلايا التائية الطازجة بدلا من الخلايا التائية المحفوظة بالتبريد كمواد أولية؛ واستخدام الخلايا الت باستخدام طريقة مختلفة لتخصيب الخلايا التائية أو حذفها تماما ؛ استخدام وسائط مختلفة وكوكتيلات السيتوكين مثل IL7 / IL15 بدلا من IL2 ؛ تغيير تركيز مصل AB البشري أو حذفه تماما ؛ توقيت التنبيغ باستخدام عمليات نقل “متعددة الضربات” ؛ الإثارة المتفاوتة ، وأحجام الثقافة ، وجدول التغذية ؛ استخدام طرق مختلفة للنقل الجيني بما في ذلك التثقيب الكهربائي للأحماض النووية أو النواقل غير الفيروسية ؛ استخدام محلول عازل و/أو واقي بالتبريد مختلف؛ وغرس الخلايا التائية ذات مستقبلات المستضدات الوهمية طازجة بدلا من حفظها بالتبريد للتسريب في وقت لاحق. قد يكون لهذه الاختلافات تأثير كبير على التركيب الخلوي وفعالية المنتج العلاجي.
| خطوة العملية الشاملة | يوم العملية | تفاصيل تقنية | |||
| إثراء الخلايا | اليوم 0 | اختيار الخلايا التائية CD4 + / CD8 + | |||
| تنشيط الخلية | بذر وتنشيط زراعة الخلايا التائية | ||||
| نقل الخلايا | اليوم 1 | نقل الفيروسات النسرية (حجم مزرعة 100 مل) | |||
| توسيع الخلية (تليها صياغة الخلية) | اليوم 2 | — | |||
| اليوم 3 | غسل الثقافة (1 دورة) ؛ شاكر تفعيل. زيادة حجم الثقافة إلى 200 مل | ||||
| اليوم 4 | — | ||||
| اليوم 5 | تغذية (50 مل) ؛ حجم الثقافة يصل إلى الحجم النهائي 250 مل | ||||
| اليوم 6 | عينة قيد المعالجة تبادل الوسائط (-125 مل / +125 مل) | ||||
| اليوم 7 | تبادل الوسائط (-150 مل / +150 مل) أو الحصاد | ||||
| اليوم 8 | عينة قيد المعالجة تبادل الوسائط (-150 مل / +150 مل) أو الحصاد | ||||
| اليوم 9 | تبادل الوسائط (-180 مل / +180 مل) أو الحصاد | ||||
| اليوم 10 | عينة قيد المعالجة تبادل الوسائط (-180 مل / +180 مل) أو الحصاد | ||||
| اليوم 11 | تبادل الوسائط (-180 مل / +180 مل) أو الحصاد | ||||
| اليوم 12 | تبادل الوسائط (-180 مل / +180 مل) أو الحصاد | ||||
| اليوم 13 | حصاد | ||||
الجدول 1: الجدول الزمني للعملية ونظرة عامة. يلخص هذا الجدول خطوات عملية TCT المستخدمة في تجربة سريرية حالية [NCT05480449]. تبدأ العملية بتخصيب الخلايا التائية عن طريق اختيار CD4 + / CD8 + ، وبذر الثقافة ، والتنشيط في اليوم 0 ، يليه التحويل في اليوم 1. تستريح الخلايا لمدة 48 ساعة ، تليها غسل الثقافة ، وزيادة حجم الثقافة إلى 200 مل ، والإثارة باستخدام آلية الاهتزاز. في اليوم 6 ، يتم أخذ أول عينة قيد المعالجة. يتم حصاد الخلايا بمجرد توفر خلايا كافية لثلاث جرعات كاملة على الأقل من الخلايا التائية ذات مستقبلات المستضدات الوهمية (5 × 10 6 خلايا CAR-T / كجم إذا كان المريض <50 كجم ، وإلا 2.5 × 108 خلايا CAR-T) واختبار مراقبة الجودة (~ 2 × 106 خلايا CAR-T) ؛ أو بمجرد أن تصل الثقافة إلى ما مجموعه 4-5 × 109 خلايا. الاختصارات: TCT = نقل الخلايا التائية ؛ CAR-T = الخلايا التائية لمستقبلات المستضد الخيمري ؛ MACS = فرز الخلايا المنشط مغناطيسيا.
Protocol
Representative Results
Discussion
برز العلاج بالخلايا التائية ذات مستقبلات المستضدات الوهمية كنهج علاجي واعد للخلايا البائية والأورام الخبيثة الأخرى. ومع ذلك ، فإن طرق تصنيع الخلايا التائية ذات مستقبلات المستضدات الوهمية التقليدية لها العديد من القيود ، مثل التكلفة العالية ، والإنتاج كثيف العمالة ، والخطوات المفتوحة ا?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
يود المؤلفون الاعتراف بمساهمات العديد من الأفراد والمنظمات في هذا العمل. قدم مختبر العلاج بالخلايا والجينات ومختبر بن للدراسات الانتقالية والمترابطة مساعدة قيمة في تطوير العملية والتحضير لتقديم IND. ساهمت ميليسا فارغيز وأماندا دينوفيا في تطوير العملية والتحضير لتقديمات IND التي تقوم عليها هذه المخطوطة. تم دعم هذا العمل من خلال منحة تسريع العلاج بالخلايا والجينات التعاونية لمستشفى الأطفال في فيلادلفيا. يود المؤلفون أيضا أن يشكروا Miltenyi Biotec على دعمهم الفني والبحثي. الشكل 1 مشمول بحقوق الطبع والنشر © 2023 Miltenyi Biotec B.V. &Co. KG ؛ كل الحقوق محفوظة.
Materials
| 12 x 75 borosilicate tubes | Charles River | TL1000 | |
| 20 mL Reagent Bag | Miltenyi Biotec | 170-076-631 | |
| 50 mL Conical Tube | Fisher | 05-539-10 | |
| 150 mL Transfer Set | Fenwal | 4R2001 | |
| 2,000 mL Transfer Set | Fenwal | 4R2041 | |
| 7AAD | Fisher Scientific | BDB559925 | |
| Alcohol Prep | Tyco/Healthcare | ||
| Bag Access | Medline | 2300E-0500 | |
| CD19 APC-Vio770 REAfinity | Miltenyi Biotec | 130-113-643 | |
| CD19 CAR Detection Reagent Biotin | Miltenyi Biotec | 130-129-550 | |
| CD19 PE | BD | 555413 | |
| CD3 APC | BD | 340440 | |
| CD4 VioBright FITC REAfinity | Miltenyi Biotec | 130-113-229 | |
| CD45 VioBlue REAfinity | Miltenyi Biotec | 130-110-637 | |
| CD8 APC-Vio770 REAfinity | Miltenyi Biotec | 130-110-681 | |
| Cellometer Reference Beads 10um | Nexcelom | B10-02-020 | |
| Cellometer Reference Beads 15um | Nexcelom | B15-02-010 | |
| Cellometer Reference Beads 5um | Nexcelom | B05-02-050 | |
| Cellometer Slides | Nexcelom | CHT4-SD100-002 | |
| CliniMACS CD4 GMP MicroBeads | Miltenyi Biotec | 276-01 | The CD4 reagent |
| CliniMACS CD8 GMP MicroBeads | Miltenyi Biotec | 275-01 | The CD8 reagent |
| CliniMACS PBS/EDTA Buffer | Miltenyi Biotec | 130-021-201 | The buffer |
| DMSO | Origen | CP-10 | |
| Freezing Bag 50 mL | Miltenyi Biotec | 200-074-400 | |
| Freezing Vial, 1.8 mL | Nunc | 12565171N | |
| Freezing Vial, 4.5 mL | Nunc | 12565161N | |
| Human AB serum | Valley Biomedical | Sterile filtered, heat inactivated | |
| Human Serum Albumin 25% | Grifols | 68516-5216-1 | |
| Human Serum Albumin 5% | Grifols | 68516-5214-1 | |
| MACS GMP Recombinant Human IL-2 | Miltenyi Biotec | 170-076-148 | The cytokines |
| MACS GMP T Cell TransAct | Miltenyi Biotec | 200-076-202 | The activation reagent |
| MycoSeq Mycoplasma Detection Kit | Life Technologies | 4460623 | |
| Needles, Hypodermic 14G | Medline | SWD200573 | |
| Needles, SlideSafe 18G | BD | B-D305918 | |
| Pipet tips, 2-200 μL, individually wrapped | Eppendorf | 022492209 | |
| Pipet tips, 50-1000 μL, individually wrapped | Eppendorf | 022492225 | |
| Pipets 10 mL | Fisher | 13-678-27F | |
| Pipets 25 mL | Fisher | 13-675-30 | |
| Pipets 5 mL | Fisher | 13-678-27E | |
| Plasmalyte-A | Baxter | 2B2544X | The electrolyte solution |
| Prodigy TS520 Tubing Set | Miltenyi Biotec | 170-076- 600 | The tubing set |
| Sterile Field | Medline | NON21001 | |
| Streptavidin PE-Vio770 | Miltenyi Biotec | 130-106-793 | |
| Syringe 1 mL | BD | 309628 | |
| Syringe 10 mL | BD | 302995 | |
| Syringe 3 mL | BD | 309657 | |
| Syringe 30 mL | BD | 302832 | |
| Syringe 50 mL | BD | 309653 | |
| TexMACS GMP Medium | Miltenyi Biotec | 170-076-306 | The medium |
| Triple Sampling Adapter | Miltenyi Biotec | 170-076-609 | |
| Viral Vector | CHOP Clinical Vector Core | huCART19 | |
| Equipment | |||
| Biological Safety Cabinet | The Baker Co | ||
| Cellometer Auto 2000 | Nexcelom | ||
| CliniMACS Prodigy | Miltenyi Biotec | 200-075-301 | The processor |
| Controlled Rate Freezer | Planer/Kryosave | ||
| Endosafe nexgen-PTS150K | Charles River | ||
| Mettler Balance | Mettler | ||
| Refrigerated Centrifuge | Thermo Fisher | ||
| Refrigerated Centrifuge | Fisher Sci | ||
| SCD Sterile Tubing Welder | Terumo | ||
| Sebra Tube Sealer | Sebra | ||
| Varitherm | Barkey | The dry thaw device | |
| XN-330 Hematology Analyzer | Sysmex |
References
- Maude, S. L., et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. New England Journal of Medicine. 378 (5), 439-448 (2018).
- Shah, N. N., et al. Bispecific anti-CD20, anti-CD19 CAR T cells for relapsed B cell malignancies: A phase 1 dose escalation and expansion trial. Nature Medicine. 26 (10), 1569-1575 (2020).
- Maude, S. L., et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. New England Journal of Medicine. 371 (16), 1507-1517 (2014).
- Grupp, S. A., et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. New England Journal of Medicine. 368 (16), 1509-1518 (2013).
- Maude, S. L., et al. Efficacy of humanized CD19-targeted chimeric antigen receptor (CAR)-modified T cells in children and young adults with relapsed/refractory acute lymphoblastic leukemia. Blood. 128 (22), 217 (2016).
- Mock, U., et al. Automated manufacturing of CAR-T cells for adoptive immunotherapy using CliniMACS Prodigy. Cytotherapy. 18 (8), 1002-1011 (2016).
- Fernández, L., et al. GMP-compliant manufacturing of NKG2D CAR memory T cells using CliniMACS Prodigy. Frontiers in Immunology. 10 (10), 2361 (2019).
- Zhu, F., et al. Closed-system manufacturing of CD19 and dual-targeted CD20/19 chimeric antigen receptor T Cells using CliniMACS Prodigy device at an academic medical center. Cytotherapy. 20 (3), 394-406 (2018).
- Zhang, W., Jordan, K. R., Schulte, B., Purev, E. Characterization of clinical grade CD19 chimeric antigen receptor T cells produced using automated CliniMACS prodigy system. Drug Design, Development and Therapy. 12 (12), 3343-3356 (2018).
- Abou-El-Enein, M., et al. Scalable manufacturing of CAR T cells for cancer immunotherapy. Blood Cancer Discovery. 2 (5), 408-422 (2021).
- Miltenyi Biotec. . CliniMACS Prodigy User Manual. , (2021).
- Ghassemi, S., et al. Rapid manufacturing of non-activated potent CAR T cells. Nature Biomedical Engineering. 6 (2), 118-128 (2022).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Chemistry, manufacturing, and control (CMC) information for human gene therapy investigational new drug applications (INDs) guidance for industry. , (2020).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Considerations for the development of chimeric antigen receptor (CAR) T cell products draft guidance for industry. , (2022).

