Herstellung von chimären Antigenrezeptor-T-Zellen auf einem automatisierten Zellprozessor
Summary
Dieser Artikel beschreibt den Herstellungsprozess für chimäre Antigenrezeptor-T-Zellen für den klinischen Einsatz, insbesondere unter Verwendung eines automatisierten Zellprozessors, der in der Lage ist, virale Transduktion und Kultivierung von T-Zellen durchzuführen. Wir geben Empfehlungen und beschreiben Fallstricke, die bei der Prozessentwicklung und Durchführung einer frühen klinischen Studie berücksichtigt werden sollten.
Abstract
Chimäre Antigenrezeptor (CAR)-T-Zellen stellen einen vielversprechenden immuntherapeutischen Ansatz für die Behandlung verschiedener maligner und nicht-maligner Erkrankungen dar. CAR-T-Zellen sind genetisch veränderte T-Zellen, die ein chimäres Protein exprimieren, das ein Ziel auf der Zelloberfläche erkennt und daran bindet, was zur Abtötung der Zielzelle führt. Herkömmliche Methoden zur Herstellung von CAR-T-Zellen sind arbeitsintensiv, teuer und können das Risiko einer Kontamination bergen. Der CliniMACS Prodigy, ein automatisierter Zellprozessor, ermöglicht die Herstellung von Zelltherapieprodukten im klinischen Maßstab in einem geschlossenen System, wodurch das Risiko einer Kontamination minimiert wird. Die Verarbeitung erfolgt halbautomatisch unter der Steuerung eines Computers und minimiert so die menschliche Beteiligung am Prozess, was Zeit spart und Variabilität und Fehler reduziert.
Dieses Manuskript und Video beschreibt den T-Zell-Transduktionsprozess (TCT) zur Herstellung von CAR-T-Zellen mit diesem Prozessor. Der TCT-Prozess umfasst die Anreicherung, Aktivierung, Transduktion mit einem viralen Vektor, Expansion und Ernte von CD4+/CD8+ T-Zellen. Mit Hilfe der Activity Matrix, einer Funktionalität, die die Reihenfolge und das Timing dieser Schritte ermöglicht, kann der TCT-Prozess umfangreich angepasst werden. Wir bieten einen Überblick über die Herstellung von CAR-T-Zellen in Übereinstimmung mit der aktuellen Good Manufacturing Practice (cGMP) und besprechen die erforderlichen Freisetzungstests und präklinischen Experimente, die einen IND-Antrag (Investigational New Drug) unterstützen. Wir demonstrieren die Machbarkeit und diskutieren die Vor- und Nachteile eines halbautomatischen Prozesses für die klinische Herstellung von CAR-T-Zellen. Abschließend beschreiben wir eine laufende, von Prüfärzten initiierte klinische Studie, die auf pädiatrische B-Zell-Malignome abzielt [NCT05480449] als Beispiel dafür, wie dieses Herstellungsverfahren in einem klinischen Umfeld angewendet werden kann.
Introduction
Der adoptive Transfer von T-Zellen, die einen chimären Antigenrezeptor (CAR) exprimieren, hat eine bemerkenswerte Wirksamkeit bei der Behandlung von Patienten mit refraktären B-Zell-Malignomen gezeigt 1,2,3,4,5. Die traditionellen Herstellungsmethoden für CAR-T-Zellen sind jedoch arbeitsintensiv, zeitaufwändig und erfordern hochqualifizierte Techniker, um hochspezialisierte Schritte durchzuführen. Der traditionelle Herstellungsprozess eines autologen CAR-T-Zellprodukts umfasst beispielsweise Dichtegradientenzentrifugation, Elutriation oder magnetische Trennung zur Anreicherung von T-Zellen, Aktivierung und Transduktion mit einem viralen Vektor in einem sterilen Kolben und Expansion in einem Bioreaktor vor der Ernte und Formulierung. In jüngster Zeit sind verschiedene Systeme entstanden, die darauf abzielen, diesen Prozess teilweise zu automatisieren. Zum Beispiel ist der Miltenyi CliniMACS Prodigy (im Folgenden als “Prozessor” bezeichnet) eine automatisierte Zellverarbeitungsvorrichtung, die viele dieser Schritte in automatisierter Weise ausführen kann 6,7,8,9. Eine ausführliche Erörterung traditioneller und automatisierter CAR-T-Fertigungsmethoden wird in einem kürzlich erschienenen Übersichtsartikel10 vorgestellt.
Der Prozessor baut auf der Funktionalität des CliniMACS Plus auf, einem von der US-amerikanischen Food and Drug Administration (FDA) zugelassenen Medizinprodukt für die Verarbeitung von hämatopoetischen Vorläuferzellen. Der Prozessor enthält eine Zellkultivierungseinheit, die das automatische Waschen, Fraktionieren und Kultivieren von Zellen ermöglicht (Abbildung 1). Der T-Zell-Transduktionsprozess (TCT) ist ein voreingestelltes Programm innerhalb des Prozessorgeräts, das die manuelle Herstellung von CAR-T-Zellen weitgehend nachbildet. TCT ermöglicht eine anpassbare Zellverarbeitung über eine grafische Benutzeroberfläche (die “Aktivitätsmatrix”, Abbildung 2). Da der Prozessor viele Schritte automatisiert und die Funktionalität mehrerer Geräte in einem Gerät konsolidiert, erfordert er weniger Schulung und spezielle Fähigkeiten zur Fehlerbehebung von Technologen. Da alle Schritte in einem geschlossenen Einweg-Schlauchsatz durchgeführt werden, kann der Prozessor in Einrichtungen mit einer weniger strengen Luftbehandlungsinfrastruktur betrieben werden, als dies für einen offenen Herstellungsprozess akzeptabel wäre. So betreiben wir den Verarbeiter in einer Anlage, die nach ISO-Klasse 8 (vergleichbar mit EU-Klasse C) zertifiziert ist.
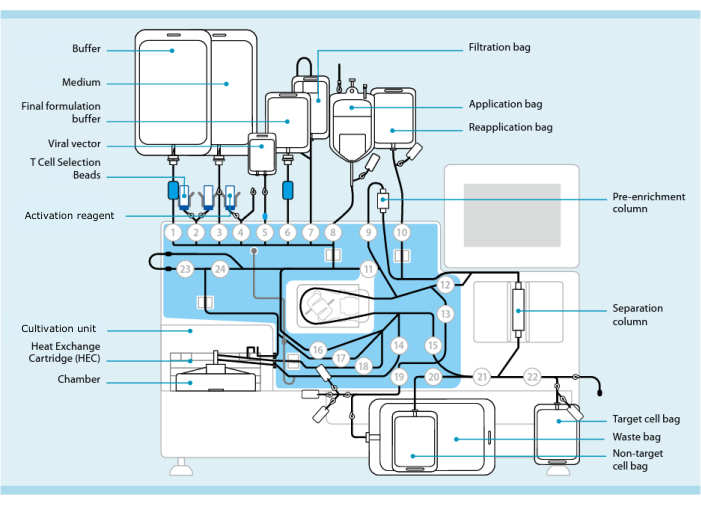
Abbildung 1: Herstellung von CAR-T-Zellen mit dem T-Zell-Transduktionssystem. Abgebildet ist der Prozessor mit dem installierten Schlauchset. Das Schlauchset ermöglicht den Anschluss anderer Komponenten wie Beutel mit Verarbeitungspuffer, Nährmedium und lentiviralem Vektor durch steriles Schweißen. Sobald das Leukaphereseprodukt in den Anwendungsbeutel gegeben wurde, kann es mit T-Zell-Auswahlperlen markiert, durch die Separationsspalte geleitet und dann in den Wiederaufnahmebeutel überführt werden. Die ausgewählten Zellen werden dann zur Kultivierung an die Kultivierungseinheit des Instruments geleitet und mit dem Aktivierungsreagenz aktiviert (siehe Materialtabelle). Das Endprodukt wird im Target-Zellbeutel gesammelt. Während des gesamten Prozesses ist es möglich, Proben zur Qualitätskontrolle aseptisch zu entnehmen. Graue Zahlen innerhalb von Kreisen stellen die nummerierten Ventile am Prozessor dar, die den Flüssigkeitsweg durch den Schlauchsatz leiten. Vervielfältigung mit freundlicher Genehmigung von 11. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
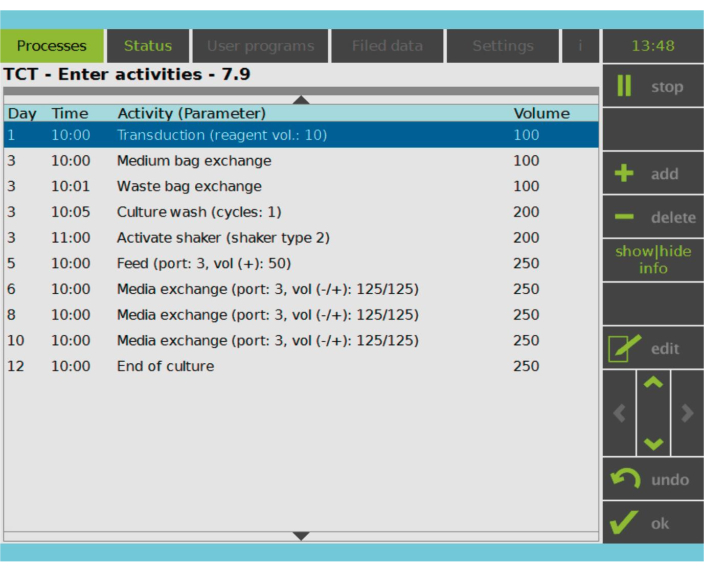
Abbildung 2: Aktivitätsmatrix. Nach der Auswahl und Aktivierung der T-Zellen ist der Rest des Herstellungsprozesses der CAR-T-Zellen vollständig anpassbar. Aktivitäten können hinzugefügt oder gelöscht und für den entsprechenden Tag und die entsprechende Uhrzeit geplant werden, und das Kulturvolumen nach der Aktivität kann angegeben werden (Volumen). Beispielsweise wurde die Transduktionsaktivität so konfiguriert, dass sie an Tag 1 um 10:00 Uhr beginnt, und das Kulturvolumen am Ende der Aktivität wurde auf 100 ml festgelegt. Die Aktivitätsmatrix kann während des gesamten Kultivierungszeitraums bearbeitet werden. Der Status des Prozesses kann auf dem integrierten Bildschirm des Verarbeitungsgeräts überwacht werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Das Ziel dieses Manuskripts ist es, einen detaillierten Überblick über die Herstellung von CAR-T-Zellen mit dem Prozessor zu geben und zusätzlich eine Anleitung zu den In-Prozess- und Produktfreigabetests zu geben, die wahrscheinlich von den Aufsichtsbehörden verlangt werden, um einen Antrag auf Zulassung eines neuen Prüfpräparats (IND) zu genehmigen. Das vorgestellte Protokoll bleibt nahe am empfohlenen Ansatz des Anbieters und ist das zugrunde liegende Protokoll für IND 28617, das derzeit in einer von einem Prüfarzt initiierten klinischen Phase-I/II-Studie evaluiert wird. Diese Studie zielt darauf ab, die Sicherheit und Wirksamkeit der Verwendung dieses Prozessors zur Herstellung humanisierter CD19-gerichteter autologer CAR-T-Zellen für Patienten mit akuter lymphatischer B-Zell-Leukämie (B-ALL) oder lymphoblastischem Lymphom der B-Linie (B-Lly) zu bestimmen [NCT05480449]. Die Studie startete im September 2022 und soll bis zu 89 Patienten im Alter von 0 bis 29 Jahren mit B-ALL oder B-Lly aufnehmen. Wir berichten über einige Herstellungsergebnisse aus dem Versuch im Manuskript.
Wir möchten darauf hinweisen, dass das Manuskript zwar als Protokoll mit zu befolgenden Schritten präsentiert wird, aber als Ausgangspunkt für andere betrachtet werden sollte, um mit der Optimierung ihres eigenen CAR-T-Zellherstellungsprozesses zu beginnen. Eine nicht erschöpfende Liste möglicher Variationen des vorgestellten Protokolls umfasst: Verwendung von frischen anstelle von kryokonservierten T-Zellen als Ausgangsmaterial; Verwendung einer anderen Methode der T-Zell-Anreicherung oder ganz Weglassen; Verwendung verschiedener Medien und Zytokincocktails wie IL7/IL15 anstelle von IL2; Variation der Konzentration des menschlichen AB-Serums oder ganz Weglassen; Zeitpunkt der Transduktion; Verwendung von “Multi-Hit”-Transduktionen; unterschiedliche Rührung, Kulturvolumen und Fütterungsplan; Verwendung verschiedener Methoden des genetischen Transfers, einschließlich der Elektroporation von Nukleinsäuren oder nicht-lentiviralen Vektoren; Verwendung eines anderen endgültigen Formulierungspuffers und/oder Kryoprotektivums; und die Infusion von CAR-T-Zellen frisch anstelle der Kryokonservierung für die Infusion zu einem späteren Zeitpunkt. Diese Schwankungen können einen signifikanten Einfluss auf die zelluläre Zusammensetzung und Wirksamkeit des therapeutischen Arzneimittels haben.
| Gesamter Prozessschritt | Tag des Prozesses | Technische Details | |||
| Anreicherung von Zellen | Tag 0 | Selektion von CD4+/CD8+ T-Zellen | |||
| Zellaktivierung | Aussaat und Aktivierung von T-Zellkulturen | ||||
| Zelltransduktion | Tag 1 | Lentivirale Transduktion (100 ml Kulturvolumen) | |||
| Zellexpansion (gefolgt von der Zellformulierung) | Tag 2 | — | |||
| Tag 3 | Culture Wash (1 Zyklus); Shaker aktiviert; Das Kulturvolumen erhöht sich auf 200 ml | ||||
| Tag 4 | — | ||||
| Tag 5 | Futter (50 ml); Das Kulturvolumen erreicht ein Endvolumen von 250 ml | ||||
| Tag 6 | In-Prozess-Probe; Medienaustausch (-125 mL / +125 mL) | ||||
| Tag 7 | Medienwechsel (-150 mL / +150 mL) oder Ernte | ||||
| Tag 8 | In-Prozess-Probe; Medienwechsel (-150 mL / +150 mL) oder Ernte | ||||
| Tag 9 | Medienaustausch (-180 mL / +180 mL) oder Ernte | ||||
| Tag 10 | In-Prozess-Probe; Medienaustausch (-180 mL / +180 mL) oder Ernte | ||||
| Tag 11 | Medienaustausch (-180 mL / +180 mL) oder Ernte | ||||
| Tag 12 | Medienaustausch (-180 mL / +180 mL) oder Ernte | ||||
| Tag 13 | Ernte | ||||
Tabelle 1: Prozesszeitplan und Übersicht. Diese Tabelle fasst die TCT-Prozessschritte zusammen, die in einer aktuellen klinischen Studie eingesetzt werden [NCT05480449]. Der Prozess beginnt mit der Anreicherung der T-Zellen durch CD4+/CD8+-Selektion, Kulturimpfung und Aktivierung an Tag 0, gefolgt von der Transduktion an Tag 1. Die Zellen ruhen 48 Stunden lang, gefolgt von einer Kulturwäsche, einer Erhöhung des Kulturvolumens auf 200 ml und Rühren mit einem Schüttelmechanismus. Am 6. Tag wird die erste In-Prozess-Probe entnommen. Die Zellentnahme erfolgt, sobald genügend Zellen für mindestens drei volle Dosen CAR-T-Zellen (5 × 10 6 CAR-T-Zellen/kg, wenn der Patient <50 kg wiegt, ansonsten 2,5 × 108 CAR-T-Zellen) und Qualitätskontrolltests (~2 × 106 CAR-T-Zellen) zur Verfügung stehen; oder wenn die Kultur insgesamt 4-5 x 109 Zellen erreicht hat. Abkürzungen: TCT = T-Zell-Transduktion; CAR-T = chimäre Antigenrezeptor-T-Zellen; MACS = magnetisch aktivierte Zellsortierung.
Protocol
Representative Results
Discussion
Die CAR-T-Zelltherapie hat sich zu einem vielversprechenden Behandlungsansatz für B-Zell- und andere Malignome entwickelt. Herkömmliche Herstellungsmethoden für CAR-T-Zellen weisen jedoch mehrere Einschränkungen auf, wie z. B. hohe Kosten, arbeitsintensive Produktion und offene Schritte, die das Kontaminationsrisiko erhöhen. In jüngster Zeit sind mehrere halbautomatische Plattformen, darunter der Miltenyi CliniMACS Prodigy (der “Prozessor”), aufgetaucht, um diese Einschränkungen zu beheben. Der T-Zell-Transduktion…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Die Autoren möchten die Beiträge mehrerer Personen und Organisationen zu dieser Arbeit würdigen. Das Cell and Gene Therapy Laboratory und das Penn Translational and Correlative Studies Laboratory leisteten wertvolle Unterstützung bei der Prozessentwicklung und Vorbereitung für IND-Einreichungen. Melissa Varghese und Amanda DiNofia trugen zur Prozessentwicklung und Vorbereitung der IND-Einreichungen bei, die diesem Manuskript zugrunde liegen. Diese Arbeit wurde durch einen Acceleration Grant der Cell and Gene Therapy Collaborative des Children’s Hospital of Philadelphia unterstützt. Die Autoren bedanken sich auch bei Miltenyi Biotec für die technische und wissenschaftliche Unterstützung. Abbildung 1 unterliegt dem Copyright © 2023 Miltenyi Biotec B.V. & Co. KG; Alle Rechte vorbehalten.
Materials
| 12 x 75 borosilicate tubes | Charles River | TL1000 | |
| 20 mL Reagent Bag | Miltenyi Biotec | 170-076-631 | |
| 50 mL Conical Tube | Fisher | 05-539-10 | |
| 150 mL Transfer Set | Fenwal | 4R2001 | |
| 2,000 mL Transfer Set | Fenwal | 4R2041 | |
| 7AAD | Fisher Scientific | BDB559925 | |
| Alcohol Prep | Tyco/Healthcare | ||
| Bag Access | Medline | 2300E-0500 | |
| CD19 APC-Vio770 REAfinity | Miltenyi Biotec | 130-113-643 | |
| CD19 CAR Detection Reagent Biotin | Miltenyi Biotec | 130-129-550 | |
| CD19 PE | BD | 555413 | |
| CD3 APC | BD | 340440 | |
| CD4 VioBright FITC REAfinity | Miltenyi Biotec | 130-113-229 | |
| CD45 VioBlue REAfinity | Miltenyi Biotec | 130-110-637 | |
| CD8 APC-Vio770 REAfinity | Miltenyi Biotec | 130-110-681 | |
| Cellometer Reference Beads 10um | Nexcelom | B10-02-020 | |
| Cellometer Reference Beads 15um | Nexcelom | B15-02-010 | |
| Cellometer Reference Beads 5um | Nexcelom | B05-02-050 | |
| Cellometer Slides | Nexcelom | CHT4-SD100-002 | |
| CliniMACS CD4 GMP MicroBeads | Miltenyi Biotec | 276-01 | The CD4 reagent |
| CliniMACS CD8 GMP MicroBeads | Miltenyi Biotec | 275-01 | The CD8 reagent |
| CliniMACS PBS/EDTA Buffer | Miltenyi Biotec | 130-021-201 | The buffer |
| DMSO | Origen | CP-10 | |
| Freezing Bag 50 mL | Miltenyi Biotec | 200-074-400 | |
| Freezing Vial, 1.8 mL | Nunc | 12565171N | |
| Freezing Vial, 4.5 mL | Nunc | 12565161N | |
| Human AB serum | Valley Biomedical | Sterile filtered, heat inactivated | |
| Human Serum Albumin 25% | Grifols | 68516-5216-1 | |
| Human Serum Albumin 5% | Grifols | 68516-5214-1 | |
| MACS GMP Recombinant Human IL-2 | Miltenyi Biotec | 170-076-148 | The cytokines |
| MACS GMP T Cell TransAct | Miltenyi Biotec | 200-076-202 | The activation reagent |
| MycoSeq Mycoplasma Detection Kit | Life Technologies | 4460623 | |
| Needles, Hypodermic 14G | Medline | SWD200573 | |
| Needles, SlideSafe 18G | BD | B-D305918 | |
| Pipet tips, 2-200 μL, individually wrapped | Eppendorf | 022492209 | |
| Pipet tips, 50-1000 μL, individually wrapped | Eppendorf | 022492225 | |
| Pipets 10 mL | Fisher | 13-678-27F | |
| Pipets 25 mL | Fisher | 13-675-30 | |
| Pipets 5 mL | Fisher | 13-678-27E | |
| Plasmalyte-A | Baxter | 2B2544X | The electrolyte solution |
| Prodigy TS520 Tubing Set | Miltenyi Biotec | 170-076- 600 | The tubing set |
| Sterile Field | Medline | NON21001 | |
| Streptavidin PE-Vio770 | Miltenyi Biotec | 130-106-793 | |
| Syringe 1 mL | BD | 309628 | |
| Syringe 10 mL | BD | 302995 | |
| Syringe 3 mL | BD | 309657 | |
| Syringe 30 mL | BD | 302832 | |
| Syringe 50 mL | BD | 309653 | |
| TexMACS GMP Medium | Miltenyi Biotec | 170-076-306 | The medium |
| Triple Sampling Adapter | Miltenyi Biotec | 170-076-609 | |
| Viral Vector | CHOP Clinical Vector Core | huCART19 | |
| Equipment | |||
| Biological Safety Cabinet | The Baker Co | ||
| Cellometer Auto 2000 | Nexcelom | ||
| CliniMACS Prodigy | Miltenyi Biotec | 200-075-301 | The processor |
| Controlled Rate Freezer | Planer/Kryosave | ||
| Endosafe nexgen-PTS150K | Charles River | ||
| Mettler Balance | Mettler | ||
| Refrigerated Centrifuge | Thermo Fisher | ||
| Refrigerated Centrifuge | Fisher Sci | ||
| SCD Sterile Tubing Welder | Terumo | ||
| Sebra Tube Sealer | Sebra | ||
| Varitherm | Barkey | The dry thaw device | |
| XN-330 Hematology Analyzer | Sysmex |
References
- Maude, S. L., et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. New England Journal of Medicine. 378 (5), 439-448 (2018).
- Shah, N. N., et al. Bispecific anti-CD20, anti-CD19 CAR T cells for relapsed B cell malignancies: A phase 1 dose escalation and expansion trial. Nature Medicine. 26 (10), 1569-1575 (2020).
- Maude, S. L., et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. New England Journal of Medicine. 371 (16), 1507-1517 (2014).
- Grupp, S. A., et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. New England Journal of Medicine. 368 (16), 1509-1518 (2013).
- Maude, S. L., et al. Efficacy of humanized CD19-targeted chimeric antigen receptor (CAR)-modified T cells in children and young adults with relapsed/refractory acute lymphoblastic leukemia. Blood. 128 (22), 217 (2016).
- Mock, U., et al. Automated manufacturing of CAR-T cells for adoptive immunotherapy using CliniMACS Prodigy. Cytotherapy. 18 (8), 1002-1011 (2016).
- Fernández, L., et al. GMP-compliant manufacturing of NKG2D CAR memory T cells using CliniMACS Prodigy. Frontiers in Immunology. 10 (10), 2361 (2019).
- Zhu, F., et al. Closed-system manufacturing of CD19 and dual-targeted CD20/19 chimeric antigen receptor T Cells using CliniMACS Prodigy device at an academic medical center. Cytotherapy. 20 (3), 394-406 (2018).
- Zhang, W., Jordan, K. R., Schulte, B., Purev, E. Characterization of clinical grade CD19 chimeric antigen receptor T cells produced using automated CliniMACS prodigy system. Drug Design, Development and Therapy. 12 (12), 3343-3356 (2018).
- Abou-El-Enein, M., et al. Scalable manufacturing of CAR T cells for cancer immunotherapy. Blood Cancer Discovery. 2 (5), 408-422 (2021).
- Miltenyi Biotec. . CliniMACS Prodigy User Manual. , (2021).
- Ghassemi, S., et al. Rapid manufacturing of non-activated potent CAR T cells. Nature Biomedical Engineering. 6 (2), 118-128 (2022).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Chemistry, manufacturing, and control (CMC) information for human gene therapy investigational new drug applications (INDs) guidance for industry. , (2020).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Considerations for the development of chimeric antigen receptor (CAR) T cell products draft guidance for industry. , (2022).

