自動セルプロセッサーでのキメラ抗原受容体T細胞製造
Summary
本稿では、臨床用のキメラ抗原受容体T細胞の製造プロセス、特にT細胞のウイルス形質導入および培養を行うことができる自動細胞プロセッサーの使用について詳述する。私たちは、初期段階の臨床試験のプロセス開発と実施中に考慮すべき推奨事項を提供し、落とし穴について説明します。
Abstract
キメラ抗原受容体(CAR)-T細胞は、さまざまな悪性および非悪性疾患の治療のための有望な免疫療法アプローチです。CAR-T細胞は遺伝子組み換えT細胞で、細胞表面の標的を認識して結合するキメラタンパク質を発現し、標的細胞を死滅させます。従来のCAR-T細胞の製造方法は、労働集約的で高価であり、汚染のリスクを伴う可能性があります。自動化された細胞プロセッサーであるCliniMACS Prodigyは、クローズドシステムで臨床スケールで細胞治療製品を製造することを可能にし、汚染のリスクを最小限に抑えます。処理はコンピュータの制御下で半自動的に行われるため、プロセスへの人間の関与が最小限に抑えられ、時間を節約し、ばらつきやエラーを減らします。
この原稿とビデオでは、このプロセッサーを使用してCAR-T細胞を製造するためのT細胞形質導入(TCT)プロセスについて説明します。TCTプロセスには、CD4+/CD8+ T細胞の濃縮、活性化、ウイルスベクターによる形質導入、増殖、および回収が含まれます。これらのステップの順序付けとタイミングを可能にする機能であるアクティビティマトリクスを使用して、TCTプロセスを広範囲にカスタマイズすることができます。現行の適正製造基準(cGMP)に準拠したCAR-T細胞製造のウォークスルーを提供し、治験薬(IND)申請をサポートするために必要なリリーステストと前臨床試験について説明します。臨床CAR-T細胞製造に半自動プロセスを使用することの実現可能性を実証し、長所と短所について説明します。最後に、小児B細胞悪性腫瘍を標的とする現在進行中の医師主導治験[NCT05480449]を、この製造プロセスを臨床現場でどのように適用できるかの例として説明します。
Introduction
キメラ抗原受容体(CAR)を発現するように操作されたT細胞の養子移植は、難治性B細胞悪性腫瘍患者の治療において顕著な有効性を示しています1,2,3,4,5。しかし、CAR-T細胞の従来の製造方法は、労働集約的で時間がかかり、高度に専門的な手順を実行するために高度な訓練を受けた技術者を必要とします。例えば、自家CAR-T細胞製剤の従来の製造プロセスでは、密度勾配遠心分離、水簸または磁気分離によるT細胞の濃縮、活性化、滅菌フラスコ内のウイルスベクターによる形質導入、回収および製剤化前のバイオリアクターでの増殖が含まれます。最近では、このプロセスを部分的に自動化することを目的としたさまざまなシステムが登場しています。例えば、Miltenyi CliniMACS Prodigy(以下、「プロセッサ」と呼ぶ)は、これらのステップの多くを自動化された方法で実行できる自動細胞処理デバイスである6,7,8,9。従来のCAR-T製造方法と自動化されたCAR-T製造方法の詳細な議論は、最近のレビュー記事10で紹介されています。
このプロセッサは、造血前駆細胞の処理用に米国食品医薬品局(FDA)が承認した医療機器であるCliniMACS Plusの機能に基づいて構築されています。プロセッサは、細胞の自動洗浄、分画、および培養を可能にする細胞培養ユニットを備えています(図1)。T細胞形質導入(TCT)プロセスは、手作業によるCAR-T細胞製造をほぼ再現するプロセッサデバイス内のプリセットプログラムです。TCTでは、グラフィカル・ユーザー・インターフェースを使用してカスタマイズ可能なセル処理が可能です(「アクティビティ・マトリックス」、 図2)。プロセッサは多くのステップを自動化し、複数のデバイスの機能を1台のマシンに統合するため、技術者によるトレーニングや専門的なトラブルシューティングスキルが少なくて済みます。すべてのステップは密閉されたシングルユースのチューブセット内で実行されるため、プロセッサは、オープンな製造プロセスで許容できると見なされるよりも厳格でない空気処理インフラストラクチャを備えた施設で操作できます。たとえば、ISOクラス8(EUグレードCに相当)として認定された施設でプロセッサを運用しています。
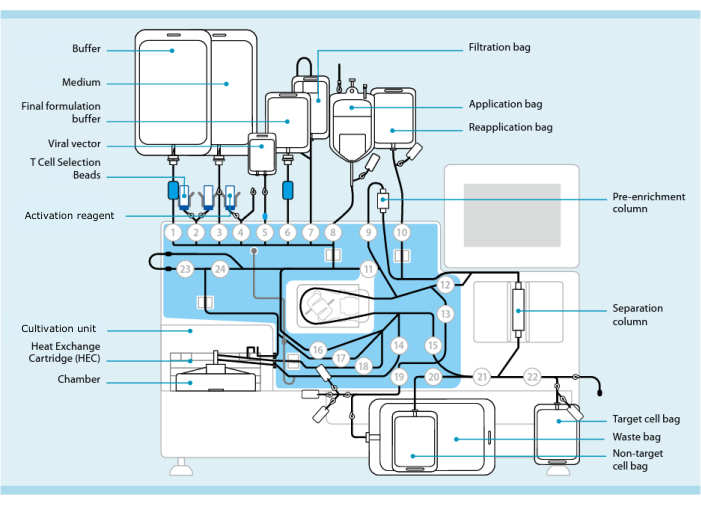
図1:T細胞形質導入システムを用いたCAR-T細胞の作製。 図は、チューブセットを取り付けたCPUです。チューブセットにより、処理バッファー、培地、レンチウイルスベクターを含むバッグなどの他のコンポーネントを滅菌溶接で接続できます。白血球アフェレーシス産物をアプリケーションバッグに加えると、T細胞選択ビーズで標識し、分離カラムに通してから、再アプリケーションバッグに移すことができます。次に、選択した細胞を培養用の機器の培養ユニットに向け、活性化試薬で活性化します( 材料表を参照)。最終産物はターゲットセルバッグに集められます。プロセス全体を通して、品質管理のためにサンプルを無菌的に除去することが可能です。円の内側の灰色の数字は、チューブセットに液体経路を通すプロセッサ上の番号付きバルブを表します。 11より許可を得て転載。この図の拡大版をご覧になるには、ここをクリックしてください。
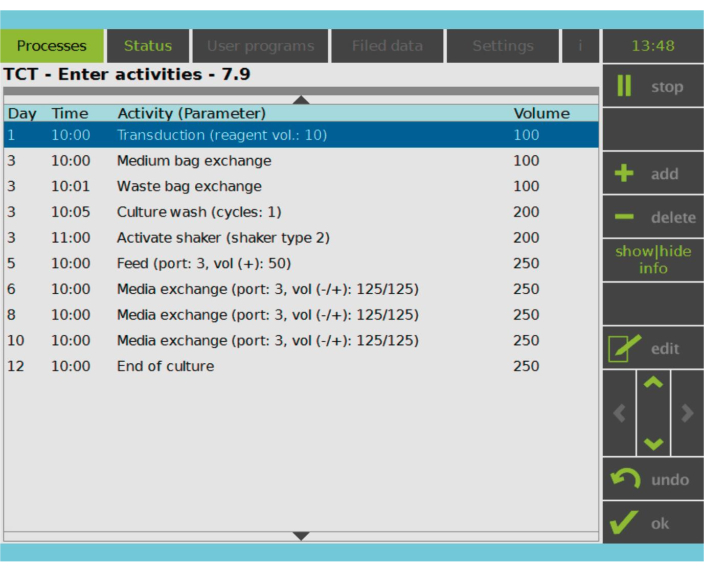
図2:アクティビティマトリクス T細胞の選択と活性化の後、CAR-T細胞製造プロセスの残りの部分は完全にカスタマイズ可能です。アクティビティの追加や削除、適切な日時のスケジュール設定が可能で、アクティビティ後の培養量(Volume)を指定できます。例えば、形質導入活性は、1日目の午前10:00に開始するように構成され、活性終了時の培養量は100mLとして設定されました。アクティビティマトリクスは、栽培期間中に編集することができます。プロセスの状態は、処理装置の統合画面で監視できます。 この図の拡大版をご覧になるには、ここをクリックしてください。
この原稿の目的は、プロセッサーを使用したCAR-T細胞の製造の詳細なウォークスルーを提供し、さらに、規制当局が治験薬(IND)申請を承認するために必要とする可能性のある工程内および製品リリース試験に関するガイダンスを提供することです。提示されたプロトコルは、ベンダーが推奨するアプローチに近いものであり、現在、単一施設の医師主導の第I/II相臨床試験で評価されているIND 28617の基礎となるプロトコルです。この試験は、このプロセッサを使用して、B細胞性急性リンパ芽球性白血病(B-ALL)またはB系統リンパ芽球性リンパ腫(B-Lly)の患者に対するヒト化CD19指向自家CAR-T細胞を製造することの安全性と有効性を判断することを目的としています[NCT05480449]。この試験は2022年9月に開始され、0歳から29歳のB-ALLまたはB-Llyの患者さん89人までを登録する予定です。試験の結果を原稿で報告します。
この原稿は、従うべき手順を含むプロトコルとして提示されていますが、他の人が独自のCAR-T細胞製造プロセスの最適化を開始するための出発点と見なされるべきであることを指摘したいと思います。提示されたプロトコルの可能なバリエーションの非包括的なリストには、次のものが含まれます:凍結保存されたT細胞の代わりに新鮮なT細胞を出発物質として使用する。T細胞濃縮の異なる方法を使用するか、またはそれを完全に省略する。IL2の代わりにIL7 / IL15などの異なる培地およびサイトカインカクテルを使用する。ヒトAB血清の濃度を変化させるか、またはそれを完全に省略する。形質導入のタイミング「マルチヒット」形質導入を使用する。さまざまな攪拌、培養量、および給餌スケジュール。核酸または非レンチウイルスベクターのエレクトロポレーションを含むさまざまな遺伝子導入方法を使用する。異なる最終製剤緩衝液および/または凍結保護剤を使用する。CAR-T細胞を凍結保存する代わりに、後で注入するために新鮮に注入します。これらの変動は、治療薬の細胞組成および効力に重大な影響を与える可能性がある。
| プロセス全体のステップ | プロセス日 | 製品仕様 | |||
| 細胞エンリッチメント | 0日目 | CD4+/CD8+ T細胞の選択 | |||
| 細胞の活性化 | T細胞培養の播種と活性化 | ||||
| 細胞形質導入 | 1日目 | レンチウイルス形質導入(培養量100 mL) | |||
| 細胞増殖(細胞の合成) | 2日目 | — | |||
| 3日目 | 培養洗浄(1サイクル);シェーカーが作動しました。培養容量が200 mLに増加 | ||||
| 4日目 | — | ||||
| 5日目 | フィード(50 mL);培養量が最終容量250 mLに達する | ||||
| 6日目 | インプロセスサンプル;培地交換 (-125 mL / +125 mL) | ||||
| 7日目 | 培地交換(-150 mL / +150 mL)またはハーベスト | ||||
| 8日目 | インプロセスサンプル;培地交換(-150 mL / +150 mL)またはハーベスト | ||||
| 9日目 | 培地交換(-180 mL / +180 mL)またはハーベスト | ||||
| 10日目 | インプロセスサンプル;培地交換(-180 mL / +180 mL)またはハーベスト | ||||
| 11日目 | 培地交換(-180 mL / +180 mL)またはハーベスト | ||||
| 12日目 | 培地交換(-180 mL / +180 mL)またはハーベスト | ||||
| 13日目 | 収穫 | ||||
表1:プロセスのタイムラインと概要。この表は、現在の臨床試験で採用されているTCTプロセスステップをまとめたものである[NCT05480449]。このプロセスは、CD4+/CD8+の選択、培養播種、および0日目の活性化によるT細胞濃縮から始まり、1日目に形質導入が続きます。細胞を48時間休ませた後、培養洗浄、培養容量を200mLに増やし、振とう機構を用いて撹拌します。6日目に、最初の工程内サンプルが採取されます。細胞は、少なくとも 3 回の全用量の CAR-T 細胞 (患者が < 50 kg の場合は 5 × 106 CAR-T 細胞/kg、それ以外の場合は 2.5 × 10 8 CAR-T 細胞) および品質管理試験 (~2 × 10 6 CAR-T 細胞) に十分な細胞が利用可能になったら回収します。または、培養物が合計4〜5 x 109細胞に達したら。略語:TCT = T細胞形質導入;CAR-T = キメラ抗原受容体T細胞;MACS = 磁気活性化セルソーティング。
Protocol
Representative Results
Discussion
CAR-T細胞療法は、B細胞やその他の悪性腫瘍に対する有望な治療アプローチとして浮上しています。しかし、従来のCAR-T細胞の製造方法には、高コスト、労働集約的な生産、汚染のリスクを高めるオープンステップなど、いくつかの制限があります。最近では、Miltenyi CliniMACS Prodigy(「プロセッサ」)を含むいくつかの半自動プラットフォームが登場し、これらの制限に対処しています。T細胞形質…
Disclosures
The authors have nothing to disclose.
Acknowledgements
著者らは、この研究に対するいくつかの個人および組織の貢献に感謝したいと思います。Cell and Gene Therapy LaboratoryとPenn Translational and Correlative Studies Laboratoryは、IND申請のためのプロセス開発と準備において貴重な支援を提供しました。Melissa Varghese と Amanda DiNofia は、この原稿の根底にある IND 提出のプロセス開発と準備に貢献しました。この研究は、フィラデルフィア小児病院の細胞・遺伝子治療共同の加速助成金の支援を受けました。また、Miltenyi Biotecの技術および研究支援にも感謝の意を表します。 図1 は、Copyright © 2023 Miltenyi Biotec B.V. & Co. KGによって保護されています。無断転載を禁じます。
Materials
| 12 x 75 borosilicate tubes | Charles River | TL1000 | |
| 20 mL Reagent Bag | Miltenyi Biotec | 170-076-631 | |
| 50 mL Conical Tube | Fisher | 05-539-10 | |
| 150 mL Transfer Set | Fenwal | 4R2001 | |
| 2,000 mL Transfer Set | Fenwal | 4R2041 | |
| 7AAD | Fisher Scientific | BDB559925 | |
| Alcohol Prep | Tyco/Healthcare | ||
| Bag Access | Medline | 2300E-0500 | |
| CD19 APC-Vio770 REAfinity | Miltenyi Biotec | 130-113-643 | |
| CD19 CAR Detection Reagent Biotin | Miltenyi Biotec | 130-129-550 | |
| CD19 PE | BD | 555413 | |
| CD3 APC | BD | 340440 | |
| CD4 VioBright FITC REAfinity | Miltenyi Biotec | 130-113-229 | |
| CD45 VioBlue REAfinity | Miltenyi Biotec | 130-110-637 | |
| CD8 APC-Vio770 REAfinity | Miltenyi Biotec | 130-110-681 | |
| Cellometer Reference Beads 10um | Nexcelom | B10-02-020 | |
| Cellometer Reference Beads 15um | Nexcelom | B15-02-010 | |
| Cellometer Reference Beads 5um | Nexcelom | B05-02-050 | |
| Cellometer Slides | Nexcelom | CHT4-SD100-002 | |
| CliniMACS CD4 GMP MicroBeads | Miltenyi Biotec | 276-01 | The CD4 reagent |
| CliniMACS CD8 GMP MicroBeads | Miltenyi Biotec | 275-01 | The CD8 reagent |
| CliniMACS PBS/EDTA Buffer | Miltenyi Biotec | 130-021-201 | The buffer |
| DMSO | Origen | CP-10 | |
| Freezing Bag 50 mL | Miltenyi Biotec | 200-074-400 | |
| Freezing Vial, 1.8 mL | Nunc | 12565171N | |
| Freezing Vial, 4.5 mL | Nunc | 12565161N | |
| Human AB serum | Valley Biomedical | Sterile filtered, heat inactivated | |
| Human Serum Albumin 25% | Grifols | 68516-5216-1 | |
| Human Serum Albumin 5% | Grifols | 68516-5214-1 | |
| MACS GMP Recombinant Human IL-2 | Miltenyi Biotec | 170-076-148 | The cytokines |
| MACS GMP T Cell TransAct | Miltenyi Biotec | 200-076-202 | The activation reagent |
| MycoSeq Mycoplasma Detection Kit | Life Technologies | 4460623 | |
| Needles, Hypodermic 14G | Medline | SWD200573 | |
| Needles, SlideSafe 18G | BD | B-D305918 | |
| Pipet tips, 2-200 μL, individually wrapped | Eppendorf | 022492209 | |
| Pipet tips, 50-1000 μL, individually wrapped | Eppendorf | 022492225 | |
| Pipets 10 mL | Fisher | 13-678-27F | |
| Pipets 25 mL | Fisher | 13-675-30 | |
| Pipets 5 mL | Fisher | 13-678-27E | |
| Plasmalyte-A | Baxter | 2B2544X | The electrolyte solution |
| Prodigy TS520 Tubing Set | Miltenyi Biotec | 170-076- 600 | The tubing set |
| Sterile Field | Medline | NON21001 | |
| Streptavidin PE-Vio770 | Miltenyi Biotec | 130-106-793 | |
| Syringe 1 mL | BD | 309628 | |
| Syringe 10 mL | BD | 302995 | |
| Syringe 3 mL | BD | 309657 | |
| Syringe 30 mL | BD | 302832 | |
| Syringe 50 mL | BD | 309653 | |
| TexMACS GMP Medium | Miltenyi Biotec | 170-076-306 | The medium |
| Triple Sampling Adapter | Miltenyi Biotec | 170-076-609 | |
| Viral Vector | CHOP Clinical Vector Core | huCART19 | |
| Equipment | |||
| Biological Safety Cabinet | The Baker Co | ||
| Cellometer Auto 2000 | Nexcelom | ||
| CliniMACS Prodigy | Miltenyi Biotec | 200-075-301 | The processor |
| Controlled Rate Freezer | Planer/Kryosave | ||
| Endosafe nexgen-PTS150K | Charles River | ||
| Mettler Balance | Mettler | ||
| Refrigerated Centrifuge | Thermo Fisher | ||
| Refrigerated Centrifuge | Fisher Sci | ||
| SCD Sterile Tubing Welder | Terumo | ||
| Sebra Tube Sealer | Sebra | ||
| Varitherm | Barkey | The dry thaw device | |
| XN-330 Hematology Analyzer | Sysmex |
References
- Maude, S. L., et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. New England Journal of Medicine. 378 (5), 439-448 (2018).
- Shah, N. N., et al. Bispecific anti-CD20, anti-CD19 CAR T cells for relapsed B cell malignancies: A phase 1 dose escalation and expansion trial. Nature Medicine. 26 (10), 1569-1575 (2020).
- Maude, S. L., et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. New England Journal of Medicine. 371 (16), 1507-1517 (2014).
- Grupp, S. A., et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. New England Journal of Medicine. 368 (16), 1509-1518 (2013).
- Maude, S. L., et al. Efficacy of humanized CD19-targeted chimeric antigen receptor (CAR)-modified T cells in children and young adults with relapsed/refractory acute lymphoblastic leukemia. Blood. 128 (22), 217 (2016).
- Mock, U., et al. Automated manufacturing of CAR-T cells for adoptive immunotherapy using CliniMACS Prodigy. Cytotherapy. 18 (8), 1002-1011 (2016).
- Fernández, L., et al. GMP-compliant manufacturing of NKG2D CAR memory T cells using CliniMACS Prodigy. Frontiers in Immunology. 10 (10), 2361 (2019).
- Zhu, F., et al. Closed-system manufacturing of CD19 and dual-targeted CD20/19 chimeric antigen receptor T Cells using CliniMACS Prodigy device at an academic medical center. Cytotherapy. 20 (3), 394-406 (2018).
- Zhang, W., Jordan, K. R., Schulte, B., Purev, E. Characterization of clinical grade CD19 chimeric antigen receptor T cells produced using automated CliniMACS prodigy system. Drug Design, Development and Therapy. 12 (12), 3343-3356 (2018).
- Abou-El-Enein, M., et al. Scalable manufacturing of CAR T cells for cancer immunotherapy. Blood Cancer Discovery. 2 (5), 408-422 (2021).
- Miltenyi Biotec. . CliniMACS Prodigy User Manual. , (2021).
- Ghassemi, S., et al. Rapid manufacturing of non-activated potent CAR T cells. Nature Biomedical Engineering. 6 (2), 118-128 (2022).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Chemistry, manufacturing, and control (CMC) information for human gene therapy investigational new drug applications (INDs) guidance for industry. , (2020).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Considerations for the development of chimeric antigen receptor (CAR) T cell products draft guidance for industry. , (2022).

