자동화된 세포 프로세서에서 키메라 항원 수용체 T 세포 제조
Summary
이 기사에서는 임상용 키메라 항원 수용체 T 세포의 제조 공정, 특히 T 세포의 바이러스 transduction 및 배양을 수행할 수 있는 자동 세포 프로세서를 사용하는 공정에 대해 자세히 설명합니다. 우리는 권장 사항을 제공하고 초기 단계 임상 시험의 프로세스 개발 및 구현 중에 고려해야 할 함정을 설명합니다.
Abstract
키메라 항원 수용체(CAR)-T 세포는 다양한 악성 및 비악성 질환 치료를 위한 유망한 면역 치료 접근법을 나타냅니다. CAR-T 세포는 세포 표면 표적을 인식하고 결합하여 표적 세포를 죽이는 키메라 단백질을 발현하는 유전자 변형 T 세포입니다. 기존의 CAR-T 세포 제조 방법은 노동 집약적이고 비용이 많이 들며 오염 위험이 있을 수 있습니다. 자동화된 세포 프로세서인 CliniMACS Prodigy를 사용하면 폐쇄형 시스템에서 임상 규모로 세포 치료제를 제조할 수 있어 오염 위험을 최소화할 수 있습니다. 처리는 컴퓨터의 제어 하에 반자동으로 이루어지므로 프로세스에 대한 사람의 개입을 최소화하여 시간을 절약하고 변동성과 오류를 줄입니다.
이 원고와 비디오는 이 프로세서를 사용하여 CAR-T 세포를 제조하기 위한 T 세포 형질도입(TCT) 공정에 대해 설명합니다. TCT 과정에는 CD4+/CD8+ T 세포 농축, 활성화, 바이러스 벡터를 사용한 transduction, 확장 및 수확이 포함됩니다. 이러한 단계의 순서와 타이밍을 허용하는 기능인 활동 매트릭스를 사용하여 TCT 프로세스를 광범위하게 사용자 지정할 수 있습니다. 당사는 현행 우수제조관리기준(cGMP)을 준수하는 CAR-T 세포 제조에 대한 실무를 제공하고 임상시험용 신약(IND) 신청을 지원하는 필수 방출 테스트 및 전임상 실험에 대해 논의합니다. 임상 CAR-T 세포 제조를 위한 반자동 공정 사용의 타당성을 입증하고 장단점에 대해 논의합니다. 마지막으로, 소아 B세포 악성종양[NCT05480449]을 표적으로 하는 연구자 주도 임상시험을 이 제조 공정이 임상 환경에서 어떻게 적용될 수 있는지에 대한 예시로 설명합니다.
Introduction
키메라 항원 수용체(CAR)를 발현하도록 조작된 T 세포의 입양 이식은 난치성 B 세포 악성 종양 1,2,3,4,5 환자를 치료하는 데 놀라운 효능을 보여주었습니다. 그러나 CAR-T 세포의 전통적인 제조 방법은 노동 집약적이고 시간이 많이 소요되며 고도로 전문화된 단계를 수행하기 위해 고도로 훈련된 기술자가 필요합니다. 예를 들어, 자가 CAR-T 세포 제품의 기존 제조 공정에는 밀도 구배 원심분리, T 세포를 농축하기 위한 용출 또는 자기 분리, 멸균 플라스크에서 바이러스 벡터를 사용한 활성화 및 형질도입, 수확 및 제형 전에 바이오리액터에서의 팽창이 포함됩니다. 최근 이 프로세스를 부분적으로 자동화하는 것을 목표로 하는 다양한 시스템이 등장했습니다. 예를 들어, Miltenyi CliniMACS Prodigy(이하, “프로세서”라 칭함)는 자동화된 방식으로 이러한 단계들 중 많은 것을 수행할 수 있는 자동화된 세포 처리 장치이다(6,7,8,9). 전통적이고 자동화된 CAR-T 제조 방법에 대한 심층적인 논의는 최근 리뷰 기사10에 제시되어 있습니다.
이 프로세서는 조혈 전구 세포 처리를 위한 미국 식품의약국(FDA) 승인 의료 기기인 CliniMACS Plus의 기능을 기반으로 합니다. 이 프로세서에는 세포의 자동 세척, 분획 및 배양이 가능한 세포 배양 장치가 포함되어 있습니다(그림 1). T 세포 형질도입(TCT) 공정은 수동 CAR-T 세포 제조를 대부분 복제하는 프로세서 장치 내의 사전 설정 프로그램입니다. TCT를 사용하면 그래픽 사용자 인터페이스를 사용하여 사용자 정의 가능한 셀 처리가 가능합니다(“활동 매트릭스”, 그림 2). 프로세서는 많은 단계를 자동화하고 여러 장치의 기능을 하나의 기계로 통합하기 때문에 기술자의 교육과 전문 문제 해결 기술이 덜 필요합니다. 모든 단계가 폐쇄된 일회용 튜빙 세트 내에서 수행되기 때문에 프로세서는 개방형 제조 공정에 허용되는 것으로 간주되는 것보다 덜 엄격한 공기 처리 인프라가 있는 시설에서 작동할 수 있습니다. 예를 들어, ISO 클래스 8(EU 등급 C에 필적) 인증을 받은 시설에서 프로세서를 작동하고 있습니다.
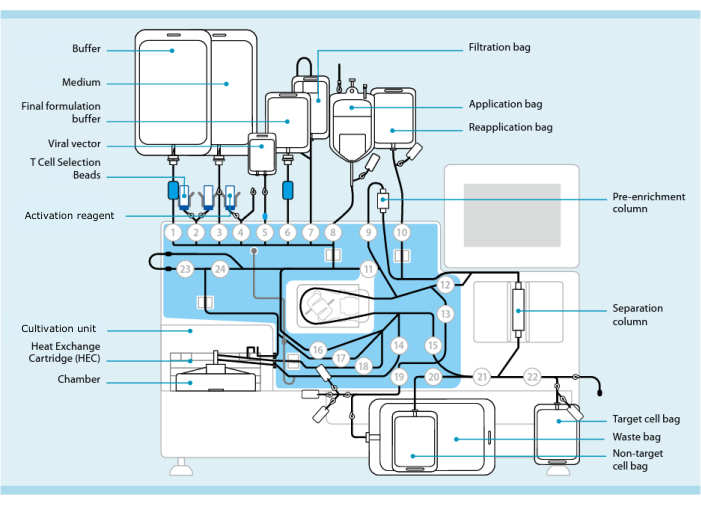
그림 1: T 세포 형질 도입 시스템을 사용한 CAR-T 세포 제조. 튜브 세트가 설치된 프로세서가 표시됩니다. 튜빙 세트를 사용하면 멸균 용접을 통해 처리 완충액, 배양 배지 및 렌티바이러스 벡터가 포함된 백과 같은 다른 구성 요소를 연결할 수 있습니다. 백혈구 채취 산물이 Application bag에 추가되면 T Cell Selection Beads로 라벨링하고 Separation column을 통과한 다음 Reapplication bag으로 옮길 수 있습니다. 그런 다음 선택된 세포는 배양용 기기의 배양 장치로 보내지고 활성화 시약으로 활성화됩니다(재료 표 참조). 최종 생성물은 Target cell bag에 수집됩니다. 공정 전반에 걸쳐 품질 관리를 위해 샘플을 무균으로 제거할 수 있습니다. 원 안의 회색 숫자는 튜빙 세트를 통해 액체 경로를 지시하는 프로세서의 번호가 매겨진 밸브를 나타냅니다. 11의 허가를 받아 복제했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
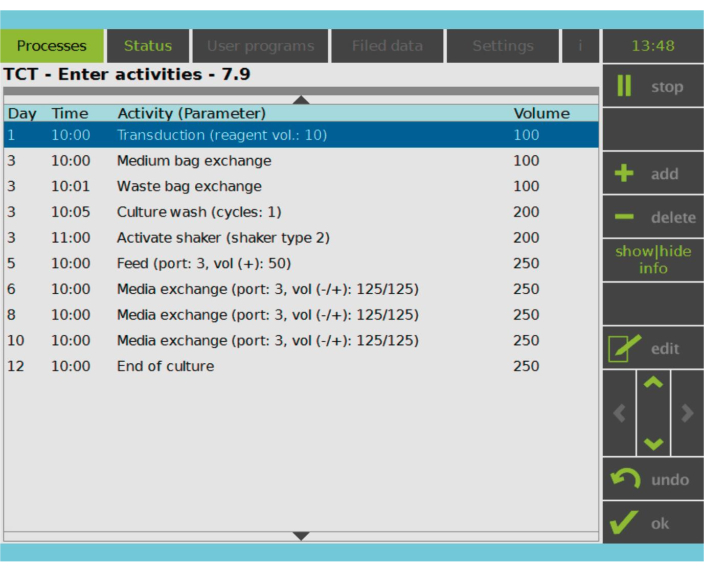
그림 2: 활동 매트릭스. T 세포 선택 및 활성화 후 CAR-T 세포 제조 공정의 나머지 부분은 완전히 맞춤화할 수 있습니다. 활동을 추가하거나 삭제할 수 있으며 적절한 날짜와 시간에 예약할 수 있으며 활동 이후의 문화권 볼륨(Volume)을 지정할 수 있습니다. 예를 들어, 형질도입 활성은 1일차 오전 10:00에 시작하도록 구성되었고, 활동 종료 시 배양 부피는 100mL로 설정되었습니다. 활동 매트릭스는 재배 기간 동안 편집할 수 있습니다. 프로세스 상태는 처리 장치의 통합 화면에서 모니터링할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
이 원고의 목적은 프로세서를 사용하여 CAR-T 세포를 제조하는 방법에 대한 자세한 설명을 제공하고 규제 기관이 임상시험용 신약(IND) 신청을 승인하는 데 필요할 수 있는 공정 중 및 제품 출시 테스트에 대한 지침을 추가로 제공하는 것입니다. 제시된 프로토콜은 공급업체가 권장하는 접근 방식에 가깝고 현재 단일 센터 연구자 주도 I/II 상 임상 시험에서 평가되고 있는 IND 28617의 기본 프로토콜입니다. 이 임상시험은 B 세포 급성 림프구성 백혈병(B-ALL) 또는 B 계통 림프구성 림프종(B-Lly) 환자를 위한 인간화 CD19 지향 자가 CAR-T 세포를 제조하기 위해 이 프로세서를 사용하는 것의 안전성과 효능을 결정하는 것을 목표로 합니다[NCT05480449]. 이 임상시험은 2022년 9월에 시작되었으며 B-ALL 또는 B-Lly에 0-29세 환자 최대 89명을 등록할 계획입니다. 우리는 원고에 시험의 일부 제조 결과를보고합니다.
원고는 따라야 할 단계가 포함된 프로토콜로 제시되었지만, 다른 사람들이 자신의 CAR-T 세포 제조 공정을 최적화하기 위한 출발점으로 간주되어야 한다는 점을 지적하고 싶습니다. 제시된 프로토콜에 대한 가능한 변이의 비포괄적 인 목록은 다음을 포함합니다 : 동결 보존 된 T 세포 대신 신선한 T 세포를 시작 물질로 사용; 다른 T 세포 농축 방법을 사용하거나 완전히 생략하는 단계; IL2 대신 IL7/IL15와 같은 다른 배지 및 사이토카인 칵테일을 사용합니다. 인간 AB 혈청의 농도를 변화시키거나 완전히 생략하는 것; 형질도입 시기; “multi-hit” transductions를 사용하여; 다양한 교반, 배양량 및 먹이 일정; 핵산 또는 비-렌티바이러스 벡터의 전기천공법을 포함하는 다양한 유전자 전달 방법을 사용하는 단계; 상이한 최종 제형 완충액 및/또는 동결 보호제를 사용하는 단계; 나중에 주입하기 위해 냉동 보관하는 대신 CAR-T 세포를 신선하게 주입합니다. 이러한 변화는 치료 제품의 세포 조성 및 효능에 상당한 영향을 미칠 수 있습니다.
| 전체 프로세스 단계 | 프로세스 데이 | 제품 상세 정보 | |||
| 세포 농축 | 0일차 | CD4+/CD8+ T 세포 선택 | |||
| 세포 활성화 | T 세포 배양 파종 및 활성화 | ||||
| 세포 형질도입(Cell Transduction) | 1일차 | 렌티바이러스 transduction(배양 용량 100mL) | |||
| 세포 확장(세포 제형 후) | 2일차 | — | |||
| 3일차 | 배양 세척(1 사이클); 셰이커가 활성화되었습니다. 배양 부피가 200mL로 증가 | ||||
| 4일차 | — | ||||
| 5일차 | 사료 (50 mL); 배양 용량이 최종 용량 250mL에 도달 | ||||
| 6일째 | 공정 중 샘플; 배지 교환(-125 mL / +125 mL) | ||||
| 7일째 | 배지 교환(-150 mL / +150 mL) 또는 수확 | ||||
| 8일째 | 공정 중 샘플; 배지 교환(-150 mL / +150 mL) 또는 수확 | ||||
| 9일째 | 배지 교환(-180 mL / +180 mL) 또는 채취 | ||||
| 10일째 | 공정 중 샘플; 배지 교환(-180 mL / +180 mL) 또는 채취 | ||||
| 11일째 | 배지 교환(-180 mL / +180 mL) 또는 채취 | ||||
| 12일째 | 배지 교환(-180 mL / +180 mL) 또는 채취 | ||||
| 13일째 | 수확 | ||||
표 1: 프로세스 타임라인 및 개요. 이 표는 현재 임상 시험에서 사용되는 TCT 프로세스 단계를 요약한 것입니다[NCT05480449]. 이 과정은 CD4+/CD8+ 선택에 의한 T 세포 농축, 배양 파종 및 0일차에 활성화로 시작되며, 1일차에 형질도입이 이어집니다. 세포를 48시간 동안 휴지시킨 후 배양 세척, 배양량을 200mL로 늘리고 진탕 메커니즘을 사용하여 교반합니다. 6일째에 첫 번째 공정 중 샘플을 채취합니다. 최소 3회 용량의 CAR-T 세포(환자가 <50kg인 경우 5 × 10 6 CAR-T 세포/kg, 그렇지 않으면 2.5 × 108 CAR-T 세포) 및 품질 관리 테스트(~2 × 106 CAR-T 세포)에 충분한 세포가 확보되면 세포를 채취합니다. 또는 배양이 총 4-5 x 109 세포에 도달하면. 약어: TCT = T 세포 형질도입; CAR-T = 키메라 항원 수용체 T 세포; MACS = 자기 활성화 세포 분류.
Protocol
Representative Results
Discussion
CAR-T 세포 치료제는 B세포 및 기타 악성 종양에 대한 유망한 치료법으로 부상했습니다. 그러나 기존의 CAR-T 세포 제조 방법은 높은 비용, 노동 집약적인 생산, 오염 위험을 증가시키는 개방형 단계 등 몇 가지 한계가 있습니다. 최근에는 이러한 한계를 해결하기 위해 Miltenyi CliniMACS Prodigy(이하 “프로세서”)를 비롯한 여러 반자동 플랫폼이 등장했습니다. 이 원고에 설명된 프로세서에 통합된 T 세포 형?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
저자들은 이 작업에 대한 여러 개인과 조직의 기여에 감사를 표하고자 합니다. 세포 및 유전자 치료 실험실(Cell and Gene Therapy Laboratory)과 펜실베이니아 중개 및 상관 연구 실험실(Penn Translational and Correlative Studies Laboratory)은 공정 개발 및 IND 제출 준비에 귀중한 지원을 제공했습니다. 멜리사 바르게세(Melissa Varghese)와 아만다 디노피아(Amanda DiNofia)는 이 원고의 기초가 되는 IND 제출을 위한 프로세스 개발 및 준비에 기여했습니다. 이 연구는 필라델피아 아동 병원의 세포 및 유전자 치료 협력 단체의 가속 보조금의 지원을 받았습니다. 저자들은 또한 기술 및 연구 지원에 대해 Miltenyi Biotec에 감사의 뜻을 전합니다. 그림 1 은 copyright © 2023 Miltenyi Biotec BV & Co. KG의 적용을 받습니다. 판권 소유.
Materials
| 12 x 75 borosilicate tubes | Charles River | TL1000 | |
| 20 mL Reagent Bag | Miltenyi Biotec | 170-076-631 | |
| 50 mL Conical Tube | Fisher | 05-539-10 | |
| 150 mL Transfer Set | Fenwal | 4R2001 | |
| 2,000 mL Transfer Set | Fenwal | 4R2041 | |
| 7AAD | Fisher Scientific | BDB559925 | |
| Alcohol Prep | Tyco/Healthcare | ||
| Bag Access | Medline | 2300E-0500 | |
| CD19 APC-Vio770 REAfinity | Miltenyi Biotec | 130-113-643 | |
| CD19 CAR Detection Reagent Biotin | Miltenyi Biotec | 130-129-550 | |
| CD19 PE | BD | 555413 | |
| CD3 APC | BD | 340440 | |
| CD4 VioBright FITC REAfinity | Miltenyi Biotec | 130-113-229 | |
| CD45 VioBlue REAfinity | Miltenyi Biotec | 130-110-637 | |
| CD8 APC-Vio770 REAfinity | Miltenyi Biotec | 130-110-681 | |
| Cellometer Reference Beads 10um | Nexcelom | B10-02-020 | |
| Cellometer Reference Beads 15um | Nexcelom | B15-02-010 | |
| Cellometer Reference Beads 5um | Nexcelom | B05-02-050 | |
| Cellometer Slides | Nexcelom | CHT4-SD100-002 | |
| CliniMACS CD4 GMP MicroBeads | Miltenyi Biotec | 276-01 | The CD4 reagent |
| CliniMACS CD8 GMP MicroBeads | Miltenyi Biotec | 275-01 | The CD8 reagent |
| CliniMACS PBS/EDTA Buffer | Miltenyi Biotec | 130-021-201 | The buffer |
| DMSO | Origen | CP-10 | |
| Freezing Bag 50 mL | Miltenyi Biotec | 200-074-400 | |
| Freezing Vial, 1.8 mL | Nunc | 12565171N | |
| Freezing Vial, 4.5 mL | Nunc | 12565161N | |
| Human AB serum | Valley Biomedical | Sterile filtered, heat inactivated | |
| Human Serum Albumin 25% | Grifols | 68516-5216-1 | |
| Human Serum Albumin 5% | Grifols | 68516-5214-1 | |
| MACS GMP Recombinant Human IL-2 | Miltenyi Biotec | 170-076-148 | The cytokines |
| MACS GMP T Cell TransAct | Miltenyi Biotec | 200-076-202 | The activation reagent |
| MycoSeq Mycoplasma Detection Kit | Life Technologies | 4460623 | |
| Needles, Hypodermic 14G | Medline | SWD200573 | |
| Needles, SlideSafe 18G | BD | B-D305918 | |
| Pipet tips, 2-200 μL, individually wrapped | Eppendorf | 022492209 | |
| Pipet tips, 50-1000 μL, individually wrapped | Eppendorf | 022492225 | |
| Pipets 10 mL | Fisher | 13-678-27F | |
| Pipets 25 mL | Fisher | 13-675-30 | |
| Pipets 5 mL | Fisher | 13-678-27E | |
| Plasmalyte-A | Baxter | 2B2544X | The electrolyte solution |
| Prodigy TS520 Tubing Set | Miltenyi Biotec | 170-076- 600 | The tubing set |
| Sterile Field | Medline | NON21001 | |
| Streptavidin PE-Vio770 | Miltenyi Biotec | 130-106-793 | |
| Syringe 1 mL | BD | 309628 | |
| Syringe 10 mL | BD | 302995 | |
| Syringe 3 mL | BD | 309657 | |
| Syringe 30 mL | BD | 302832 | |
| Syringe 50 mL | BD | 309653 | |
| TexMACS GMP Medium | Miltenyi Biotec | 170-076-306 | The medium |
| Triple Sampling Adapter | Miltenyi Biotec | 170-076-609 | |
| Viral Vector | CHOP Clinical Vector Core | huCART19 | |
| Equipment | |||
| Biological Safety Cabinet | The Baker Co | ||
| Cellometer Auto 2000 | Nexcelom | ||
| CliniMACS Prodigy | Miltenyi Biotec | 200-075-301 | The processor |
| Controlled Rate Freezer | Planer/Kryosave | ||
| Endosafe nexgen-PTS150K | Charles River | ||
| Mettler Balance | Mettler | ||
| Refrigerated Centrifuge | Thermo Fisher | ||
| Refrigerated Centrifuge | Fisher Sci | ||
| SCD Sterile Tubing Welder | Terumo | ||
| Sebra Tube Sealer | Sebra | ||
| Varitherm | Barkey | The dry thaw device | |
| XN-330 Hematology Analyzer | Sysmex |
References
- Maude, S. L., et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. New England Journal of Medicine. 378 (5), 439-448 (2018).
- Shah, N. N., et al. Bispecific anti-CD20, anti-CD19 CAR T cells for relapsed B cell malignancies: A phase 1 dose escalation and expansion trial. Nature Medicine. 26 (10), 1569-1575 (2020).
- Maude, S. L., et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. New England Journal of Medicine. 371 (16), 1507-1517 (2014).
- Grupp, S. A., et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. New England Journal of Medicine. 368 (16), 1509-1518 (2013).
- Maude, S. L., et al. Efficacy of humanized CD19-targeted chimeric antigen receptor (CAR)-modified T cells in children and young adults with relapsed/refractory acute lymphoblastic leukemia. Blood. 128 (22), 217 (2016).
- Mock, U., et al. Automated manufacturing of CAR-T cells for adoptive immunotherapy using CliniMACS Prodigy. Cytotherapy. 18 (8), 1002-1011 (2016).
- Fernández, L., et al. GMP-compliant manufacturing of NKG2D CAR memory T cells using CliniMACS Prodigy. Frontiers in Immunology. 10 (10), 2361 (2019).
- Zhu, F., et al. Closed-system manufacturing of CD19 and dual-targeted CD20/19 chimeric antigen receptor T Cells using CliniMACS Prodigy device at an academic medical center. Cytotherapy. 20 (3), 394-406 (2018).
- Zhang, W., Jordan, K. R., Schulte, B., Purev, E. Characterization of clinical grade CD19 chimeric antigen receptor T cells produced using automated CliniMACS prodigy system. Drug Design, Development and Therapy. 12 (12), 3343-3356 (2018).
- Abou-El-Enein, M., et al. Scalable manufacturing of CAR T cells for cancer immunotherapy. Blood Cancer Discovery. 2 (5), 408-422 (2021).
- Miltenyi Biotec. . CliniMACS Prodigy User Manual. , (2021).
- Ghassemi, S., et al. Rapid manufacturing of non-activated potent CAR T cells. Nature Biomedical Engineering. 6 (2), 118-128 (2022).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Chemistry, manufacturing, and control (CMC) information for human gene therapy investigational new drug applications (INDs) guidance for industry. , (2020).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Considerations for the development of chimeric antigen receptor (CAR) T cell products draft guidance for industry. , (2022).

