Производство Т-клеток химерного антигенного рецептора на автоматизированном клеточном процессоре
Summary
В этой статье подробно описан процесс производства Т-клеток с химерным антигенным рецептором для клинического использования, в частности, с использованием автоматизированного клеточного процессора, способного выполнять вирусную трансдукцию и культивирование Т-клеток. Мы даем рекомендации и описываем подводные камни, которые следует учитывать при разработке процесса и проведении ранней фазы клинического исследования.
Abstract
Химерные антигенные рецепторы (CAR)-Т-клетки представляют собой перспективный иммунотерапевтический подход для лечения различных злокачественных и доброкачественных заболеваний. CAR-T-клетки — это генетически модифицированные Т-клетки, которые экспрессируют химерный белок, который распознает и связывается с мишенью на поверхности клетки, что приводит к уничтожению клетки-мишени. Традиционные методы производства CAR-T-клеток являются трудоемкими, дорогостоящими и могут быть сопряжены с риском загрязнения. CliniMACS Prodigy, автоматизированный клеточный процессор, позволяет производить продукты клеточной терапии в клиническом масштабе в закрытой системе, сводя к минимуму риск загрязнения. Обработка происходит в полуавтоматическом режиме под контролем компьютера и таким образом минимизирует участие человека в процессе, что экономит время и снижает вариативность и ошибки.
В этой рукописи и видео описывается процесс трансдукции Т-клеток (TCT) для производства CAR-T-клеток с использованием этого процессора. Процесс ТСТ включает обогащение, активацию, трансдукцию вирусным вектором CD4+/CD8+ Т-клеток, экспансию и сбор CD4+/CD8+ Т-клеток. С помощью Activity Matrix, функциональности, которая позволяет упорядочивать и определять время выполнения этих шагов, процесс TCT может быть полностью настроен. Мы проводим экскурсию по производству CAR-T-клеток в соответствии с действующей надлежащей производственной практикой (cGMP) и обсуждаем необходимые испытания и доклинические эксперименты, которые будут поддерживать заявку на экспериментальное новое лекарственное средство (IND). Мы демонстрируем осуществимость и обсуждаем преимущества и недостатки использования полуавтоматического процесса для клинического производства CAR-T-клеток. Наконец, мы описываем продолжающееся клиническое исследование, инициированное исследователем, которое нацелено на злокачественные новообразования у детей [NCT05480449] в качестве примера того, как этот производственный процесс может быть применен в клинических условиях.
Introduction
Адоптивный перенос Т-клеток, сконструированных для экспрессии химерного антигенного рецептора (CAR), показал замечательную эффективность в лечении пациентов с рефрактерными В-клеточными злокачественными новообразованиями 1,2,3,4,5. Однако традиционные методы производства CAR-T-клеток являются трудоемкими, отнимают много времени и требуют высококвалифицированных технических специалистов для выполнения узкоспециализированных этапов. Например, традиционный процесс производства аутологичного CAR-T-клеточного продукта включает в себя центрифугирование с градиентом плотности, элютриацию или магнитную сепарацию для обогащения Т-клеток, активацию и трансдукцию вирусным вектором в стерильной колбе и расширение в биореакторе перед сбором и составлением рецептуры. В последнее время появились различные системы, которые нацелены на частичную автоматизацию этого процесса. Например, Miltenyi CliniMACS Prodigy (далее именуемый «процессор») представляет собой автоматизированное устройство для обработки клеток, которое может выполнять многие из этих шагов в автоматическом режиме 6,7,8,9. Подробное обсуждение традиционных и автоматизированных методов производства CAR-T представлено в недавней обзорной статье10.
Процессор основан на функциональности CliniMACS Plus, одобренного Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) медицинского устройства для обработки гемопоэтических клеток-предшественников. Процессор включает в себя блок культивирования клеток, который позволяет выполнять автоматизированную промывку, фракционирование и культивирование клеток (рис. 1). Процесс трансдукции Т-клеток (TCT) представляет собой предустановленную программу в процессорном устройстве, которая в значительной степени повторяет ручное производство CAR-T-клеток. TCT позволяет настраивать обработку ячеек с помощью графического пользовательского интерфейса («Матрица активности», рис. 2). Поскольку процессор автоматизирует множество шагов и консолидирует функциональность нескольких устройств в одной машине, он требует от технологов меньшего обучения и специализированных навыков поиска и устранения неисправностей. Поскольку все этапы выполняются в закрытом комплекте одноразовых трубок, процессор может эксплуатироваться на объектах с менее строгой инфраструктурой обработки воздуха, чем это считается приемлемым для открытого производственного процесса. Например, мы эксплуатируем процессор на предприятии, сертифицированном по классу ISO 8 (сопоставимо с классом C ЕС).
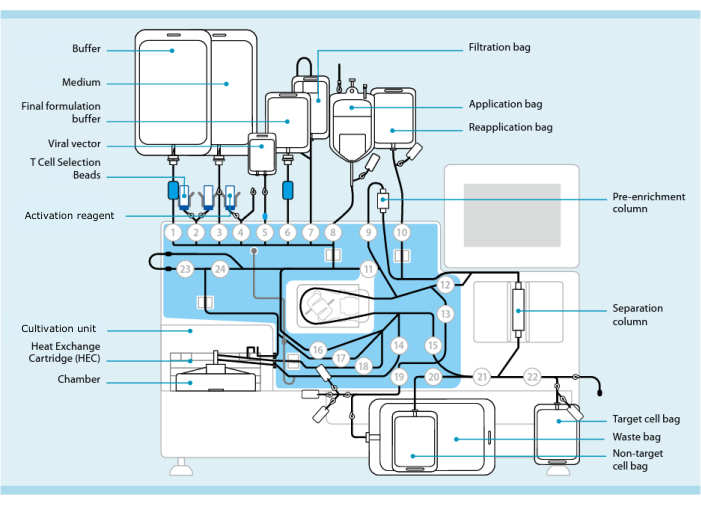
Рисунок 1: Производство CAR-T-клеток с использованием системы трансдукции Т-клеток. На рисунке показан процессор с установленным комплектом трубок. Комплект трубок позволяет соединять другие компоненты, такие как мешки, содержащие буфер для обработки, питательную среду и лентивирусный вектор, с помощью стерильной сварки. После того, как продукт для лейкафереза добавлен в пакет для нанесения, он может быть помечен гранулами для отбора Т-клеток, пропущен через колонку разделения, а затем перенесен в пакет для повторного нанесения. Затем отобранные клетки направляются в блок культивирования прибора для культивирования и активируются активационным реагентом (см. Таблицу материалов). Конечный продукт собирается в ячейковый мешок Target. На протяжении всего процесса возможен отбор образцов для контроля качества асептическим методом. Серые цифры внутри кругов обозначают пронумерованные клапаны на процессоре, которые направляют путь жидкости через комплект трубок. Воспроизведено с разрешения 11. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
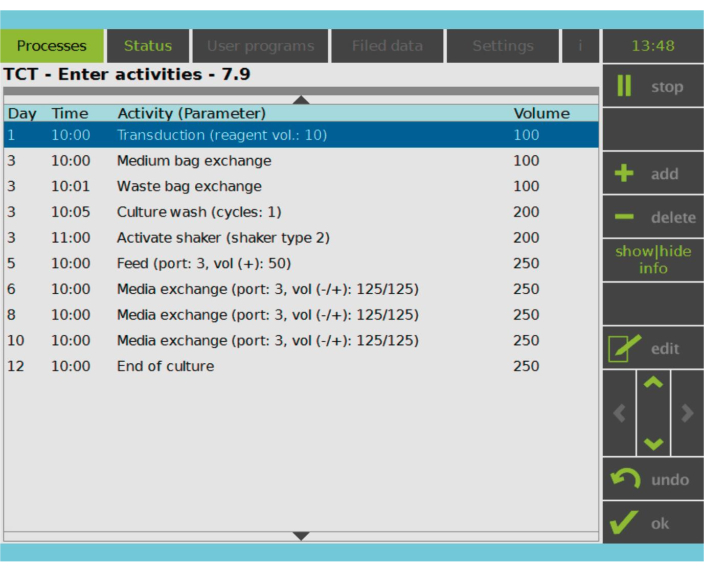
Рисунок 2: Матрица активности. После выбора и активации Т-клеток оставшаяся часть процесса производства CAR-T-клеток полностью настраивается. Действия могут быть добавлены или удалены и запланированы на соответствующий день и время, а также может быть указан объем культуры после действия (Volume). Например, упражнение «Трансдукция» было настроено на начало в 10:00 утра в 1-й день, а объем культивирования в конце упражнения был установлен равным 100 мл. Матрицу активности можно редактировать в течение всего периода выращивания. Состояние процесса можно отслеживать на встроенном экране обрабатывающего устройства. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Цель данной рукописи состоит в том, чтобы предоставить подробное описание производства CAR-T-клеток с использованием процессора, а также дать рекомендации по тестированию в процессе и выпуску продукта, которые, вероятно, потребуются регулирующим органам для одобрения заявки на исследуемый новый лекарственный препарат (IND). Представленный протокол близок к рекомендованному поставщиком подходу и является базовым протоколом для IND 28617, который в настоящее время оценивается в рамках одноцентрового клинического исследования I/II фазы, инициированного исследователем. Данное исследование направлено на определение безопасности и эффективности использования данного процессора для производства гуманизированных CD19-направленных аутологичных CAR-T-клеток у пациентов с В-клеточным острым лимфобластным лейкозом (B-ALL) или лимфобластной лимфомой линии B (B-Lly) [NCT05480449]. Исследование началось в сентябре 2022 года, и в нем планируется принять участие до 89 пациентов в возрасте от 0 до 29 лет с B-ALL или B-Lly. В рукописи мы приводим некоторые производственные результаты испытаний.
Мы хотели бы отметить, что, несмотря на то, что рукопись представлена в виде протокола с пошаговыми инструкциями, ее следует рассматривать как отправную точку для других людей, чтобы начать оптимизировать свой собственный процесс производства CAR-T-клеток. Неполный перечень возможных вариаций представленного протокола включает: использование в качестве исходного материала свежих вместо криоконсервированных Т-клеток; использование другого метода обогащения Т-клеток или его полное исключение; использование различных сред и цитокиновых коктейлей, таких как IL7/IL15 вместо IL2; варьирование концентрации АВ в сыворотке крови человека или ее полное исключение; время трансдукции; использование «многоударных» трансдукций; различное перемешивание, объемы культивирования и график кормления; использование различных методов генетического переноса, включая электропорацию нуклеиновых кислот или лентивирусных векторов; использование другого буфера для конечной рецептуры и/или криопротектора; и инфузия CAR-T-клеток в свежем виде вместо криоконсервации для инфузии в более позднее время. Эти вариации могут оказывать существенное влияние на клеточный состав и эффективность терапевтического препарата.
| Общий этап процесса | Процессуальный день | Технические детали | |||
| Обогащение клеток | День 0 | Выбор CD4+/CD8+ Т-клеток | |||
| Активация клеток | Посев и активация культуры Т-клеток | ||||
| Клеточная трансдукция | День 1 | Лентивирусная трансдукция (объем культивирования 100 мл) | |||
| Клеточная экспансия (с последующей клеточной формулировкой) | День 2 | — | |||
| День 3 | Культуральная промывка (1 цикл); Шейкер активирован; Объем культуры увеличивается до 200 мл | ||||
| День 4 | — | ||||
| День 5 | Корм (50 мл); Объем культуры достигает конечного объема 250 мл | ||||
| День 6 | Образец в процессе обработки; Обмен средами (-125 мл / +125 мл) | ||||
| День 7 | Обмен средами (-150 мл / +150 мл) или Harvest | ||||
| День 8 | Образец в процессе обработки; Обмен средами (-150 мл / +150 мл) или Harvest | ||||
| День 9 | Обмен средами (-180 мл / +180 мл) или Harvest | ||||
| День 10 | Образец в процессе обработки; Обмен средами (-180 мл / +180 мл) или Harvest | ||||
| День 11 | Обмен средами (-180 мл / +180 мл) или Harvest | ||||
| День 12 | Обмен средами (-180 мл / +180 мл) или Harvest | ||||
| День 13 | Урожай | ||||
Таблица 1: График и обзор процесса. В этой таблице обобщены этапы процесса TCT, используемые в текущем клиническом исследовании [NCT05480449]. Процесс начинается с обогащения Т-клеток путем отбора CD4+/CD8+, посева культуры и активации на 0-й день, за которым следует трансдукция в 1-й день. Клетки отдыхают в течение 48 ч с последующей промывкой культуры, увеличением объема культуры до 200 мл и перемешиванием с помощью встряхивающего механизма. На 6-й день отбирается первая проба в процессе производства. Забор клеток осуществляется при наличии достаточного количества клеток для получения по крайней мере трех полных доз CAR-T-клеток (5 × 10 6 CAR-T-клеток/кг, если пациент весит <50 кг, в противном случае 2,5 × 108 CAR-T-клеток) и контроля качества (~2 × 106 CAR-T-клеток); или после того, как культура достигнет в общей сложности 4-5 х 109 клеток. Сокращения: TCT = трансдукция Т-клеток; CAR-T = химерный антигенный рецептор Т-клеток; MACS = магнитно-активируемая сортировка клеток.
Protocol
Representative Results
Discussion
CAR-T-клеточная терапия стала перспективным подходом к лечению В-клеточных и других злокачественных новообразований. Однако традиционные методы производства CAR-T-клеток имеют ряд ограничений, таких как высокая стоимость, трудоемкое производство и открытые этапы, которые увеличивают рис…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Авторы выражают признательность нескольким лицам и организациям за вклад в эту работу. Лаборатория клеточной и генной терапии и Лаборатория трансляционных и коррелятивных исследований Пенсильванского университета оказали ценную помощь в разработке процессов и подготовке к подаче заявок на IND. Мелисса Варгезе (Melissa Varghese) и Аманда ДиНофиа (Amanda DiNofia) внесли свой вклад в разработку процесса и подготовку к подаче заявок на IND, которые легли в основу этой рукописи. Эта работа была поддержана грантом Acceleration Grant of the Cell and Gene Therapy Collaborative of the Children’s Hospital of Philadelphia. Авторы также хотели бы поблагодарить компанию Miltenyi Biotec за техническую и исследовательскую поддержку. На рисунок 1 распространяется авторское право © 2023 Miltenyi Biotec B.V. & Co. KG; Все права защищены.
Materials
| 12 x 75 borosilicate tubes | Charles River | TL1000 | |
| 20 mL Reagent Bag | Miltenyi Biotec | 170-076-631 | |
| 50 mL Conical Tube | Fisher | 05-539-10 | |
| 150 mL Transfer Set | Fenwal | 4R2001 | |
| 2,000 mL Transfer Set | Fenwal | 4R2041 | |
| 7AAD | Fisher Scientific | BDB559925 | |
| Alcohol Prep | Tyco/Healthcare | ||
| Bag Access | Medline | 2300E-0500 | |
| CD19 APC-Vio770 REAfinity | Miltenyi Biotec | 130-113-643 | |
| CD19 CAR Detection Reagent Biotin | Miltenyi Biotec | 130-129-550 | |
| CD19 PE | BD | 555413 | |
| CD3 APC | BD | 340440 | |
| CD4 VioBright FITC REAfinity | Miltenyi Biotec | 130-113-229 | |
| CD45 VioBlue REAfinity | Miltenyi Biotec | 130-110-637 | |
| CD8 APC-Vio770 REAfinity | Miltenyi Biotec | 130-110-681 | |
| Cellometer Reference Beads 10um | Nexcelom | B10-02-020 | |
| Cellometer Reference Beads 15um | Nexcelom | B15-02-010 | |
| Cellometer Reference Beads 5um | Nexcelom | B05-02-050 | |
| Cellometer Slides | Nexcelom | CHT4-SD100-002 | |
| CliniMACS CD4 GMP MicroBeads | Miltenyi Biotec | 276-01 | The CD4 reagent |
| CliniMACS CD8 GMP MicroBeads | Miltenyi Biotec | 275-01 | The CD8 reagent |
| CliniMACS PBS/EDTA Buffer | Miltenyi Biotec | 130-021-201 | The buffer |
| DMSO | Origen | CP-10 | |
| Freezing Bag 50 mL | Miltenyi Biotec | 200-074-400 | |
| Freezing Vial, 1.8 mL | Nunc | 12565171N | |
| Freezing Vial, 4.5 mL | Nunc | 12565161N | |
| Human AB serum | Valley Biomedical | Sterile filtered, heat inactivated | |
| Human Serum Albumin 25% | Grifols | 68516-5216-1 | |
| Human Serum Albumin 5% | Grifols | 68516-5214-1 | |
| MACS GMP Recombinant Human IL-2 | Miltenyi Biotec | 170-076-148 | The cytokines |
| MACS GMP T Cell TransAct | Miltenyi Biotec | 200-076-202 | The activation reagent |
| MycoSeq Mycoplasma Detection Kit | Life Technologies | 4460623 | |
| Needles, Hypodermic 14G | Medline | SWD200573 | |
| Needles, SlideSafe 18G | BD | B-D305918 | |
| Pipet tips, 2-200 μL, individually wrapped | Eppendorf | 022492209 | |
| Pipet tips, 50-1000 μL, individually wrapped | Eppendorf | 022492225 | |
| Pipets 10 mL | Fisher | 13-678-27F | |
| Pipets 25 mL | Fisher | 13-675-30 | |
| Pipets 5 mL | Fisher | 13-678-27E | |
| Plasmalyte-A | Baxter | 2B2544X | The electrolyte solution |
| Prodigy TS520 Tubing Set | Miltenyi Biotec | 170-076- 600 | The tubing set |
| Sterile Field | Medline | NON21001 | |
| Streptavidin PE-Vio770 | Miltenyi Biotec | 130-106-793 | |
| Syringe 1 mL | BD | 309628 | |
| Syringe 10 mL | BD | 302995 | |
| Syringe 3 mL | BD | 309657 | |
| Syringe 30 mL | BD | 302832 | |
| Syringe 50 mL | BD | 309653 | |
| TexMACS GMP Medium | Miltenyi Biotec | 170-076-306 | The medium |
| Triple Sampling Adapter | Miltenyi Biotec | 170-076-609 | |
| Viral Vector | CHOP Clinical Vector Core | huCART19 | |
| Equipment | |||
| Biological Safety Cabinet | The Baker Co | ||
| Cellometer Auto 2000 | Nexcelom | ||
| CliniMACS Prodigy | Miltenyi Biotec | 200-075-301 | The processor |
| Controlled Rate Freezer | Planer/Kryosave | ||
| Endosafe nexgen-PTS150K | Charles River | ||
| Mettler Balance | Mettler | ||
| Refrigerated Centrifuge | Thermo Fisher | ||
| Refrigerated Centrifuge | Fisher Sci | ||
| SCD Sterile Tubing Welder | Terumo | ||
| Sebra Tube Sealer | Sebra | ||
| Varitherm | Barkey | The dry thaw device | |
| XN-330 Hematology Analyzer | Sysmex |
References
- Maude, S. L., et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. New England Journal of Medicine. 378 (5), 439-448 (2018).
- Shah, N. N., et al. Bispecific anti-CD20, anti-CD19 CAR T cells for relapsed B cell malignancies: A phase 1 dose escalation and expansion trial. Nature Medicine. 26 (10), 1569-1575 (2020).
- Maude, S. L., et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. New England Journal of Medicine. 371 (16), 1507-1517 (2014).
- Grupp, S. A., et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. New England Journal of Medicine. 368 (16), 1509-1518 (2013).
- Maude, S. L., et al. Efficacy of humanized CD19-targeted chimeric antigen receptor (CAR)-modified T cells in children and young adults with relapsed/refractory acute lymphoblastic leukemia. Blood. 128 (22), 217 (2016).
- Mock, U., et al. Automated manufacturing of CAR-T cells for adoptive immunotherapy using CliniMACS Prodigy. Cytotherapy. 18 (8), 1002-1011 (2016).
- Fernández, L., et al. GMP-compliant manufacturing of NKG2D CAR memory T cells using CliniMACS Prodigy. Frontiers in Immunology. 10 (10), 2361 (2019).
- Zhu, F., et al. Closed-system manufacturing of CD19 and dual-targeted CD20/19 chimeric antigen receptor T Cells using CliniMACS Prodigy device at an academic medical center. Cytotherapy. 20 (3), 394-406 (2018).
- Zhang, W., Jordan, K. R., Schulte, B., Purev, E. Characterization of clinical grade CD19 chimeric antigen receptor T cells produced using automated CliniMACS prodigy system. Drug Design, Development and Therapy. 12 (12), 3343-3356 (2018).
- Abou-El-Enein, M., et al. Scalable manufacturing of CAR T cells for cancer immunotherapy. Blood Cancer Discovery. 2 (5), 408-422 (2021).
- Miltenyi Biotec. . CliniMACS Prodigy User Manual. , (2021).
- Ghassemi, S., et al. Rapid manufacturing of non-activated potent CAR T cells. Nature Biomedical Engineering. 6 (2), 118-128 (2022).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Chemistry, manufacturing, and control (CMC) information for human gene therapy investigational new drug applications (INDs) guidance for industry. , (2020).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Considerations for the development of chimeric antigen receptor (CAR) T cell products draft guidance for industry. , (2022).

