Fabricación de células T con receptor de antígeno quimérico en un procesador celular automatizado
Summary
En este artículo se detalla el proceso de fabricación de linfocitos T receptores de antígenos quiméricos para uso clínico, concretamente utilizando un procesador celular automatizado capaz de realizar la transducción viral y el cultivo de linfocitos T. Proporcionamos recomendaciones y describimos los escollos que deben tenerse en cuenta durante el desarrollo del proceso y la implementación de un ensayo clínico de fase inicial.
Abstract
Los linfocitos T con receptor de antígeno quimérico (CAR) representan un enfoque inmunoterapéutico prometedor para el tratamiento de diversas enfermedades malignas y no malignas. Las células CAR-T son células T modificadas genéticamente que expresan una proteína quimérica que reconoce y se une a una diana de la superficie celular, lo que provoca la muerte de la célula diana. Los métodos tradicionales de fabricación de células CAR-T requieren mucha mano de obra, son costosos y pueden conllevar el riesgo de contaminación. El CliniMACS Prodigy, un procesador celular automatizado, permite fabricar productos de terapia celular a escala clínica en un sistema cerrado, minimizando el riesgo de contaminación. El procesamiento se produce de forma semiautomática bajo el control de un ordenador y, por lo tanto, minimiza la participación humana en el proceso, lo que ahorra tiempo y reduce la variabilidad y los errores.
Este manuscrito y video describe el proceso de transducción de células T (TCT) para la fabricación de células CAR-T utilizando este procesador. El proceso TCT implica el enriquecimiento, la activación, la transducción con un vector viral, la expansión y la cosecha de células T CD4+/CD8+. Usando la Matriz de Actividades, una funcionalidad que permite ordenar y cronometrar estos pasos, el proceso TCT se puede personalizar ampliamente. Proporcionamos un recorrido por la fabricación de células CAR-T de conformidad con las Buenas Prácticas de Fabricación (cGMP) actuales y analizamos las pruebas de liberación requeridas y los experimentos preclínicos que respaldarán una solicitud de nuevo fármaco en investigación (IND). Demostramos la viabilidad y discutimos las ventajas y desventajas de utilizar un proceso semiautomático para la fabricación clínica de células CAR-T. Por último, describimos un ensayo clínico en curso iniciado por un investigador que se dirige a las neoplasias malignas de células B pediátricas [NCT05480449] como ejemplo de cómo se puede aplicar este proceso de fabricación en un entorno clínico.
Introduction
La transferencia adoptiva de linfocitos T modificados para expresar un receptor de antígeno quimérico (CAR) ha demostrado una eficacia notable en el tratamiento de pacientes con neoplasias malignas de linfocitos B refractarias 1,2,3,4,5. Sin embargo, los métodos tradicionales de fabricación de las células CAR-T requieren mucha mano de obra, mucho tiempo y técnicos altamente capacitados para llevar a cabo pasos altamente especializados. Por ejemplo, el proceso de fabricación tradicional de un producto autólogo de células CAR-T implica la centrifugación en gradiente de densidad, la elutriación o separación magnética para enriquecer las células T, la activación y transducción con un vector viral en un matraz estéril y la expansión en un biorreactor antes de la cosecha y la formulación. Recientemente han surgido varios sistemas que tienen como objetivo automatizar parcialmente este proceso. Por ejemplo, el Miltenyi CliniMACS Prodigy (en adelante, el “procesador”) es un dispositivo de procesamiento celular automatizado que puede realizar muchos de estos pasos de forma automatizada 6,7,8,9. En un reciente artículo de revisión10 se presenta un análisis en profundidad de los métodos de fabricación de CAR-T tradicionales y automatizados.
El procesador se basa en la funcionalidad de CliniMACS Plus, un dispositivo médico aprobado por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) para el procesamiento de células progenitoras hematopoyéticas. El procesador incluye una unidad de cultivo celular que permite el lavado, fraccionamiento y cultivo automatizado de células (Figura 1). El proceso de transducción de células T (TCT) es un programa preestablecido dentro del dispositivo procesador que replica en gran medida la fabricación manual de células CAR-T. TCT permite el procesamiento de celdas personalizable mediante una interfaz gráfica de usuario (la “Matriz de actividades”, Figura 2). Debido a que el procesador automatiza muchos pasos y consolida la funcionalidad de varios dispositivos en una sola máquina, requiere menos capacitación y habilidades especializadas de resolución de problemas por parte de los tecnólogos. Debido a que todos los pasos se realizan dentro de un conjunto de tubos cerrados de un solo uso, el procesador puede operarse en instalaciones con una infraestructura de manejo de aire menos estricta de lo que se consideraría aceptable para un proceso de fabricación abierto. Por ejemplo, estamos operando el procesador en una instalación certificada como ISO clase 8 (comparable al grado C de la UE).
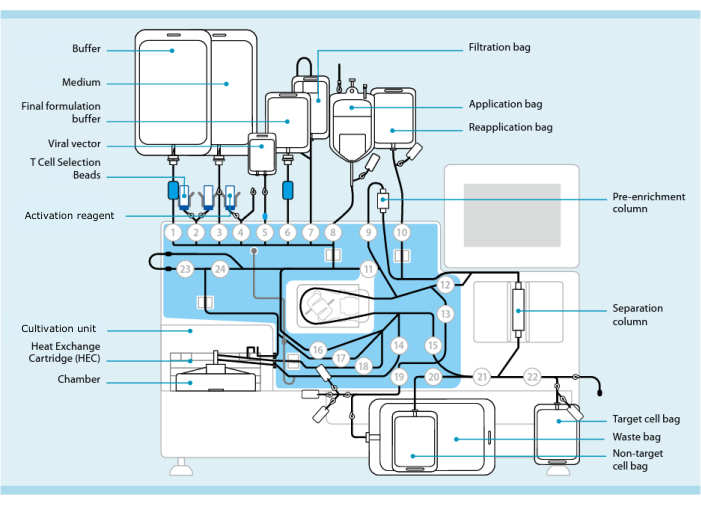
Figura 1: Fabricación de células CAR-T utilizando el sistema de transducción de células T. Se muestra el procesador con el juego de tubos instalado. El juego de tubos permite conectar otros componentes, como bolsas que contienen tampón de procesamiento, medio de cultivo y vector lentiviral mediante soldadura estéril. Una vez que el producto de leucoféresis se agrega a la bolsa de aplicación, se puede etiquetar con perlas de selección de células T, pasar a través de la columna de separación y luego transferirse a la bolsa de reaplicación. A continuación, las células seleccionadas se dirigen a la unidad de cultivo del instrumento para el cultivo y se activan con el reactivo de activación (véase la tabla de materiales). El producto final se recoge en la bolsa de células Target. A lo largo del proceso, es posible extraer muestras para el control de calidad de forma aséptica. Los números grises dentro de los círculos representan las válvulas numeradas en el procesador que dirigen la ruta del líquido a través del conjunto de tubos. Reproducido con permiso de 11. Haga clic aquí para ver una versión más grande de esta figura.
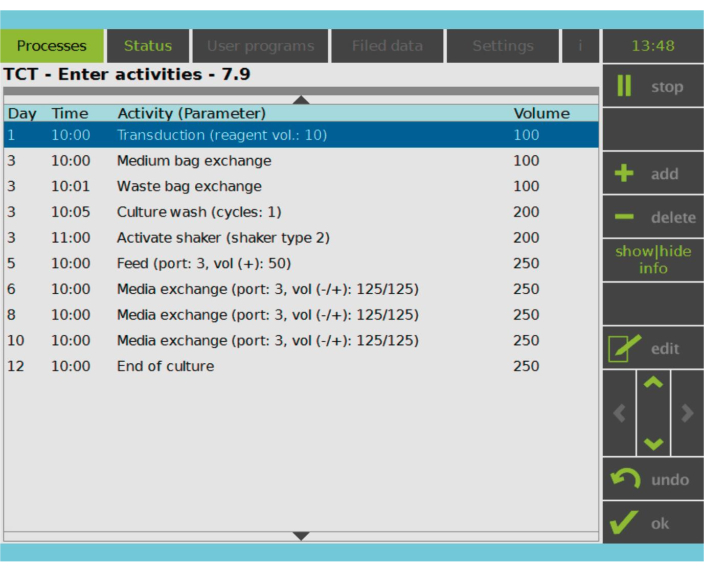
Figura 2: Matriz de actividades. Después de la selección y activación de las células T, el resto del proceso de fabricación de células CAR-T es totalmente personalizable. Las actividades se pueden agregar o eliminar y programar para el día y la hora adecuados, y se puede especificar el volumen de referencia cultural después de la actividad (Volumen). Por ejemplo, la actividad de transducción se configuró para comenzar a las 10:00 a.m. del día 1 y el volumen de cultivo al final de la actividad se estableció en 100 ml. La matriz de actividades se puede editar durante todo el período de cultivo. El estado del proceso se puede monitorear en la pantalla integrada del dispositivo de procesamiento. Haga clic aquí para ver una versión más grande de esta figura.
El objetivo de este manuscrito es proporcionar un recorrido detallado de la fabricación de células CAR-T utilizando el procesador y, además, proporcionar orientación sobre las pruebas en proceso y de liberación del producto que probablemente requerirán los reguladores para aprobar una solicitud de nuevo fármaco en investigación (IND). El protocolo presentado se mantiene cerca del enfoque recomendado por el proveedor y es el protocolo subyacente para IND 28617, que actualmente se está evaluando en un ensayo clínico de fase I/II iniciado por un investigador de un solo centro. Este ensayo tiene como objetivo determinar la seguridad y eficacia del uso de este procesador para fabricar células CAR-T autólogas humanizadas dirigidas a CD19 para pacientes con leucemia linfoblástica aguda de células B (LLA-B) o linfoma linfoblástico de linaje B (LLY-B) [NCT05480449]. El ensayo comenzó en septiembre de 2022 y está previsto que se inscriban hasta 89 pacientes de 0 a 29 años con LLA-B o B-Lly. En el manuscrito se presentan algunos resultados de fabricación del ensayo.
Nos gustaría señalar que, aunque el manuscrito se presenta como un protocolo con pasos a seguir, debe considerarse un punto de partida para que otros comiencen a optimizar su propio proceso de fabricación de células CAR-T. Una lista no exhaustiva de posibles variaciones del protocolo presentado incluye: el uso de células T frescas en lugar de criopreservadas como material de partida; usar un método diferente de enriquecimiento de células T u omitirlo por completo; el uso de diferentes medios y cócteles de citoquinas como IL7/IL15 en lugar de IL2; variar la concentración de suero AB humano u omitirla por completo; momento de la transducción; el uso de transducciones “multi-hit”; variación de la agitación, los volúmenes de cultivo y el programa de alimentación; el uso de diferentes métodos de transferencia genética, incluida la electroporación de ácidos nucleicos o vectores no lentivirales; utilizar un tampón de formulación final y/o crioprotector diferente; e infundir células CAR-T frescas en lugar de criopreservar para su infusión en un momento posterior. Estas variaciones pueden tener un impacto significativo en la composición celular y la potencia del producto terapéutico.
| Paso general del proceso | Día del Proceso | Técnicas | |||
| Enriquecimiento celular | Día 0 | Selección de linfocitos T CD4+/CD8+ | |||
| Activación celular | Siembra y activación de cultivos de células T | ||||
| Transducción celular | Día 1 | Transducción lentiviral (volumen de cultivo de 100 mL) | |||
| Expansión celular (seguida de formulación celular) | Día 2 | — | |||
| Día 3 | Lavado de cultivo (1 ciclo); Agitador activado; El volumen de cultivo aumenta a 200 mL | ||||
| Día 4 | — | ||||
| Día 5 | Alimentación (50 mL); El volumen de cultivo alcanza el volumen final de 250 mL | ||||
| Día 6 | Muestra en proceso; Intercambio de medios (-125 mL / +125 mL) | ||||
| Día 7 | Intercambio de medios (-150 mL / +150 mL) o Cosecha | ||||
| Día 8 | Muestra en proceso; Intercambio de medios (-150 mL / +150 mL) o Cosecha | ||||
| Día 9 | Intercambio de medios (-180 mL / +180 mL) o Cosecha | ||||
| Día 10 | Muestra en proceso; Intercambio de medios (-180 mL / +180 mL) o Cosecha | ||||
| Día 11 | Intercambio de medios (-180 mL / +180 mL) o Cosecha | ||||
| Día 12 | Intercambio de medios (-180 mL / +180 mL) o Cosecha | ||||
| Día 13 | Cosecha | ||||
Tabla 1: Cronograma y descripción general del proceso. Esta tabla resume los pasos del proceso de TCT empleados en un ensayo clínico actual [NCT05480449]. El proceso comienza con el enriquecimiento de las células T mediante la selección de CD4+/CD8+, la siembra del cultivo y la activación en el día 0, seguido de la transducción en el día 1. Las células descansan durante 48 h, seguidas de un lavado de cultivo, un aumento del volumen de cultivo a 200 ml y agitación mediante un mecanismo de agitación. El día 6, se toma la primera muestra en proceso. Las células se extraen una vez que se dispone de suficientes células para al menos tres dosis completas de células CAR-T (5 × 10 6 células CAR-T/kg si el paciente pesa <50 kg, de lo contrario, 2,5 × 108 células CAR-T) y pruebas de control de calidad (~2 × 106 células CAR-T); o una vez que el cultivo alcanza un total de 4-5 x 109 células. Abreviaturas: TCT = transducción de células T; CAR-T = linfocitos T receptores de antígenos quiméricos; MACS = clasificación de células activadas magnéticamente.
Protocol
Representative Results
Discussion
La terapia de células CAR-T se ha convertido en un enfoque de tratamiento prometedor para las células B y otras neoplasias malignas. Sin embargo, los métodos tradicionales de fabricación de células CAR-T tienen varias limitaciones, como el alto costo, la producción intensiva en mano de obra y los pasos abiertos que aumentan el riesgo de contaminación. Recientemente, han surgido varias plataformas semiautomatizadas, incluida Miltenyi CliniMACS Prodigy (el “procesador”), para abordar estas limitaciones. El proceso d…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Los autores desean reconocer las contribuciones de varias personas y organizaciones a este trabajo. El Laboratorio de Terapia Celular y Génica y el Laboratorio de Estudios Traslacionales y Correlativos de la Universidad de Pensilvania proporcionaron una valiosa asistencia en el desarrollo de procesos y la preparación para las presentaciones de IND. Melissa Varghese y Amanda DiNofia contribuyeron al proceso, desarrollo y preparación de las presentaciones de IND que subyacen a este manuscrito. Este trabajo fue apoyado por una Beca de Aceleración de la Colaboración de Terapia Celular y Génica del Hospital Infantil de Filadelfia. Los autores también quieren agradecer a Miltenyi Biotec su apoyo técnico y de investigación. La figura 1 está cubierta por los derechos de autor © 2023 Miltenyi Biotec B.V. & Co. KG; Todos los derechos reservados.
Materials
| 12 x 75 borosilicate tubes | Charles River | TL1000 | |
| 20 mL Reagent Bag | Miltenyi Biotec | 170-076-631 | |
| 50 mL Conical Tube | Fisher | 05-539-10 | |
| 150 mL Transfer Set | Fenwal | 4R2001 | |
| 2,000 mL Transfer Set | Fenwal | 4R2041 | |
| 7AAD | Fisher Scientific | BDB559925 | |
| Alcohol Prep | Tyco/Healthcare | ||
| Bag Access | Medline | 2300E-0500 | |
| CD19 APC-Vio770 REAfinity | Miltenyi Biotec | 130-113-643 | |
| CD19 CAR Detection Reagent Biotin | Miltenyi Biotec | 130-129-550 | |
| CD19 PE | BD | 555413 | |
| CD3 APC | BD | 340440 | |
| CD4 VioBright FITC REAfinity | Miltenyi Biotec | 130-113-229 | |
| CD45 VioBlue REAfinity | Miltenyi Biotec | 130-110-637 | |
| CD8 APC-Vio770 REAfinity | Miltenyi Biotec | 130-110-681 | |
| Cellometer Reference Beads 10um | Nexcelom | B10-02-020 | |
| Cellometer Reference Beads 15um | Nexcelom | B15-02-010 | |
| Cellometer Reference Beads 5um | Nexcelom | B05-02-050 | |
| Cellometer Slides | Nexcelom | CHT4-SD100-002 | |
| CliniMACS CD4 GMP MicroBeads | Miltenyi Biotec | 276-01 | The CD4 reagent |
| CliniMACS CD8 GMP MicroBeads | Miltenyi Biotec | 275-01 | The CD8 reagent |
| CliniMACS PBS/EDTA Buffer | Miltenyi Biotec | 130-021-201 | The buffer |
| DMSO | Origen | CP-10 | |
| Freezing Bag 50 mL | Miltenyi Biotec | 200-074-400 | |
| Freezing Vial, 1.8 mL | Nunc | 12565171N | |
| Freezing Vial, 4.5 mL | Nunc | 12565161N | |
| Human AB serum | Valley Biomedical | Sterile filtered, heat inactivated | |
| Human Serum Albumin 25% | Grifols | 68516-5216-1 | |
| Human Serum Albumin 5% | Grifols | 68516-5214-1 | |
| MACS GMP Recombinant Human IL-2 | Miltenyi Biotec | 170-076-148 | The cytokines |
| MACS GMP T Cell TransAct | Miltenyi Biotec | 200-076-202 | The activation reagent |
| MycoSeq Mycoplasma Detection Kit | Life Technologies | 4460623 | |
| Needles, Hypodermic 14G | Medline | SWD200573 | |
| Needles, SlideSafe 18G | BD | B-D305918 | |
| Pipet tips, 2-200 μL, individually wrapped | Eppendorf | 022492209 | |
| Pipet tips, 50-1000 μL, individually wrapped | Eppendorf | 022492225 | |
| Pipets 10 mL | Fisher | 13-678-27F | |
| Pipets 25 mL | Fisher | 13-675-30 | |
| Pipets 5 mL | Fisher | 13-678-27E | |
| Plasmalyte-A | Baxter | 2B2544X | The electrolyte solution |
| Prodigy TS520 Tubing Set | Miltenyi Biotec | 170-076- 600 | The tubing set |
| Sterile Field | Medline | NON21001 | |
| Streptavidin PE-Vio770 | Miltenyi Biotec | 130-106-793 | |
| Syringe 1 mL | BD | 309628 | |
| Syringe 10 mL | BD | 302995 | |
| Syringe 3 mL | BD | 309657 | |
| Syringe 30 mL | BD | 302832 | |
| Syringe 50 mL | BD | 309653 | |
| TexMACS GMP Medium | Miltenyi Biotec | 170-076-306 | The medium |
| Triple Sampling Adapter | Miltenyi Biotec | 170-076-609 | |
| Viral Vector | CHOP Clinical Vector Core | huCART19 | |
| Equipment | |||
| Biological Safety Cabinet | The Baker Co | ||
| Cellometer Auto 2000 | Nexcelom | ||
| CliniMACS Prodigy | Miltenyi Biotec | 200-075-301 | The processor |
| Controlled Rate Freezer | Planer/Kryosave | ||
| Endosafe nexgen-PTS150K | Charles River | ||
| Mettler Balance | Mettler | ||
| Refrigerated Centrifuge | Thermo Fisher | ||
| Refrigerated Centrifuge | Fisher Sci | ||
| SCD Sterile Tubing Welder | Terumo | ||
| Sebra Tube Sealer | Sebra | ||
| Varitherm | Barkey | The dry thaw device | |
| XN-330 Hematology Analyzer | Sysmex |
References
- Maude, S. L., et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. New England Journal of Medicine. 378 (5), 439-448 (2018).
- Shah, N. N., et al. Bispecific anti-CD20, anti-CD19 CAR T cells for relapsed B cell malignancies: A phase 1 dose escalation and expansion trial. Nature Medicine. 26 (10), 1569-1575 (2020).
- Maude, S. L., et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. New England Journal of Medicine. 371 (16), 1507-1517 (2014).
- Grupp, S. A., et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. New England Journal of Medicine. 368 (16), 1509-1518 (2013).
- Maude, S. L., et al. Efficacy of humanized CD19-targeted chimeric antigen receptor (CAR)-modified T cells in children and young adults with relapsed/refractory acute lymphoblastic leukemia. Blood. 128 (22), 217 (2016).
- Mock, U., et al. Automated manufacturing of CAR-T cells for adoptive immunotherapy using CliniMACS Prodigy. Cytotherapy. 18 (8), 1002-1011 (2016).
- Fernández, L., et al. GMP-compliant manufacturing of NKG2D CAR memory T cells using CliniMACS Prodigy. Frontiers in Immunology. 10 (10), 2361 (2019).
- Zhu, F., et al. Closed-system manufacturing of CD19 and dual-targeted CD20/19 chimeric antigen receptor T Cells using CliniMACS Prodigy device at an academic medical center. Cytotherapy. 20 (3), 394-406 (2018).
- Zhang, W., Jordan, K. R., Schulte, B., Purev, E. Characterization of clinical grade CD19 chimeric antigen receptor T cells produced using automated CliniMACS prodigy system. Drug Design, Development and Therapy. 12 (12), 3343-3356 (2018).
- Abou-El-Enein, M., et al. Scalable manufacturing of CAR T cells for cancer immunotherapy. Blood Cancer Discovery. 2 (5), 408-422 (2021).
- Miltenyi Biotec. . CliniMACS Prodigy User Manual. , (2021).
- Ghassemi, S., et al. Rapid manufacturing of non-activated potent CAR T cells. Nature Biomedical Engineering. 6 (2), 118-128 (2022).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Chemistry, manufacturing, and control (CMC) information for human gene therapy investigational new drug applications (INDs) guidance for industry. , (2020).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Considerations for the development of chimeric antigen receptor (CAR) T cell products draft guidance for industry. , (2022).

