Высококачественная подготовка ядер головного мозга и костного мозга для мультиомных одноядерных анализов
Summary
Успех транскриптомики одноклеточных/одноядерных и мультиомиксов во многом зависит от качества клеток/ядер. Поэтому выделение клеток/ядер из ткани и их очистка должны быть строго стандартизированы. Этот протокол описывает подготовку ядер головного мозга и костного мозга для последующего одноядерного мультиомного анализа.
Abstract
Одноклеточный анализ стал предпочтительным подходом для разгадки сложности биологических процессов, требующих оценки вариабельности индивидуальных клеточных реакций на лечение или инфекцию с одноклеточным разрешением.
За последние 10 лет было разработано множество методов молекулярного профилирования отдельных клеток, и несколько специализированных технологий были коммерциализированы. Каплеточное профилирование одиночных клеток 10X Genomics — это широко распространенная технология, которая предлагает готовые к использованию реагенты для транскриптомного и мультиомного профилирования одиночных клеток. Технология включает в себя рабочие процессы для секвенирования одноклеточной и одноядерной РНК (scRNA-Seq и snRNA-Seq соответственно), scATAC-Seq, одноклеточного иммунного профилирования (секвенирование BCR/TCR) и мультиома. Последний сочетает в себе транскрипционную (scRNA-Seq) и эпигенетическую (scATAC-Seq) информацию, поступающую из одной и той же клетки.
Качество (жизнеспособность, целостность, чистота) одноклеточных или одноядерных суспензий, выделенных из тканей и проанализированных любым из этих подходов, имеет решающее значение для получения высококачественных данных. Поэтому протоколы пробоподготовки должны быть адаптированы к особенностям каждой биологической ткани и обеспечивать получение высококачественных клеточных и ядерных суспензий.
В этой статье описаны два протокола подготовки образцов головного мозга и костного мозга для последующего конвейера multiome 10X Genomics. Протоколы выполняются поэтапно и охватывают диссоциацию тканей, сортировку клеток, выделение ядер и контроль качества готовой суспензии ядер, которая используется в качестве исходного материала для разделения клеток и штрихкодирования, подготовки библиотек и секвенирования. Эти стандартизированные протоколы позволяют создавать высококачественные библиотеки ядер, а также надежные и надежные данные.
Introduction
В течение многих лет одноклеточные методы были золотым стандартом анализа биологических процессов. Первоначально они были ограничены фенотипированием отдельных клеток с помощью микроскопии, проточной цитометрии и аналогичных анализов. Прорыв в анализе одиночных клеток произошел с разработкой подходов к молекулярному профилированию отдельных клеток, в частности секвенирования одноклеточной РНК (scRNA-Seq), позволившего охарактеризовать весь транскриптом отдельных клеток. Очень мощная scRNA-Seq генерирует информацию о транскрипционном статусе клетки в определенном состоянии и в определенный момент времени. Тем не менее, он не дает представления о регуляции генов, которые управляют транскрипцией, или о молекулярных модификациях, которые происходят с течением времени. Чтобы преодолеть это ограничение, было вложено много усилий в разработку одноклеточных мультиомиксных анализов, которые позволяют анализировать множество факторов и процессов, происходящих из одной и той же клетки 1,2,3,4. Первое успешное измерение двух модальностей в одиночных клетках было получено путем связывания мультиплексных паттернов экспрессии поверхностных белков с полным транскриптомом отдельных клеток в подходе CITE-Seq5. Более поздние эволюции сочетают экспрессию генов с доступностью хроматина (анализ на транспозазный хроматин с использованием секвенирования, ATAC-Seq), тем самым одновременно захватывая транскриптомные и эпигеномные модальности в одних и тех же клетках (например, sci-CAR)6. Первые коммерческие решения, позволившие ассоциировать транскриптомику с клеточным фенотипом или с эпигенетическими изменениями одной и той же клетки, были разработаны компанией 10X Genomics.
Эксперименты по молекулярному профилированию отдельных клеток включают следующие этапы: (1) диссоциация тканей или приготовление одноклеточных суспензий; (2) очистка клеток и/или выделение ядер; (3) секционирование и штрихкодирование; (4) библиотечное строительство и контроль качества; (5) секвенирование нового поколения; (6) Анализ данных. Хотя шаги (3)-(6) могут значительно различаться в зависимости от используемой технологии, начальные шаги, как правило, являются общими для всех них. Качество приготовленной суспензии клетка/ядро будет определять общий результат эксперимента. В зависимости от типа ткани получение высококачественных одноклеточных/ядерных суспензий может быть сложной задачей. Особенности некоторых тканей, таких как сердце, мышцы, мозг, легкие, кишечник и другие, требуют методов разрушения тканей и выделения ядер, адаптированных к каждому типу образца, чтобы гарантировать получение высококачественных ядер для молекулярного анализа 7,8,9,10 . Методы разрушения тканей и протоколы диссоциации могут быть механическими, ферментативными (например, смесь коллагеназ и ДНКазы) или их комбинацией, и могут выполняться вручную или с помощью инструментов (например, Qiagen DSC-400, gentleMACS).
Одноклеточные методы стали предпочтительным инструментом для биомедицинских исследований. В нейробиологии разнообразие клеток в головном мозге и сложность их функций требуют анализа с высоким разрешением и высокой пропускной способностью для визуализации редких клеточных популяций и оценки их гетерогенности 11,12,13,14. Связывание клеточной идентичности и механизмов регуляции генов отдельных клеток дает представление о развитии и физиологии мозга. Другим примером являются исследования иммунного ответа в контексте инфекционных, аутоиммунных или раковых заболеваний, которые в значительной степени основаны на анализе отдельных клеток. Гетерогенность субпопуляций иммунных клеток и сложность их активности и взаимодействия с другими типами клеток требуют разрешения отдельных клеток для расшифровки механизмов, лежащих в основе иммунного ответа. Иммунные клетки происходят из костного мозга, где гемопоэтические предшественники состоят из постепенно дифференцируемых клеток, которые приобретают и теряют маркеры клеточной поверхности в течение поэтапного процесса, прежде чем выйти из костного мозга в дом на периферии. Анализ отдельных клеток позволяет детально охарактеризовать стадии клеточного развития. Это может быть достигнуто с помощью фенотипирования одной клетки, традиционно выполняемого с помощью многопараметрической проточной цитометрии. Тем не менее, было показано, что транскриптомные сигнатуры одиночных клеток позволяют более точно идентифицировать подтипы клеток-предшественников, поскольку эти клетки распределены в кластерах, которые попадают друг в друга и, следовательно, могут быть неправильно идентифицированы при использовании метода маркеров грубой клеточной поверхности15. Все большее число исследований раскрывает эпигенетические модификации, которые гемопоэтические стволовые и прогениторные клетки (HSPC) могут приобретать при воздействии различных агентов, что приводит к значительному влиянию на долгосрочную чувствительность иммунной системы 16,17,18,19. Новые мультиомиксные технологии позволяют изучать эти процессы с одноклеточным разрешением.
Для образцов головного мозга 11,20,21,22 и образцов костного мозга23,24 описано множество протоколов выделения клеток и ядер. Для минимизации систематической ошибки, обусловленной экспериментальной изменчивостью, необходимо валидировать оптимизированные протоколы подготовки одноядерных ядер для совместного одноклеточного транскриптомного и эпигеномного секвенирования, тем самым обеспечивая воспроизводимость одноклеточных мультиомных анализов.
В данной работе описаны два надежных протокола подготовки ядер из (1) свежезамороженной ткани мозга и (2) свежих ГСПК костного мозга для последующего анализа одноклеточного мультиома (рис. 1).
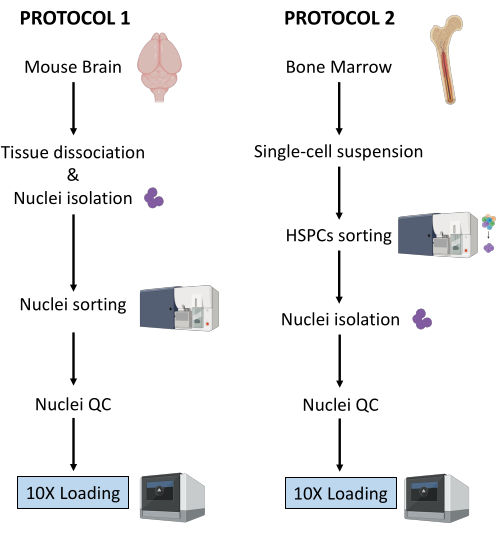
Рисунок 1: Схематическое изображение протоколов выделения ядер из свежезамороженных тканей головного мозга и костного мозга. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
Приготовление высококачественной клеточной или ядерной суспензии имеет решающее значение для успеха одноклеточного или одноядерного РНК-Seq и одноклеточного мультиомного анализа 29,30,31. Здесь мы описали протоколы пробоподготовки и выделения ядер для мультиомных анализов из двух типов тканей: головного мозга и костного мозга.
Протокол работы мозга, описанный в этой статье, позволяет извлекать высококачественные ядра из свежезамороженных тканей мозга. Он включает в себя следующие этапы: разрушение замороженных тканей, выделение ядер, очистка ядер и контроль качества подготовленного материала. Ткань мозга состоит из множества различных типов клеток, и процедура диссоциации тканей и выделения ядер должна сохранять пропорции клеточных популяций, присутствующие в исходной ткани. Здесь был оптимизирован состав лизисного буфера и время инкубации, чтобы обеспечить полный и щадящий лизис всех клеточных популяций, составляющих ткань.
Протокол HSPCs костного мозга несколько отличается, поскольку он требует одного дополнительного шага в начале эксперимента, чтобы выделить интересующую клеточную популяцию из гетерогенной клеточной суспензии. После забора свежей ткани эритроциты лизируются, и образец обогащается для интересующей подгруппы клеток. Клетки-мишени лизируются, ядра изолируют, а качество приготовленного материала контролирует.
10X Genomics предоставляет несколько протоколов, валидированных для выделения ядер в различных тканях32,33. Компания также выпускает на рынок набор для выделения ядер с простым конвейером для выделения ядер из валидированных тканей34. Однако эти протоколы нуждаются в дополнительной оптимизации, чтобы адаптировать особенности определенных образцов. В качестве примера можно привести примеры, требующие работы с малым количеством входных данных. Для этих образцов наиболее сложными этапами являются центрифугирование, которое должно быть достаточно строгим для очистки образца и достаточно щадящим, чтобы избежать потери клеток/ядер. В соответствии с протоколом, описанным здесь, мы адаптировали протокол 10X Genomics Demonstrated Protocol – Nuclei Isolation for Single Cell Multiome ATAC + GEX Sequencing (CG000365 – Rev C)27, чтобы найти тонкий баланс между этими двумя требованиями. Как показано на примере получения ядер из отсортированных ГСПЦ, мы улучшили извлечение ядер без ущерба для качества образца.
Дополнительной проблемой является стадия лизиса очищенных клеток для выделения ядер. Более жесткие условия лизиса и более длительный инкубационный период могут повредить ядра и тем самым повлиять на качество данных секвенирования. На рисунке 5 показана репрезентативная визуализация ядер из образцов костного мозга при различном времени инкубации с лизисным буфером и показано, насколько различным может быть состояние ядер в зависимости от лизиса клетки. На примере ГСПК мы определили 3-минутный лизис как условие, которое приводит к наибольшей доле здоровых, интактных ядер и наименьшей доле поврежденных ядер. Время инкубации лизиса должно быть оптимизировано для каждого нового типа образца.
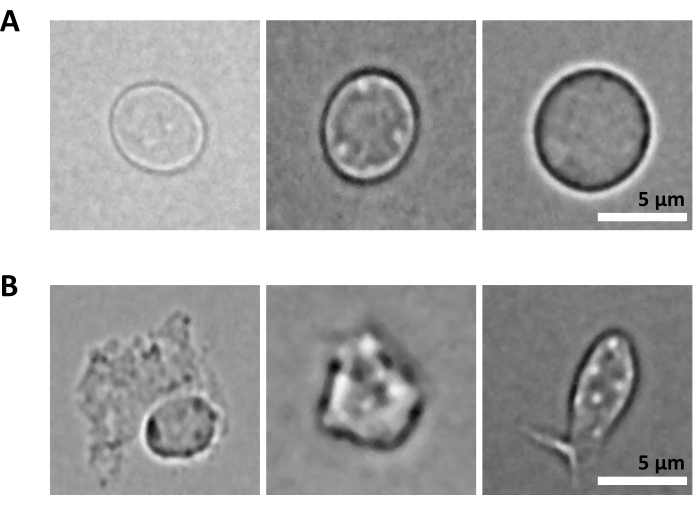
Рисунок 5: Контроль качества ядер с помощью микроскопии. Показаны репрезентативные светлопольные изображения изолированных ядер из костного мозга мыши с (А) интактными и (Б) поврежденными ядрами. Масштабная линейка 5 мкм. Изображения были получены с помощью инвертированного микроскопа с использованием 40-кратного объектива ELWD NA 0.60 и 1,5-кратного цифрового зума. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Оба протокола, подробно описанные в этой работе, основаны на очистке целевых клеток или ядер с помощью высокопроизводительных приборов FACS. Этот этап имеет решающее значение для протоколов подготовки одноклеточных/ядерных клеток, где редкие подмножества клеток должны быть выделены из гетерогенных суспензий. В этих случаях, как и в приведенном здесь примере для сортировки HSPC, может потребоваться многомерная панель проточной цитометрии для включения «стробирования» на интересующей клеточной популяции. Сортировка происходит очень быстро и точно, что приводит к чистоте отсортированных подмножеств клеток более 95%. При таком подходе клеточная суспензия подвергается давлению до 70 фунтов на квадратный дюйм и, следовательно, может быть ограничением для сортировки хрупких клеток (например, дендритных клеток, нейтрофилов), поскольку это может привести к разрыву их клеточной мембраны. В этих случаях следует выбирать альтернативные решения для клеточной очистки, в том числе магнитную сортировку, применение приборов нового поколения (например, CellenOne, Cellenion; MACSQuant Tyto, Miltenyi)35,36 или системы на основе капель (например, ODIN, Sensific)37. Тем не менее, медленная скорость сортировки этих технологий, когда сортировка клеток длится несколько часов, а не минут, является сильным ограничивающим фактором для применения этих подходов при подготовке жизнеспособных клеток для Multiome и других одноклеточных приложений, основанных на анализе большого количества клеток.
Для очистки ядер, выделенных из ткани, предпочтительным методом является FACS из-за его пропускной способности и чистоты выделенного материала. Ядра не чувствительны к давлению, а отфильтрованные тканевые изоляты можно легко очистить с помощью клеточного сортировщика. Если лаборатория не оснащена прибором FACS, существуют другие альтернативы, несколько менее эффективные, но достаточно хорошие. В качестве примера можно привести ультрацентрифугирование или использование небольшого оборудования, такого как MARS (Applied Cell), которое разделяет частицы на основе их разницы в размерах, используя акустические волны; ламинарная промывочная машина CURIOX, использующая гидрофобные свойства клеточно-ядерных суспензий; или LEVITAS bio, который опирается на физические свойства клеток (левитация), чтобы отделить их от мусора.
Здесь мы опишем протоколы для получения большого количества ядер и наилучшей чистоты для последующего протокола Multiome. Сортировка FACS и повторные этапы центрифугирования приводят к значительным потерям исходного материала. По этой причине в протоколе подготовки ядер из мозга, который мы здесь описываем, требуется достаточно обильный исходный материал, чтобы в результате после сортировки FACS было собрано не менее 500 000 ядер. Альтернативные протоколы должны применяться, если этот критерий не может быть сопоставлен. При работе с редкими клеточными популяциями или небольшими участками тканей лимитирующим фактором может быть доступное количество исходного материала. Для решения этой проблемы можно улучшить извлечение ядер путем (а) уменьшения объема лизиса, (б) уменьшения объема промывки, (в) использования однократной промывки с увеличенным временем центрифугирования, чтобы попытаться улучшить извлечение, как указано в протоколах 10X Genomics для выделения ядер с низким входом клеток. Для мультиомного анализа материалов с низким содержанием стоит рассмотреть приложения на основе планшетов, такие как scNMT, SNARE-seq и Paired-seq38 , которые требуют гораздо меньшего количества входных образцов.
Таким образом, мы описали два надежных протокола подготовки ядер головного мозга и костного мозга для последующего анализа Multiome. Эти протоколы применимы в любом научном проекте, требующем высококачественных одноядерных суспензий из этих двух типов тканей, независимо от поставленного научного вопроса. Наша группа применяет протокол выделения ядер мозга в исследованиях развития мозга при инактивации различных генов-мишеней, а также в исследованиях иммунного ответа на фоне неврологических заболеваний. Мы используем протокол выделения ядер костного мозга для расшифровки участия различных кроветворных субпопуляций в формировании иммунной системы.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Ана Джимин Чой получила стипендию от Международной программы докторантуры Парижского университета Пастера (PPU).
Materials
| 18 G x 1 ½ (1.2 mm x 38 mm) Agani needles | Terumo | AN*1838S1 | |
| 15 mL tubes | Falcon | 352097 | |
| 5 mL round bottom FACS tube with cell strainer cap 35 µm | falcon | 352235 | |
| 50 mL tubes | Falcon | 352070 | |
| 7-AAD | BD pharmagen | 559925 | |
| ACK Lysing Buffer | Gibco | A10492-01 | |
| APC anti-mouse CD117 (c-Kit) | BioLegend | 105812 | Clone: 2B8 |
| APC/Cyanine 7 anti-mouse CD16/32 (FcγR) | BioLegend | 101328 | Clone: 93 |
| BD FACSAria III | BD Biosciences | non-applicable | |
| BD FACSDiva Software v8.0.1 | BD Biosciences | non-applicable | |
| Bovine Serum Albumin stock solution 10% | Miltenyi Biotec | 130-091-376 | |
| Cell staining buffer | Biolegend | 420201 | |
| CFI Suprplan Fluor ELWD 40XC ON 0.6 | Nikon | non-applicable | |
| CMOS camera Prime 95B 25 mm | Photometrix | non-applicable | |
| Countess II FL Automated Cell Counter | Invitrogen | AMQAF1000 | |
| Countess cell counting chamber slide | Invitrogen | C10283 | |
| Coverglass 24 mm x 24 mm 0.13-0.17 mm | Brand | BR470819 | |
| Digitonine 5% | Invitrogen | BN2006 | |
| Disposable Scalpels | Swann-Morton | 0508 | |
| DMEM (1x) + GlutaMAX-I | Gibco | 31966-021 | |
| DPBS (10x) | Gibco | 14200-067 | |
| DTT | Sigma aldrich | 646563 | |
| Epifluorescence inverted microscope Nikon Ti2 -E | Nikon | non-applicable | |
| Eppendorf Safe-Lock Tubes 0.5 mL | Eppendorf | 30123603 | |
| Ethanol 70% | VWR | 83801.290 | |
| FITC anti-mouse CD34 | Invitrogen | 11-0341-85 | Clone: RAM34 |
| Forceps for dissection | FST | 11152-10 | |
| Heat-inactivated Fetal Bovine Serum (FBS) | Gibco | 11533387 | |
| Dounce Homogeniser 2 mL | Bellco glass | 1984-10002 | Pestle “A” Large Clearance: .0030-.0050″ and Pestle “B” Small Clearance: .0005-.0025″ |
| LIVE/DEAD fixable aqua dead cell stain kit | Invitrogen | L34957 | |
| Magnesium chloride solution 1 M | Sigma aldrich | M1028 | |
| Microcentrifuge | Eppendorf | 5424R | |
| Mounting medium Fluoromount-G | invitrogen | 00-4958-02 | |
| Nonidet P40 substitute | Sigma aldrich | 74385 | |
| Nuclease free water | ThermoFischer | AM9932 | |
| Nuclei buffer 20x | 10X Genomics | 2000153/2000207 | |
| Nuclei isolation kit EZ prep | Sigma Aldrich | NUC-101 | |
| OneComp eBeads compensation beads | Invitrogen | 01-1111-41 | |
| Pacific Blue anti-mouse lineage cocktail (including anti-mouse CD3, Ly-6G/Ly-6C, CD11b, CD45R/B220, TER-119) |
BioLegend | 133310 | Clones (in the same order as the antibodies listed): 17A2, RB6-8C5, M1/70, RA3-6B2, Ter-119 |
| PCR Tube Strips 0.2 mL | Eppendorf | 951010022 | |
| PE anti-mouse Ly-6A/E (Sca-1) | BioLegend | 122507 | Clone: E13-161.7 |
| Petri dish 100 mm x 20 mm OPTILUX | Falcon | 353003 | |
| Ply-L-lysine 0.01% sterile-filtered suitable for cell culture | Sigma | P4707 | |
| Printed microscope slides 8 well 6 mm numbered | Epredia | ER-301B-CE24 | |
| Protein LoBind Tubes 1.5 mL | Eppendorf | 30108116 | |
| Recombinant Rnase inhibitor 5000 U | Takara | 2313A | |
| Scissors for dissection | FST | 14090-09 | |
| Sodium chloride solution 5 M | Sigma aldrich | 59222C | |
| Syringe filters, PES, 0.2 µm | Fisher Scientific | 15206869 | |
| Transparent nail polish | any | non-applicable | |
| Trizma Hydrochloride solution pH 7.4 | Sigma aldrich | T2194 | |
| Trypan Blue 0.4% | gibco | 15250061 | |
| Tween 20 | Biorad | 1662404 | |
| UltraPure Distilated Water Dnase/Rnase Free | Invitrogen | 10977-035 |
References
- Clark, S. J., et al. scNMT-seq enables joint profiling of chromatin accessibility DNA methylation and transcription in single cells. Nature Communications. 9 (1), 781 (2018).
- Lee, J., Hyeon, D. Y., Hwang, D. Single-cell multiomics: technologies and data analysis methods. Experimental & Molecular Medicine. 52 (9), 1428-1442 (2020).
- Cerrizuela, S., et al. High-throughput scNMT protocol for multiomics profiling of single cells from mouse brain and pancreatic organoids. STAR Protocols. 3 (3), 101555 (2022).
- Dimitriu, M. A., Lazar-Contes, I., Roszkowski, M., Mansuy, I. M. Single-cell multiomics techniques: From conception to applications. Frontiers in Cell and Developmental Biology. 10, 854317 (2022).
- Stoeckius, M., et al. Simultaneous epitope and transcriptome measurement in single cells. Nature Methods. 14 (9), 865-868 (2017).
- Cao, J., et al. . Joint profiling of chromatin accessibility and gene expression in thousands of single cells. 361 (6409), 1380-1385 (2018).
- Narayanan, A., et al. Nuclei Isolation from Fresh Frozen Brain Tumors for Single-Nucleus RNA-seq and ATAC-seq.Journal of Visualized Experiments. JoVE. 162, 61542 (2020).
- Kim, M., et al. Single-nucleus transcriptomics reveals functional compartmentalization in syncytial skeletal muscle cells. Nature Communications. 11 (1), 6375 (2020).
- Santos, M. D., et al. Extraction and sequencing of single nuclei from murine skeletal muscles. STAR Protocols. 2 (3), 100694 (2021).
- Safabakhsh, S., et al. Isolating nuclei from frozen human heart tissue for single-nucleus RNA sequencing. Current Protocols. 2 (7), (2022).
- Lau, S. -. F., Cao, H., Fu, A. K. Y., Ip, N. Y. Single-nucleus transcriptome analysis reveals dysregulation of angiogenic endothelial cells and neuroprotective glia in Alzheimer’s disease. Proceedings of the National Academy of Sciences of the United States of America. 117 (41), 25800-25809 (2020).
- Armand, E. J., Li, J., Xie, F., Luo, C., Mukamel, E. A. Single-cell sequencing of brain cell transcriptomes and epigenomes. Neuron. 109 (1), 11-26 (2021).
- Morabito, S., et al. Single-nucleus chromatin accessibility and transcriptomic characterization of Alzheimer’s disease. Nature Genetics. 53 (8), 1143-1155 (2021).
- Chen, S., et al. Spatially resolved transcriptomics reveals genes associated with the vulnerability of middle temporal gyrus in Alzheimer’s disease. Acta Neuropathologica Communications. 10 (1), (2022).
- Paul, F., et al. Transcriptional heterogeneity and lineage commitment in myeloid progenitors. Cell. 163 (7), 1663-1677 (2015).
- Kaufmann, E., et al. BCG educates hematopoietic stem cells to generate protective innate immunity against tuberculosis. Cell. 172 (1-2), 176-190 (2018).
- Christ, A., et al. diet triggers NLRP3-dependent innate immune reprogramming. Cell. 172 (1-2), 162-175 (2018).
- Moorlag, S. J. C. F. M., et al. β-Glucan Induces protective trained immunity against mycobacterium tuberculosis infection: A key role for IL-1. Cell Reports. 31 (7), 107634 (2020).
- de Laval, B., et al. C/EBPβ-dependent epigenetic memory induces trained immunity in hematopoietic stem cells. Cell Stem Cell. 26 (5), 657-674 (2020).
- Renthal, W., et al. Characterization of human mosaic Rett syndrome brain tissue by single-nucleus RNA sequencing. Nature Neuroscience. 21 (12), 1670-1679 (2018).
- Yang, A. C., et al. A human brain vascular atlas reveals diverse mediators of Alzheimer’s risk. Nature. 603 (7903), 885-892 (2022).
- Lee, D. R., Zhang, Y., Rhodes, C. T., Petros, T. J. Generation of single-cell and single-nuclei suspensions from embryonic and adult mouse brains. STAR Protocols. 4 (1), 101944 (2022).
- Corces, M. R., et al. Lineage-specific and single-cell chromatin accessibility charts human hematopoiesis and leukemia evolution. Nature Genetics. 48 (10), 1193-1203 (2016).
- Ranzoni, A. M., et al. Integrative single-cell RNA-seq and ATAC-seq analysis of human developmental hematopoiesis. Cell Stem Cell. 28 (3), 472-487 (2021).
- . 10X Genomics Chromium Next GEM Single Cell Multiome ATAC + Gene Expression User Guide. Document Number CG000338 Rev F. At. , (2022).
- J, , et al. Microdissection of mouse brain into functionally and anatomically different regions. Journal of Visualized Experiments: JoVE. 168, 61941 (2021).
- . . 10X Genomics 10X Genomics Demonstrated Protocol – Nuclei Isolation for Single Cell Multiome ATAC + GEX sequencing (CG000365 – Rev C). At. , (2022).
- Haag, S., Murthy, A. Murine monocyte and macrophage culture. Bio-Protocol. 11 (6), (2021).
- Haque, A., Engel, J., Teichmann, S. A., Lönnberg, T. A practical guide to single-cell RNA-sequencing for biomedical research and clinical applications. Genome Medicine. 9 (1), (2017).
- Jiang, P. Quality control of single-cell RNA-seq. Methods in Molecular Biology. , 1-9 (1935).
- Regan, C., Preall, J. Practical considerations for single-cell genomics. Current Protocols. 2 (8), (2022).
- . . 10X Genomics 10X Genomics Demonstrated Protocol – Nuclei Isolation for Single Cell ATAC Sequencing (CG000169 – Rev E). At. , (2022).
- . 10X Genomics 10X Genomics Demonstrated Protocol – Nuclei Isolation from Complex Tissues for Single Cell Multiome. ATAC + Gene Expression Sequencing. (CG000375 – Rev C). At. , (2022).
- . . 10X Genomics 10X Genomics – Chromium Nuclei Isolation Kit (CG000505 – Rev A). AT. , (2022).
- Shomroni, O., et al. A novel single-cell RNA-sequencing approach and its applicability connecting genotype to phenotype in ageing disease. Scientific Reports. 12 (1), 4091 (2022).
- Ocañas, S. R., Pham, K. D., Blankenship, H. E., Machalinski, A. H., Chucair-Elliott, A. J., Freeman, W. M. Minimizing the ex vivo confounds of cell-isolation techniques on transcriptomic and translatomic profiles of purified microglia. 9 (2), 0348-0321 (2022).
- Gérard, A., et al. High-throughput single-cell activity-based screening and sequencing of antibodies using droplet microfluidics. Nature Biotechnology. 38 (6), 715-721 (2020).
- Vandereyken, K., Sifrim, A., Thienpont, B., Voet, T. Methods and applications for single-cell and spatial multi-omics. Nature Reviews. Genetics. 24, 494-515 (2023).

