ניתוח היווצרות קומפלקס חלבונים בריכוזים מיקרומולרים על ידי צימוד מיקרופלואידיקה עם פוטומטריית מסה
Summary
פרוטוקול זה משלב פוטומטריית מסה עם מערכת מיקרופלואידיקה חדשנית לחקר אינטראקציות חלבון-חלבון בעלות זיקה נמוכה. גישה זו מבוססת על דילול מהיר של קומפלקסים מרוכזים מאוד בתמיסה, המאפשר מדידות בעלות זיקה נמוכה ומרחיב את תחולת פוטומטריית המסה.
Abstract
פוטומטריית מסה היא טכנולוגיה רב-תכליתית למדידת מסה המאפשרת לחקור אינטראקציות ביומולקולריות והיווצרות מורכבת בתמיסה ללא תוויות. פוטומטריית מסה מתאימה בדרך כלל לניתוח דגימות בתחום הריכוז של 100 pM-100 ננומטר. עם זאת, במערכות ביולוגיות רבות, יש צורך למדוד דגימות מרוכזות יותר כדי לחקור אינטראקציות בעלות זיקה נמוכה או חולפות. כאן, אנו מדגימים שיטה המרחיבה ביעילות את טווח ריכוזי הדגימות שניתן לנתח באמצעות פוטומטריית מסה מננו-מולרית לעשרות מיקרומולאריות.
בפרוטוקול זה, פוטומטריית מסה משולבת עם מערכת מיקרופלואידיקה חדשנית כדי לחקור את היווצרותם של קומפלקסים חלבוניים בתמיסה בטווח ריכוזי המיקרומולרים. באמצעות מערכת המיקרופלואידיקה, המשתמשים יכולים לשמור דגימה בריכוז גבוה יותר הרצוי ולאחר מכן דילול לטווח הננו-מולרי – מספר אלפיות שנייה לפני מדידת פוטומטריית המסה. בשל מהירות הדילול, הנתונים מתקבלים לפני שיווי המשקל של המדגם השתנה (כלומר, דיסוציאציה של המכלול).
הטכניקה מיושמת למדידת אינטראקציות בין נוגדן אימונוגלובולין G (IgG) לבין קולטן Fc בילוד, ומראה היווצרות קומפלקסים מסדר גבוה שלא היו ניתנים לכימות עם מדידות פוטומטריה של מסה סטטית.
לסיכום, השילוב של פוטומטריית מסה ומיקרופלואידיקה מאפשר לאפיין דגימות בתחום ריכוזי המיקרומולרים ובקיא במדידת אינטראקציות ביומולקולריות בעלות זיקות חלשות יותר. יכולות אלה יכולות להיות מיושמות במגוון הקשרים – כולל פיתוח ועיצוב של תרופות ביותרפיות – ומאפשרות אפיון יסודי של אינטראקציות חלבון-חלבון מגוונות.
Introduction
אינטראקציות חלבון-חלבון מדגישות את רוב תפקודי התאים, החל מוויסות חיסוני ועד שכפול ותרגום DNA. כתוצאה מכך, קיים צורך בסיסי לאורך מדעי החיים לחקור מגוון רחב של אינטראקציות על פני קומפלקסים הטרוגניים מגוונים הנוצרים בדרך כלל. עם זאת, האיתור, האפיון והכימות שלהם הם לעתים קרובות מאתגרים, במיוחד עבור אינטראקציות בעלות זיקה נמוכה1.
מבחני משקעים חיסוניים משמשים לעתים קרובות לזיהוי אינטראקציות בעלות זיקה גבוהה, אך עבור אינטראקציות בעלות זיקה נמוכה ואינטראקציות חולפות, הזיהוי אינו אפשרי במידה רבה2. ניתן להשתמש גם בטכניקות פלואורסצנטיות אך דורשות הוספה שעלולה להפריע לתוויות פלואורסצנטיות2. Cryo-EM יכול לספק תמונת מצב מבנית וקריאת אנסמבל של קומפלקסים חלבוניים שנוצרו ברזולוציה מרחבית גבוהה, אך גם בדרך כלל דורש עבודה בריכוזים נמוכים מדי עבור הדמיה של אינטראקציות בעלות זיקה נמוכה. Cryo-EM מביא גם אתגרים הקשורים לעלות, נגישות, הכנת מדגם וזמן ניתוח3.
בנוסף, תהודה פלסמונית פני השטח (SPR) הפכה לדרך פופולרית לכימות אינטראקציות חלבון-חלבון, אם כי היא דורשת אימוביליזציה של חלבון, אשר יכולה להשפיע על שיווי המשקל הקושר ולגרום לקצבי על משתנים, ובכך להפחית את דיוק המדידה 4,5. זה כולל גם כמה שלבי בדיקה לפני איסוף נתונים וניתוח6.
פוטומטריית מסה היא טכניקה של מולקולה אחת ששימשה לניתוח אינטראקציות חלבון-חלבון 5,6,7. זה עובד על ידי מדידת המסה של מולקולות בודדות או קומפלקסים בהתבסס על האור שהם מפזרים כאשר הם נוחתים על פני השטח של כיסוי זכוכית8. מדידות פוטומטריית מסה שימשו לכימות זיקות קשירה מהשפע היחסי של שותפי קישור והקומפלקסים שהם יוצרים5. עם זאת, בדומה לטכניקות אחרות של מולקולה בודדת, ריכוז הדגימה שתימדד צריך להיות בדרך כלל פחות מ-100 ננומטר. אם הריכוז גבוה יותר, המולקולות שנוחתות על משטח הזכוכית יחפפו מרחבית, וכתוצאה מכך איכות הנתונים תהיה ירודה7. כתוצאה מכך, אינטראקציות חלשות יותר (KD ~micromolars), המתנתקות בריכוזים נמוכים אלה, אינן ניתנות למדידה מהימנה מכיוון שלא ניתן לצפות בתערובת ההכרחית של מינים לא קשורים וקשורים5.
כאן, אנו מתארים גישה המתגברת על מגבלה זו המבוססת על מכשיר פוטומטריית מסה מיקרופלואידיקה מצומד חדש. באופן ספציפי, מערכת מיקרופלואידיקה משמשת בשילוב עם פוטומטר המסה כדי להרחיב ביעילות את טווח האינטראקציות שניתן לכמת על ידי פוטומטריית מסה. מיקרופלואידיקה הוכחה כמציעה מגוון אפשרויות לחקר אינטראקציות חלבון-חלבון, כולל דילול מהיר לזיהוי אינטראקציות חלשות 1,9. המערכת המתוארת כאן פועלת על ידי דילול מהיר של הדגימה עד פי 10,000 על שבב מיקרופלואידי והזרמתה באופן מיידי על פני אזור התצפית של השבב, מה שמאפשר למדידת פוטומטריית המסה להתחיל תוך 50 מילישניות מהרגע שבו החלו המולקולות בתהליך הדילול10. הדילול מתרחש כאשר הדגימה והמאגר משולבים במערבל שסתום טסלה הפוך על השבב, כאשר קצבי הזרימה היחסיים של שתי התמיסות קובעים את כמות הדילול המתרחשת (ראה שלב פרוטוקול 8). קצב הזרימה ניתן לשליטה באמצעות תוכנת הבקרה המיקרופלואידית. שינוי קצב הזרימה יכול לשנות את האוכלוסייה היחסית של המין מכיוון שהוא יכול להשפיע על מספר אירועי הנחיתה על פני הזכוכית, וזה מה שנמדד על ידי פוטומטר המסה.
מהירות התהליך מהירה מספיק כדי להשלים את המדידה לפני שתקינות האינטראקציה תשובש (לפרטים נוספים, ראו גם את הדיון). ניתן להבין זאת באמצעות מבט קצר על התיאוריה של תגובות מסדר ראשון, כאשר 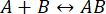 . קבוע קצב האסוציאציה קדימה הוא kf, קבוע הקצב לאחור (דיסוציאציה) הוא kb, וקבוע דיסוציאציית שיווי המשקל (KD) מוגדר כ
. קבוע קצב האסוציאציה קדימה הוא kf, קבוע הקצב לאחור (דיסוציאציה) הוא kb, וקבוע דיסוציאציית שיווי המשקל (KD) מוגדר כ
KD = kb/ kf
עבור קשירת חלבונים, kfמוגבל בדרך כלל על ידי הדיפוזיה11 של המגיבים ולכן מוגבל לטווח של 10 6-10 7 M-1·s-1. מכיוון שהטווח של מוגבל, לתגובה בעלת זיקה נמוכה (KD~micromolars) תהיה kb≈ 1 s-1. כלומר, kb = kf · KD = (106 M-1·s-1) (10-6 M) = 1 s-1, כאשר זמן מחצית החיים של המתחם נע סביב 0.7 s11,12.
המערכת לדוגמה שלנו היא קשירה של נוגדן חד-שבטי IgG trastuzumab לתחום המסיס של קולטן Fc בילוד IgG (FcRn), שהם שותפים ידועים באינטראקציה13. נתונים שפורסמו בעבר שהתקבלו באמצעות פוטומטריית מסה קונבנציונלית בלבד (כלומר, עם דילול ידני של דגימות) הראו כי החלבונים יוצרים מינים מרובים. מונומרים של FcRn, דימרים של FcRn ו-IgG לא קשור נראו בבירור, בעוד שקומפלקסים של IgG-FcRn (ביחס של 1:1 ו-1:2) זוהו גם הם (ב-pH 5.0) אך רק עם שפע נמוך מאוד5. תצפית זו מעלה את השאלה האם ניתן לזהות בבירור רב יותר היווצרות קומפלקס IgG-FcRn אם נמדדת בריכוז גבוה יותר. ואכן, שילוב פוטומטריית מסה עם גישת דילול מהיר מצומד שתוארה כאן סיפק ראיות חזקות יותר להיווצרות מורכבת על ידי עלייה בחלקיקים הנמדדים שלהם.
פרוטוקול פוטומטריית המסה והמיקרופלואידיקה המתואר כאן מאפשר לאפיין היווצרות קומפלקסים עם KD עד לטווח המיקרומולארי. קביעה אמפירית של KD תדרוש שיפורים נוספים בדיוק חיישן הזרימה, יציבות המשאבה, וריאציות שבב לשבב ומיקום המדידה בתוך חלון התצפית, שכן כל הגורמים הללו ישפיעו על הזמן מרגע דילול הדגימה ועד למדידה.
אותה גישה יכולה להיות מיושמת כדי לחקור קשירה בין חלבונים מסיסים, בתנאי שיש להם משקלים מולקולריים נפרדים (מופרדים על ידי לפחות 25 kDa) הנמצאים בטווח המתאים לניתוח עם פוטומטר מסה (30 kDa עד 6 MDa). התובנות המתקבלות יכולות להיות מועילות למחקרים במגוון הקשרים – החל מהשגת הבנה מכניסטית של תפקודים תאיים ועד לתכנון תרופות ביותרפיות חדשות.
Protocol
Representative Results
Discussion
הפרוטוקול המתואר כאן מספק שיטה לזיהוי וכימות אינטראקציות חלבון-חלבון בעלות זיקה נמוכה. הוא משתמש בפוטומטר מסה המחובר למערכת מיקרופלואידיקה בעלת דילול מהיר. פוטומטריית מסה היא כלי ביואנליטי ללא תוויות שיכול למדוד באופן אמין מסה מולקולרית בתמיסה עבור ביומולקולות16, עבור אלה בטווח של 30 kDa עד 6 MDa. מכיוון שפוטומטריית מסה היא טכניקה של מולקולה בודדת המנתחת דגימות בזו אחר זו, היא מוגבלת בדרך כלל לדגימות בטווח הריכוז של 100 pM-100 ננומטר. מעל טווח זה, המולקולות הנוחתות על משטח הזכוכית יחפפו מרחבית, וכתוצאה מכך איכות הנתונים תהיה ירודה; מתחת לטווח זה, מעט מדי נתונים מתקבלים כדי לבצע ניתוח חזק7. תוצאה חשובה היא שהיא יכולה להגביל את חקירת אינטראקציות החלבונים לאלה היוצרות תערובת של מינים קשורים ולא קשורים בטווח זה.
כאן, פירטנו פרוטוקול שלב אחר שלב לשימוש במערכת מיקרופלואידיקה של דילול מהיר כדי להרחיב ביעילות את טווח ריכוזי הדגימות המקובלים לפוטומטריית מסה. על ידי דילול הדגימה על השבב המיקרופלואידי ולאחר מכן הזרמתה על פני חלון התצפית של הגלאי תוך 50 מילישניות, המערכת לוכדת את הקומפלקסים הקיימים בדגימה הלא מדוללת לפני שינוי שיווי משקל האינטראקציה. הדגימה מועברת ברציפות לגלאי במהלך מדידות בודדות. בתנאים אלה, 95% מהקומפלקס יישאר שלם בעת מדידת הדגימה, אפילו עבור אינטראקציות בעלות זיקה נמוכה – עם KD בסדר גודל של מיקרוטוחנות ושיעורי דיסוציאציה במהירות של 1 s-1.
ניתן לחשב זאת באופן הבא: עבור תגובה 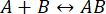 עם קצב קדימה kfוקצב אחורה kb,
עם קצב קדימה kfוקצב אחורה kb,
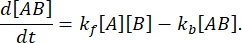
בשיווי משקל, הריכוזים של כל שלושת המינים (A, B והקומפלקס AB) נשארים קבועים, כך 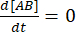 ו
ו 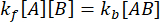 – . תחת ההנחה השמרנית שההפרעה (דילול, במקרה זה) עלולה לגרום למורכבות להתנתק, אך תגובת האסוציאציה קדימה אינה מתקדמת, ניתן להתייחס למונח kf [A] [B] כזניח, וניתן לבצע את הפישוט הבא:
– . תחת ההנחה השמרנית שההפרעה (דילול, במקרה זה) עלולה לגרום למורכבות להתנתק, אך תגובת האסוציאציה קדימה אינה מתקדמת, ניתן להתייחס למונח kf [A] [B] כזניח, וניתן לבצע את הפישוט הבא:
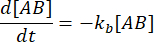
אינטגרציה נותנת את הביטוי הבא לריכוז של קומפלקס בזמן לאחר הפרת שיווי המשקל:
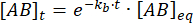
החלק של המכלול שנשאר קשור בזמן t לאחר הפרת שיווי המשקל הוא כך:
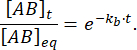
ב- = 50 אלפיות השנייה, עבור תגובה עם kb≈ 1 s-1, חסם השבר הוא 0.95, או 95%11,12.
פוטומטריה המונית שימשה כאן ובעבר5 כדי לחקור את הקישור של נוגדן חד שבטי IgG trastuzumab לתחום המסיס של FcRn. דווח כי שני השותפים הקושרים נקשרים בזיקה ננו-מולרית ב-pH17 חומצי. פוטומטריה המונית שימשה להערכה איכותית של שפע הקומפלקסים שנוצרו בזמן שהשותפים המחייבים היו ב- pH 5.0, והדגימות דוללו במהירות באמצעות מערכת מיקרופלואידית נוספת. ההליך הותאם לאינטראקציה מסוימת בין חלבון לחלבון בהתבסס על תוצאות5 שדווחו בעבר. אותו הליך יכול לשמש לחקר אינטראקציות אחרות, בתנאי שלמשתמשים יש ידע מוקדם או לייעל את תנאי הניסוי עבור המערכת המדוברת, כגון באילו מאגרים להשתמש, ריכוז החלבון הראשוני, הסטויכיומטריה הצפויה וכמות הדגירה הדרושה כדי לאפשר לאינטראקציה להגיע לשיווי משקל.
כאשר תערובת IgG-FcRn דוללה ידנית, היה קשה לזהות את נוכחותם של קומפלקסים IgG-FcRn, למרות שחלבונים אלה ידועים באינטראקציה5. מאמר זה מראה כי גישת הדילול המהיר מביאה לכמות מוגברת באופן משמעותי של קומפלקסים אלה. עבור אותה מדגם, כאשר נעשה שימוש בדילול מהיר, נצפו בבירור מתחמי FcRn-IgG 1:1 ומתחמי FcRn-IgG 2:1. הבדלים אלה בהיווצרות מורכבת מדגימים את החשיבות של חקר מערכות אינטראקציה ביומולקולריות על פני מגוון רחב של ריכוזים.
בנוסף, תוצאות אלה גם מראות כי זה פשוט להשתמש microfluidics עם ניתוח מולקולה בודדת כדי ללכוד אינטראקציות חלשות – מילוי פער משמעותי בשיטה. השילוב של מיקרופלואידיקה בדילול מהיר עם פוטומטריית מסה מציע יתרונות אטרקטיביים בשל היתרונות של פוטומטריית מסה כטכניקה אנליטית. כלומר, פוטומטריה המונית אינה דורשת תוויות, כרוכה בהכנת מדגם מינימלית, והמדידות נעשות בתמיסה. עבור פרוטוקול זה, יתרון מרכזי נוסף של פוטומטריית מסה הוא היכולת להבחין ולכמת את כל המינים שנוצרו (בתנאי שיש להם מסה ברורה של >30 kDa). זאת בניגוד ל-SPR, למשל, שיכול למדוד קצבי קשירה ואי-קשירה, אך אינו יכול לספק בקלות מידע סטויכיומטריה8.
עבור פרוטוקול זה, כמו גם ניסויי פוטומטריה המוניים באופן כללי יותר, מספר שיקולים מועילים. ראשית, ריכוז החלבון הסופי צריך להיות בגבול של מה פוטומטריית מסה יכול למדוד (100 pM-100 nM). ריכוז הדגירה ההתחלתי צריך להיות גם בטווח של המערכת המיקרופלואידית (עד 90 מיקרומטר) ולהיות מעל KD בפועל של אינטראקציה10. נקודת המוצא המומלצת היא יחס ערבוב ריכוז של 1:1 בין המינים המקיימים אינטראקציה בריכוז μM. לאחר מכן ניתן היה לשנות את היחס ל-1:2, 1:5, או, כמו במקרה של אינטראקציה זו, ל-1:10. אם אין מידע קודם על אינטראקציות החלבון, המשתמש יצטרך לייעל את הניסוי, החל מריכוז גבוה (מומלץ 20 מיקרומטר) עבור כל שותף כדי לקבוע אם הזיקה של הרכיבים היא בטווח הריכוז שנשמר על ידי השיטה שהוצגה (כלומר, קומפלקסים נוצרים). מיטוב עשוי לכלול גם בחירת תנאי מאגר אחרים כדי לקדם את האינטראקציות או הטיטרציה של אחד מרכיבי האינטראקציה כדי לקבוע את יחס הערבוב הנכון. לאחר קביעתם, ניתן לייעל ריכוזים וזרימות כדי לאפשר תנאים אופטימליים למחקר ולשיטה, למשל, הפחתת הריכוזים כדי לאפשר רזולוציית שיא טובה יותר.
שנית, כדי לשכפל בהצלחה את הניסוי הזה, זיהומים צריך להיות ממוזער. מקורות נפוצים של זיהומים הידועים כמשפיעים לרעה על מדידות פוטומטריה של מסה כוללים חלבונים אחרים או פסולת תאית שנותרת לאחר טיהור, מאגרים לא מסוננים, דטרגנטים יוצרי מיצלה (אם קיימים בריכוז גבוה מדי), ומאגרים המכילים ריכוזים גבוהים של מלח, גליצרול או רכיבים אחרים. כפי שנדון בפרוטוקול לעיל, יש להסיר בועות במערכת המיקרופלואידיקה. בועות יכולות להיווצר במערכת הצינורות או אם הדגימות הן בעלות מתח פנים גבוה ומועדות להיווצרות קצף. בועות יכולות להיווצר גם בשמן הטבילה, אשר ניתן לזהות מטבעת המיקוד (איור 3). אם לא ניתן להסיר בועות באמצעות השלבים המתוארים בפרוטוקול, פתרון נוסף הוא להוציא את הדגימה באמצעות מייבש ומשאבת ואקום, ולהשאיר את הדגימה בלחץ מופחת למשך מספר דקות. ערבול או ניעור תמיסות חלבון מרוכזות מאוד אינו מומלץ מכיוון שפעולות אלה עשויות לקדם היווצרות בועות.
בעוד שמדידה של אינטראקציה ספציפית אחת בין חלבון לחלבון מודגמת כאן, ניתן ליישם את אותו פרוטוקול על מערכות אינטראקציה חלבון-חלבון אחרות ללא שינוי משמעותי. כיוון עתידי נוסף של פרוטוקול זה יהיה להשתמש במדידות כדי לחשב ערכי KD עבור הקומפלקסים שזוהו, כפי שתואר במקום אחר בהקשר של פוטומטריית מסה 5,7. בעוד שהמחקרים הקודמים השתמשו בנתונים מניסויים שכללו דילול ידני ואינטראקציות חזקות יותר, עקרון הניתוח יכול להיות מיושם בקלות בהקשר זה – בתנאי שייושמו שיפורים נוספים במכשיר המיקרופלואידי (כגון דיוק מוגבר של חיישן זרימה ויציבות המשאבה).
מעבר לאינטראקציות חלבון-חלבון, סביר להניח שיהיו יישומים רחבים יותר לגישה משולבת של פוטומטריית מסה ומיקרופלואידיקה של דילול מהיר. פוטומטריית מסה יכולה לשמש להערכת טוהר הדגימה, צבירה והומוגניות 18,19; חקר אוליגומריזציה של חלבונים20, הרכבה מקרומולקולרית21 או פילמור22; ובתחומים אחרים. ניתוח פוטומטריית מסה משתרע גם מעבר לחלבונים; הוא שימש לחקר אינטראקציות בין חומצות גרעין וחלבונים23, חלקיקים נגיפיים24 וננו-חלקיקים25. פרוטוקול זה מתאר אפוא יישום חשוב של מערכת מיקרופלואידיקה פוטומטרית מסה משולבת – הוא מאפשר מדידה ישירה של אינטראקציות חלבון-חלבון חלשות ברמת מולקולות וקומפלקסים בודדים. הערך של היישום הנוכחי הוא גבוה, שכן הוא פותח את האפשרות לאפיין באופן ישיר אינטראקציות שבדרך כלל היה קשה לחקור – עם רלוונטיות על פני תחומים טיפוליים קריטיים. גישה משולבת זו יכולה לשמש גם בסיס למגוון רחב יותר של חקירות עבור דגימות עם ריכוזים של עד עשרות micromolar.
Disclosures
The authors have nothing to disclose.
Acknowledgements
W.S. נתמך על ידי מלגת מנהיגי העתיד של UKRI [MR/V02213X/1]. הטקסט והגרפיקה של כתב היד הוכנו בתמיכת חברי צוות התקשורת המדעית של רפיין (פנגיוטה פגאנופולו, נויס טורס טמריט, וקתרין ליכטן). אנו מודים גם למשוב רב ערך מקמיל הטז, סופיה פריירה ומתיאס לנגהורסט.
Materials
| 2-Propanol (Isopropanol) | VWR International LLC | 20880.320 | |
| Data acquisition software | Refeyn | AcquireMP (v2022 R1) | |
| Data analysis software | Refeyn | DiscoverMP (v2022 R1) | |
| FCRN, His-Tag | Sigma | SRP0624 | |
| Herceptin (IgG) | Cambridge Bioscience | HY-P9907-1mg | |
| Mass photometer | Refeyn | TwoMP | |
| Microfluidics box | Refeyn | MassFluidix HC system | |
| Microfluidics chip | Refeyn | MassFluidix HC chip | |
| Microfluidics control software | Fluigent | OxyGEN | |
| Phosphate Buffered Saline (PBS), 1x Ultra Pure | VWR International LLC | K812 | |
| Sodium Hydroxide (NaOH) | Sigma | S2770 | |
| β-Amylase, from sweet potato | Sigma | A8781 |
References
- Arter, W. E., Levin, A., Krainer, G., Knowles, T. P. J. Microfluidic approaches for the analysis of protein-protein interactions in solution. Biophysical Reviews. 12 (2), 575-585 (2020).
- Hellenkamp, B., Thurn, J., Stadlmeier, M., Hugel, T. Kinetics of transient protein complexes determined via diffusion-independent microfluidic mixing and fluorescence stoichiometry. The Journal of Physical Chemistry. B. 122 (49), 11554-11560 (2018).
- Li, Z. Editorial: Methods in structural biology: Cryo-electron microscopy. Frontiers in Molecular Biosciences. 9, 1041386 (2022).
- Herling, T. W., et al. A microfluidic platform for real-time detection and quantification of protein-ligand interactions. Biophysical Journal. 110 (9), 1957-1966 (2016).
- Soltermann, F., et al. Quantifying protein-protein interactions by molecular counting with mass photometry. Angewandte Chemie International Edition. 59 (27), 10774-10779 (2020).
- Wu, D., Piszczek, G. Rapid determination of antibody-antigen affinity by mass photometry. Journal of Visualized Experiments: JoVE. 168, 61784 (2021).
- Wu, D., Piszczek, G. Measuring the affinity of protein-protein interactions on a single-molecule level by mass photometry. Analytical Biochemistry. 592, 113575 (2020).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Zijlstra, N., et al. Rapid microfluidic dilution for single-molecule spectroscopy of low-affinity biomolecular complexes. Angewandte Chemie International Edition. 56 (25), 7126-7129 (2017).
- MassFluidix® HC system for rapid dilution via microfluidics. Available from: https://www.refeyn.com/massfluidix-hc-system (2023)
- Pollard, T. D. A guide to simple and informative binding assays. Molecular Biology of the Cell. 21 (23), 4061-4067 (2010).
- Jarmoskaite, I., AlSadhan, I., Vaidyanathan, P. P., Herschlag, D. How to measure and evaluate binding affinities. eLife. 9, e57264 (2020).
- Monnet, C., et al. Selection of IgG variants with increased FcRn binding using random and directed mutagenesis: Impact on effector functions. Frontiers in Immunology. 6, 39 (2015).
- . Refeyn TwoMP: Transforming biomolecular characterisation Available from: https://www.refeyn.com/twomp-mass-photometer (2022)
- Lai, S. -. H., Tamara, S., Heck, A. J. R. Single-particle mass analysis of intact ribosomes by mass photometry and Orbitrap-based charge detection mass spectrometry. iScience. 24 (11), 103211 (2021).
- Wu, D., Piszczek, G. Standard protocol for mass photometry experiments. European Biophysics Journal. 50 (3-4), 403-409 (2021).
- Vaughn, D. E., Bjorkman, P. J. Structural basis of pH-dependent antibody binding by the neonatal Fc receptor. Structure. 6 (1), 63-73 (1998).
- Niebling, S., et al. Biophysical screening pipeline for Cryo-EM grid preparation of membrane proteins. Frontiers in Molecular Biosciences. 9, 882288 (2022).
- Paul, S. S., Lyons, A., Kirchner, R., Woodside, M. T. Quantifying oligomer populations in real time during protein aggregation using single-molecule mass photometry. ACS Nano. 16 (10), 16462-16470 (2022).
- Schulz, L., et al. Evolution of increased complexity and specificity at the dawn of form I Rubiscos. Science. 378 (6616), 155-160 (2022).
- Malay, A. D., et al. An ultra-stable gold-coordinated protein cage displaying reversible assembly. Nature. 569 (7756), 438-442 (2019).
- Hundt, N., Cole, D., Hantke, M. F., Miller, J. J., Struwe, W. B., Kukura, P. Direct observation of the molecular mechanism underlying protein polymerization. Science Advances. 8 (35), eabm7935 (2022).
- Acharya, A., et al. Distinct RPA domains promote recruitment and the helicase-nuclease activities of Dna2. Nature Communications. 12, 6521 (2021).
- Ebberink, E. H. T. M., Ruisinger, A., Nuebel, M., Thomann, M., Heck, A. J. R. Assessing production variability in empty and filled adeno-associated viruses by single molecule mass analyses. Molecular Therapy – Methods & Clinical Development. 27, 491-501 (2022).
- Melo, L., et al. Size distributions of gold nanoparticles in solution measured by single-particle mass photometry. The Journal of Physical Chemistry B. 125 (45), 12466-12475 (2021).

