マイクロ流体と質量測光の結合によるマイクロモル濃度でのタンパク質複合体形成の解析
Summary
このプロトコルは、質量測光と新しいマイクロ流体システムを組み合わせて、低親和性のタンパク質間相互作用を調査します。このアプローチは、溶液中の高濃度の錯体を急速に希釈することに基づいており、低親和性測定を可能にし、質量測光の適用範囲を広げます。
Abstract
質量測光は、ラベルなしで溶液中の生体分子相互作用と複雑な形成の研究を可能にする汎用性の高い質量測定技術です。質量測光は、一般に100 pM〜100 nMの濃度範囲のサンプルの分析に適しています。しかし、多くの生物系では、低親和性または一過性の相互作用を研究するために、より濃縮されたサンプルを測定する必要があります。ここでは、質量測光で分析できる試料濃度の範囲をナノモルから数十マイクロモルまで効果的に拡大する手法を実証します。
このプロトコルでは、質量測光を新しいマイクロ流体システムと組み合わせて、マイクロモル濃度範囲の溶液中のタンパク質複合体の形成を調査します。マイクロ流体システムを使用すると、ユーザーはサンプルを目的の高濃度に維持し、その後、質量測光測定の数ミリ秒前にナノモル範囲に希釈することができます。希釈の速度により、サンプルの平衡がシフトする(つまり、複合体の解離)前にデータが得られます。
この手法は、免疫グロブリンG(IgG)抗体と新生児Fc受容体との間の相互作用を測定するために適用され、静的質量測光測定では定量化できなかった高次複合体の形成を示しています。
結論として、質量測光とマイクロ流体工学の組み合わせにより、マイクロモル濃度範囲でサンプルを特徴づけることが可能になり、親和性の弱い生体分子相互作用の測定に熟達しています。これらの機能は、バイオ医薬品の開発や設計など、さまざまな状況に適用でき、多様なタンパク質間相互作用の詳細な特性評価を可能にします。
Introduction
タンパク質間相互作用は、免疫調節からDNAの複製や翻訳まで、ほとんどの細胞機能を強調しています。その結果、生命科学全体を通じて、一般的に形成される多様な不均一複合体にわたる広範囲の相互作用を調査することが根本的に求められています。しかし、それらの検出、特性評価、定量は、特に親和性の低い相互作用では困難な場合が多いです1。
免疫沈降アッセイは、高親和性相互作用の検出によく使用されますが、低親和性および一過性相互作用の場合、検出はほとんど不可能です2。蛍光技術も使用できますが、蛍光標識の潜在的に破壊的な添加が必要です2。クライオ電子顕微鏡は、高い空間分解能で形成されたタンパク質複合体の構造スナップショットとアンサンブル読み出しを提供できますが、通常、低親和性相互作用をイメージングするには低濃度で作業する必要があります。クライオ電子顕微鏡は、コスト、アクセス性、サンプル調製、分析時間に関する課題ももたらします3。
さらに、表面プラズモン共鳴(SPR)は、タンパク質間相互作用を定量化するための一般的な方法になっていますが、タンパク質の固定化が必要であり、結合平衡に影響を及ぼし、オンレートが変動するため、測定精度が低下する可能性があります4,5。また、データ収集と分析の前にいくつかのアッセイステップも含まれます6。
質量測光は、タンパク質間相互作用の分析に用いられてきた単一分子技術である5,6,7。これは、ガラスカバーガラスの表面に着地したときに散乱する光に基づいて、単一分子または錯体の質量を測定することによって機能します8。質量測光測定は、結合パートナーの相対的な存在量とそれらが形成する複合体からの結合親和性を定量化するために使用されてきました5。それにもかかわらず、他の単一分子技術と同様に、測定されるサンプルの濃度は通常100 nM未満である必要があります。濃度が高いと、ガラス表面に着地する分子が空間的に重なり合い、データ品質が低下します7。その結果、これらの低濃度で解離する弱い相互作用(KD ~マイクロモル)は、非結合種と結合種5の必要な混合物を観察することができないため、確実に測定することができない。
ここでは、新しい結合マイクロ流体質量測光デバイスに基づいて、この制限を克服するアプローチについて説明します。具体的には、マイクロ流体システムを質量光度計と組み合わせて使用し、質量測光で定量化できる相互作用の範囲を効果的に拡大します。マイクロ流体工学は、弱い相互作用を検出するための迅速な希釈など、タンパク質間相互作用を研究するためのさまざまな可能性を提供することが示されています1,9。本明細書に記載のシステムは、マイクロ流体チップ上で試料を10,000倍まで急速に希釈し、直ちにチップの観察領域を横切って流すことによって動作し、分子が希釈プロセスを開始してから50ms以内に質量測光測定を開始することを可能にする10。希釈は、サンプルとバッファーがチップ上の逆テスラバルブミキサーで混合されるときに発生し、2つの溶液の相対流量によって発生する希釈量が決まります(プロトコルステップ8を参照)。流量はマイクロ流体制御ソフトウェアで制御できます。流量を変更すると、質量光度計で測定されるガラスの表面への着地イベントの数に影響を与える可能性があるため、種の相対的な個体数が変化する可能性があります。
プロセスの速度は、相互作用の完全性が損なわれる前に測定を完了するのに十分な速さです(詳細については、ディスカッションも参照してください)。これは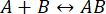 、一次反応の理論を簡単に見ることで理解できます。前方(連合)速度定数はkf、後方(解離)速度定数はkb、平衡解離定数(KD)は次のように定義されます。
、一次反応の理論を簡単に見ることで理解できます。前方(連合)速度定数はkf、後方(解離)速度定数はkb、平衡解離定数(KD)は次のように定義されます。
KD= kb/ kf
タンパク質結合の場合、kfは一般に反応物の拡散によって制限されるため11、したがって106-10 7 M-1·s-1の範囲に制限される。範囲が限られているため、低親和性(KD~マイクロモル)反応はkb≈ 1 s-1になります。つまり、kb= kf ·KD =(106 M-1・s-1)(10-6 M)= 1 s-1、複合体の半減期は約0.7秒11,12です。
我々のシステム例は、IgGモノクローナル抗体トラスツズマブの、既知の相互作用パートナーであるIgG新生児Fc受容体(FcRn)の可溶性ドメインへの結合である13。従来の質量測光のみを使用して(つまり、サンプルを手動で希釈して)得られた以前に発表されたデータは、タンパク質が複数の種を形成することを示しました。FcRnモノマー、FcRn二量体、および非結合IgGがはっきりと見え、IgG-FcRn複合体(1:1および1:2の比率)も(pH 5.0で)検出されましたが、存在量は非常に少なかった5。この観察結果は、IgG-FcRn複合体の形成を、より高い濃度で測定した場合、より明確に検出できるかどうかという疑問を提起します。実際、質量測光法とここで説明した結合急速希釈法を組み合わせると、測定された粒子の増加による複雑な形成のより堅牢な証拠が得られました。
ここで説明する質量測光およびマイクロ流体プロトコルは、マイクロモル範囲までの KDを有する複合体の形成を特徴付けることを可能にする。KD を経験的に決定するには、流量センサーの精度、ポンプの安定性、チップ間のばらつき、および観察ウィンドウ内の測定位置をさらに改善する必要があります。
質量光度計(30 kDa〜6 MDa)での分析に適した範囲に収まる明確な分子量(少なくとも25 kDaで分離)がある場合、同じアプローチを適用して可溶性タンパク質間の結合を調べることができます。得られた知見は、細胞機能の機構的理解から新しいバイオ医薬品の設計まで、さまざまな状況での研究に役立つ可能性がある。
Protocol
Representative Results
Discussion
ここで概説するプロトコルは、低親和性タンパク質間相互作用を検出および定量する方法を提供します。これは、急速希釈マイクロ流体システムに結合された質量光度計を使用します。質量測光は、30 kDaから6 MDaの範囲の生体分子16の溶液中の分子量を確実に測定できる、ラベルフリーのバイオ分析ツールです。質量測光は、試料を1つずつ分析する1分子の手法であるため、一般的には100pM〜100nMの濃度範囲の試料に限られます。この範囲を超えると、ガラス表面に着地する分子が空間的に重なり合い、データ品質が低下します。この範囲を下回ると、得られたデータが少なすぎて、ロバストな分析を行うことができません7。重要な結果は、タンパク質相互作用の研究を、その範囲内で結合種と非結合種の混合物を形成するものに限定できることです。
ここでは、急速希釈マイクロ流体システムを使用して、質量測光に適したサンプル濃度の範囲を効果的に拡大するための段階的なプロトコルについて詳しく説明します。マイクロ流体チップ上でサンプルを希釈し、50 ms以内に検出器観察ウィンドウを横切って流すことにより、システムは相互作用平衡がシフトする前に、希釈されていないサンプルに存在する複合体を捕捉します。サンプルは、個々の測定中に検出器に連続的に送達されます。これらの条件下では、複合体の95%は、低親和性相互作用の場合でも、サンプルを測定したときに無傷のままです-マイクロモルオーダーのKDと1s-1の速さで解離速度。
これは次のように計算できます:順方向速度kfおよび逆方向速度kbの反応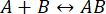 の場合、
の場合、
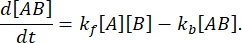
平衡状態では、3つの種(A、B、および複合体 AB)すべての濃度が一定に保たれるため、 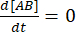 と
と 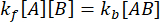 になります。摂動(この場合は希釈)によって複合体が解離する可能性があるが、順方向(会合)反応は進行しないという控えめな仮定の下では、 用語kf [A] [B]は無視できるものとして扱うことができ、次のように単純化することができます。
になります。摂動(この場合は希釈)によって複合体が解離する可能性があるが、順方向(会合)反応は進行しないという控えめな仮定の下では、 用語kf [A] [B]は無視できるものとして扱うことができ、次のように単純化することができます。
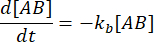
積分すると、平衡摂動後の時間における錯体の濃度について、次の式が得られます。
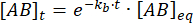
平衡摂動後の時間 t で結合されたままの複合体の割合は、次のようになります。
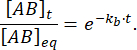
= 50 msで、kbと1 s-1との反応の場合≈フラクションの束縛は0.95、つまり95%11,12です。
質量測光は、IgGモノクローナル抗体トラスツズマブのFcRnの可溶性ドメインへの結合を調べるために、ここでも以前にも 使用されました5。2つの結合パートナーは、酸性pH17でナノモル親和性で結合することが報告されています。質量測光を使用して、結合パートナーがpH 5.0にある間に形成された複合体の存在量を定性的に評価し、サンプルを追加のマイクロ流体システムを介して急速に希釈しました。この手順は、以前に報告された結果に基づいて、特定のタンパク質間相互作用に最適化されました5。ユーザーが予備知識を持っているか、使用するバッファー、初期タンパク質濃度、予想される化学量論、相互作用が平衡に達するために必要なインキュベーション量など、問題のシステムの実験条件を最適化していれば、同じ手順を使用して他の相互作用を研究することができます。
IgG-FcRn混合物を手動で希釈すると、これらのタンパク質が相互作用することが知られているにもかかわらず、IgG-FcRn複合体の存在を検出することは困難でした5。この論文は、急速希釈アプローチにより、これらの複合体の量が著しく増加することを示しています。同じサンプルについて、急速希釈を使用した場合、1:1のFcRn-IgG複合体と2:1のFcRn-IgG複合体の両方が明確に観察されました。これらの複合体形成の違いは、広範囲の濃度にわたる生体分子相互作用系を研究することの重要性を示しています。
さらに、これらの結果は、マイクロ流体工学と単一分子分析を使用して弱い相互作用を捕捉することが容易であり、この手法の大きなギャップを埋めることも示しています。急速希釈マイクロ流体工学と質量測光の組み合わせは、分析技術としての質量測光の利点により、魅力的な利点を提供します。つまり、質量測光は標識を必要とせず、最小限のサンプル調製で済み、測定は溶液中で行われます。このプロトコルでは、質量測光のもう一つの重要な利点は、形成されたすべての種を区別および定量できることです(>30 kDaの明確な質量を有する場合)。これは、例えば、結合速度と非結合速度を測定できるが、化学量論に関する情報を容易に提供できないSPRとは対照的である8。
このプロトコル、およびより一般的な質量測光実験では、いくつかの考慮事項が役立ちます。まず、最終的なタンパク質濃度は、質量測光法で測定できる限界(100 pM-100 nM)内にある必要があります。開始インキュベーション濃度も、マイクロ流体系の範囲(最大90μM)内にあり、相互作用の実際のKD を超えると理論化されるべきである10。推奨される開始点は、μM濃度で相互作用する種間の1:1の濃度混合比です。次に、比率を1:2、1:5、またはこの交互作用の場合のように1:10に変更できます。タンパク質相互作用に関する事前情報がない場合、ユーザーは、各パートナーの高濃度(推奨20 μM)から始めて、成分の親和性が提示された方法で維持される濃度範囲内にあるかどうかを判断する(つまり、複合体が形成される)実験を最適化する必要があります。最適化には、相互作用を促進するための他のバッファー条件の選択や、適切な混合比を決定するための相互作用成分の1つの滴定も含まれる場合があります。これらが決定されると、濃度と流量を最適化して、研究と分析法に最適な条件(濃度を下げてピーク分離能を向上させるなど)が可能になります。
第二に、この実験を正常に再現するには、不純物を最小限に抑える必要があります。質量測光測定に悪影響を及ぼすことが知られている不純物の一般的な発生源には、精製後に残存する他のタンパク質または細胞破片、ろ過されていないバッファー、ミセル形成界面活性剤(高濃度で存在する場合)、および高濃度の塩、グリセロール、またはその他の成分を含むバッファーが含まれます。上記の議定書で説明したように、マイクロ流体システム内の気泡は除去する必要があります。気泡は、チューブシステム内で形成される場合、またはサンプルの表面張力が高く、泡が形成されやすい場合に発生する可能性があります。気泡は浸漬油中にも形成され、フォーカスリングから検出できます(図3)。プロトコルに記載されている手順を使用して気泡を除去できない場合は、デシケーターと真空ポンプを使用してサンプルを脱気し、サンプルを数分間減圧下に置きます。高濃度のタンパク質溶液をボルテックスまたは振とうすることは、気泡の形成を促進する可能性があるため、推奨されません。
ここでは、1つの特定のタンパク質間相互作用の測定が実証されていますが、同じプロトコルを他のタンパク質間相互作用系にも、大きな変更を加えることなく適用することができます。このプロトコルのさらなる将来の方向性は、質量測光の文脈で他の場所で説明されているように、測定を使用して同定された錯体のKD値を計算することです5,7。以前の研究では、手動希釈とより強い相互作用を含む実験からのデータが使用されていましたが、マイクロ流体デバイスのさらなる改善が実装されれば、分析原理はこのコンテキストに容易に適用できます(流量センサーの精度とポンプの安定性の向上など)。
タンパク質間相互作用以外にも、質量測光と急速希釈マイクロ流体法を組み合わせた幅広い用途が期待されます。質量測光は、サンプルの純度、凝集、および均質性を評価するために使用できます18,19。タンパク質オリゴマー化20、高分子集合体21または重合22を研究する。そして他の分野で。質量測光分析は、タンパク質以外にも及びます。これは、核酸とタンパク質23、ウイルス粒子24、およびナノ粒子25との間の相互作用を調べるために使用されています。したがって、このプロトコルは、複合質量測光マイクロ流体システムの重要なアプリケーションを記述しています-個々の分子および複合体のレベルで弱いタンパク質間相互作用を直接測定できます。本アプリケーションの価値は高く、一般的に研究が困難であった相互作用を、重要な治療領域全体で関連性のある方法で直接特徴付ける可能性を開きます。この組み合わせたアプローチは、数十マイクロモルまでの濃度のサンプルのより広範な調査の基礎としても役立つ可能性があります。
Disclosures
The authors have nothing to disclose.
Acknowledgements
W.S.は、UKRIフューチャーリーダーズフェローシップ[MR / V02213X / 1]によってサポートされています。原稿のテキストとグラフィックは、Refeynの科学コミュニケーションチームのメンバー(Panagiota Paganopoulou、Neus Torres Tamarit、Catherine Lichten)の支援を受けて作成されました。また、Camille Hetez、Sofia Ferreira、Matthias Langhorstからの貴重なフィードバックにも感謝します。
Materials
| 2-Propanol (Isopropanol) | VWR International LLC | 20880.320 | |
| Data acquisition software | Refeyn | AcquireMP (v2022 R1) | |
| Data analysis software | Refeyn | DiscoverMP (v2022 R1) | |
| FCRN, His-Tag | Sigma | SRP0624 | |
| Herceptin (IgG) | Cambridge Bioscience | HY-P9907-1mg | |
| Mass photometer | Refeyn | TwoMP | |
| Microfluidics box | Refeyn | MassFluidix HC system | |
| Microfluidics chip | Refeyn | MassFluidix HC chip | |
| Microfluidics control software | Fluigent | OxyGEN | |
| Phosphate Buffered Saline (PBS), 1x Ultra Pure | VWR International LLC | K812 | |
| Sodium Hydroxide (NaOH) | Sigma | S2770 | |
| β-Amylase, from sweet potato | Sigma | A8781 |
References
- Arter, W. E., Levin, A., Krainer, G., Knowles, T. P. J. Microfluidic approaches for the analysis of protein-protein interactions in solution. Biophysical Reviews. 12 (2), 575-585 (2020).
- Hellenkamp, B., Thurn, J., Stadlmeier, M., Hugel, T. Kinetics of transient protein complexes determined via diffusion-independent microfluidic mixing and fluorescence stoichiometry. The Journal of Physical Chemistry. B. 122 (49), 11554-11560 (2018).
- Li, Z. Editorial: Methods in structural biology: Cryo-electron microscopy. Frontiers in Molecular Biosciences. 9, 1041386 (2022).
- Herling, T. W., et al. A microfluidic platform for real-time detection and quantification of protein-ligand interactions. Biophysical Journal. 110 (9), 1957-1966 (2016).
- Soltermann, F., et al. Quantifying protein-protein interactions by molecular counting with mass photometry. Angewandte Chemie International Edition. 59 (27), 10774-10779 (2020).
- Wu, D., Piszczek, G. Rapid determination of antibody-antigen affinity by mass photometry. Journal of Visualized Experiments: JoVE. 168, 61784 (2021).
- Wu, D., Piszczek, G. Measuring the affinity of protein-protein interactions on a single-molecule level by mass photometry. Analytical Biochemistry. 592, 113575 (2020).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Zijlstra, N., et al. Rapid microfluidic dilution for single-molecule spectroscopy of low-affinity biomolecular complexes. Angewandte Chemie International Edition. 56 (25), 7126-7129 (2017).
- MassFluidix® HC system for rapid dilution via microfluidics. Available from: https://www.refeyn.com/massfluidix-hc-system (2023)
- Pollard, T. D. A guide to simple and informative binding assays. Molecular Biology of the Cell. 21 (23), 4061-4067 (2010).
- Jarmoskaite, I., AlSadhan, I., Vaidyanathan, P. P., Herschlag, D. How to measure and evaluate binding affinities. eLife. 9, e57264 (2020).
- Monnet, C., et al. Selection of IgG variants with increased FcRn binding using random and directed mutagenesis: Impact on effector functions. Frontiers in Immunology. 6, 39 (2015).
- . Refeyn TwoMP: Transforming biomolecular characterisation Available from: https://www.refeyn.com/twomp-mass-photometer (2022)
- Lai, S. -. H., Tamara, S., Heck, A. J. R. Single-particle mass analysis of intact ribosomes by mass photometry and Orbitrap-based charge detection mass spectrometry. iScience. 24 (11), 103211 (2021).
- Wu, D., Piszczek, G. Standard protocol for mass photometry experiments. European Biophysics Journal. 50 (3-4), 403-409 (2021).
- Vaughn, D. E., Bjorkman, P. J. Structural basis of pH-dependent antibody binding by the neonatal Fc receptor. Structure. 6 (1), 63-73 (1998).
- Niebling, S., et al. Biophysical screening pipeline for Cryo-EM grid preparation of membrane proteins. Frontiers in Molecular Biosciences. 9, 882288 (2022).
- Paul, S. S., Lyons, A., Kirchner, R., Woodside, M. T. Quantifying oligomer populations in real time during protein aggregation using single-molecule mass photometry. ACS Nano. 16 (10), 16462-16470 (2022).
- Schulz, L., et al. Evolution of increased complexity and specificity at the dawn of form I Rubiscos. Science. 378 (6616), 155-160 (2022).
- Malay, A. D., et al. An ultra-stable gold-coordinated protein cage displaying reversible assembly. Nature. 569 (7756), 438-442 (2019).
- Hundt, N., Cole, D., Hantke, M. F., Miller, J. J., Struwe, W. B., Kukura, P. Direct observation of the molecular mechanism underlying protein polymerization. Science Advances. 8 (35), eabm7935 (2022).
- Acharya, A., et al. Distinct RPA domains promote recruitment and the helicase-nuclease activities of Dna2. Nature Communications. 12, 6521 (2021).
- Ebberink, E. H. T. M., Ruisinger, A., Nuebel, M., Thomann, M., Heck, A. J. R. Assessing production variability in empty and filled adeno-associated viruses by single molecule mass analyses. Molecular Therapy – Methods & Clinical Development. 27, 491-501 (2022).
- Melo, L., et al. Size distributions of gold nanoparticles in solution measured by single-particle mass photometry. The Journal of Physical Chemistry B. 125 (45), 12466-12475 (2021).

