Driedimensionale bioprinting van menselijke iPSC-afgeleide neuron-astrocyt coculturen voor screeningstoepassingen
Summary
Hier presenteren we een protocol om 3D-gebioprinte coculturen van iPSC-afgeleide neuronen en astrocyten te produceren. Dit cocultuurmodel, gegenereerd in een hydrogelsteiger in formaten met 96 of 384 putjes, toont een hoge levensvatbaarheid na het printen en neurietuitgroei binnen 7 dagen en toont de expressie van rijpheidsmarkers voor beide celtypen.
Abstract
Om een celmodel levensvatbaar te maken voor het screenen van geneesmiddelen, moet het systeem voldoen aan de vereisten voor doorvoer en homogeniteit en een efficiënte ontwikkelingstijd hebben. Veel gepubliceerde 3D-modellen voldoen echter niet aan deze criteria. Dit beperkt daarom hun bruikbaarheid bij vroege toepassingen voor het ontdekken van geneesmiddelen. Driedimensionaal (3D) bioprinten is een nieuwe technologie die kan worden toegepast op de ontwikkeling van 3D-modellen om de ontwikkelingstijd te versnellen, de standaardisatie te verhogen en de doorvoer te verhogen. Hier presenteren we een protocol voor de ontwikkeling van 3D biogeprinte cocultuurmodellen van door de mens geïnduceerde pluripotente stamcellen (iPSC)-afgeleide glutamaterge neuronen en astrocyten. Deze coculturen zijn ingebed in een hydrogelmatrix van bioactieve peptiden, extracellulaire matrix (ECM)-eiwitten over de volledige lengte en met een fysiologische stijfheid van 1,1 kPa. Het model kan snel worden vastgesteld in formaten met 96 wells en 384 wells en produceert een gemiddelde levensvatbaarheid na het printen van 72%. De verhouding tussen astrocyten en neuronen in dit model blijkt 1:1,5 te zijn, wat binnen het fysiologische bereik voor het menselijk brein ligt. Deze 3D-biogeprinte celpopulaties vertonen ook expressie van volwassen neurale celtypemarkers en groei van neuriet- en astrocytenprojecties binnen 7 dagen na kweek. Als gevolg hiervan is dit model geschikt voor analyse met behulp van celkleurstoffen en immunokleuringstechnieken naast neurietuitgroeitesten. De mogelijkheid om deze fysiologisch representatieve modellen op grote schaal te produceren, maakt ze ideaal voor gebruik in screeningstests met gemiddelde tot hoge doorvoer voor neurowetenschappelijke doelen.
Introduction
Onderzoek naar ziekten van het centrale zenuwstelsel (CZS) in de geneesmiddelenontdekkingsindustrie breidt zich uit1. Veel voorkomende CZS-ziekten zoals epilepsie, schizofrenie en de ziekte van Alzheimer hebben echter nog steeds geen genezende behandelingen 2,3,4. Het gebrek aan effectieve therapieën voor CZS-ziekten kan, althans gedeeltelijk, worden toegeschreven aan een gebrek aan nauwkeurige in vitro modellen van de hersenen. Dit heeft geresulteerd in een translationele kloof tussen de huidige in-vitromodellen en in-vivogegevens en een daaruit voortvloeiend knelpunt in de onderzoeksinspanningen.
Als gevolg van deze translationele kloof is er de afgelopen jaren een aanzienlijke toename geweest in de ontwikkeling van nieuwe 3D-celmodellen, waaronder neurale organoïden, neurosferoïden en op steigers gebaseerde modellen6. De 3D-structuur van deze modellen helpt bij het recapituleren van de neurale micro-omgeving, inclusief biomechanische spanningen, cel-celcontacten en de extracellulaire matrix (ECM) van de hersenen7. De hersen-ECM is een dynamisch element van de neurofysiologie dat de ruimte inneemt tussen neurale celtypen, waaronder neuronen, astrocyten, oligodendrocyten en de neurovasculaire eenheid7. Van recapitulatie van de hersen-ECM is aangetoond dat het de neuronale morfologie en het neuronale vuren beïnvloedt, en veel complexe 3D-modellen van de hersenen hebben de afzetting van ECM-eiwitten door neurale celtypen aangetoond 8,9,10,11. Op steigers gebaseerde modellen bestaan uit volwassen neurale coculturen die zijn gesuspendeerd in een poreuze synthetische of biologische hydrogelmatrix die de hersenen ECM12 vertegenwoordigt. In tegenstelling tot organoïde en sferoïde systemen, maken op steigers gebaseerde 3D-modellen het mogelijk om de aanwezige ECM-eiwitten aan te passen en hebben ze het extra voordeel dat ze kunnen worden afgestemd op de hydrogelstijfheid om biomechanische spanningen na te bootsen13,14.
Hoewel een overweldigende meerderheid van de neurale 3D-modellen een verhoogde recapitulatie van de micro-omgeving van de hersenen laat zien, zijn niet alle modellen erg geschikt voor het implementeren van toepassingen voor het ontdekken vangeneesmiddelen15. Om een 3D-model in industriële processen te kunnen implementeren, moet het systeem voldoen aan de doorvoervereisten voor screeningtoepassingen en een relatief korte ontwikkelingstijd hebben16. 3D-bioprinten is een nieuwe technologie die het potentieel biedt om neurale modellen op basis van 3D-steigers te maken met een snelle ontwikkelingstijd, een hogere doorvoer en een hogere mate van precisiecontrole, naast het wegnemen van variabiliteit veroorzaakt door menselijke fouten17. Dit protocol presenteert een 3D-cocultuurmodel van menselijke iPSC-afgeleide glutamaterge neuronen en astrocyten in een hydrogelsteiger. Deze hydrogelsteiger bevat fysiologisch representatieve bioactieve peptiden (RGD, IKVAV, YIGSR) en ECM-eiwitten binnen een mimetische biomechanische stijfheid. Deze ECM-eiwitten van volledige lengte omvatten laminine-211 over de volledige lengte en hyaluronzuur, overvloedig aanwezig in de menselijke cortex, met een stijfheid van 1,1 kPa in overeenstemming met in vivo metingen18. Dit model is praktisch ontworpen voor het ontdekken van geneesmiddelen en is gemaakt met behulp van een 3D-bioprinter in een plaatformaat met 96 of 384 putjes dat geschikt is voor screeningsanalyse met behulp van beeldvormingstechnieken met celkleurstoffen en antilichamen, naast neurietuitgroeitests. Cellen vertonen expressie van markers van neurale celtypen en groei van neuriet- en astrocytaire projecties binnen 7 dagen na kweek. Dit protocol zal dus de methodologie presenteren om een high-throughput 3D neuraal cocultuurmodel te ontwikkelen voor gebruik in toepassingen voor het ontdekken van geneesmiddelen.
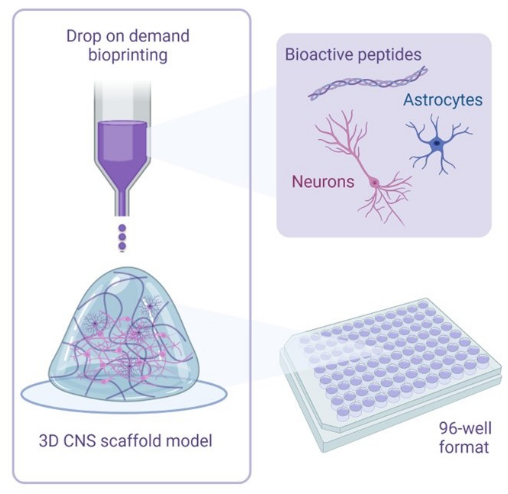
Figuur 1: Illustratief overzicht van de methodologie die wordt gebruikt voor het 3D-bioprinten van coculturen. Menselijke iPSC-afgeleide neuronen en astrocyten worden gecombineerd met activator- en bioink-oplossingen die bioactieve peptiden bevatten en worden gebioprint op hydrogelsteigers in formaten met 96 of 384 putjes met behulp van drop-on-demand bioprinttechnologie. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
De behoefte aan nauwkeurige modellen van het CZS is nog nooit zo groot geweest, en de beperkingen van tweedimensionale (2D) traditionele celkweekmodellen hebben de afgelopen jaren geleid tot een generatie complexe CZS-modellen19. Veel complexe 3D-modellen die interacties tussen neurale celtypen en de ECM weergeven, hebben echter beperkingen die de toepassing van deze modellen in industriële processen zouden verhinderen 6,20,21. In dit protocol ontwikkelen we een 3D-cocultuurmodel van menselijke iPSC-afgeleide neuronen en astrocyten, dat tot doel heeft enkele van deze beperkingen op te lossen met behulp van 3D-bioprinttechnologie om een bioactieve hydrogelsteiger te creëren in formaten met 96 putjes en 384 putjes.
De methodologie voor het ontwikkelen van deze modellen is vereenvoudigd door middel van de software voor het ontwerpen van plaatkaarten, automatisch gegenereerde printprotocollen en het begeleide printproces van de bioprinter. Vanwege de gevoelige aard van de gevoelige iPSC-afgeleide celtypen die in dit protocol worden gebruikt, moet echter voorzichtigheid worden betracht met de volgende kritieke stappen bij het ontdooien en kweken. Ten eerste heeft de opname van ROCK-remmer (ROCKi) verschillende voordelen tijdens het bioprintproces en tijdens de vroege kweek. Het ontdooien van cellen is een kritiek punt waarop de neuronen een stressreactie kunnen ervaren, en onjuiste ontdooiprotocollen kunnen de overlevingskansen verkleinen22. Het wordt meestal aanbevolen om cellen zo efficiënt mogelijk te ontdooien, media toe te voegen en cellen zo efficiënt mogelijk op incubatortemperatuur te brengen23. Tijdens het bioprintproces dat in dit protocol wordt beschreven, is het echter noodzakelijk dat neuronen en astrocyten opnieuw worden gesuspendeerd in een activatoroplossing in plaats van media, en dat cellen pas aan het einde van de printrun (tot 30 minuten na ontdooien) boven kamertemperatuur worden gebracht. De toevoeging van ROCKi aan de media onmiddellijk na het ontdooien en het opnemen van dit tijdens de twee centrifugatiestappen (stappen 2.1-2.7 en 1.3.15-1.3.20) is dus absoluut noodzakelijk om de celspanningsroutes te remmen, wat zou resulteren in lagere levensvatbaarheidsniveaus24. Bovendien is aangetoond dat ROCKi de uitgroei van neurieten bevordert en de neuronale rijping verbetert25. Zo wordt de suppletie met ROCKi voortgezet gedurende 48 uur na het bioprinten. Het is echter absoluut noodzakelijk om de ROCKi-suppletie na 48 uur te verwijderen om ervoor te zorgen dat de cellen volledig worden afgewassen tijdens de daaropvolgende mediawisselingen voordat de cellen voor de test worden gebruikt.
Een volgende stap die kritische aandacht vereist, is het toevoegen van media na het printen en het wisselen van media (stappen 2.8-2.13). De biogeprinte hydrogelsteiger heeft een equivalente biomechanische stijfheid van slechts 1,1 kPa, wat overeenkomt met grijze stof. Zoals beschreven in stap 2.10 is het van cruciaal belang om tijdens het toevoegen en opzuigen van media voorzichtig in de zijkant van de put te pipetten om verstoring te voorkomen. Dit is met name van belang voor platen met 384 putjes, waar het gelniveau een groter deel van het totale putvolume in beslag neemt. Deze methode moet ook worden gebruikt in 2D-controleputten om het optillen van de randen van cellen en het afschuiven van neurietuitgroeiingen te voorkomen. De auteurs willen ook het belang benadrukken van een steriele techniek in de bioprinter, die met dezelfde voorzichtigheid moet worden behandeld als die van een bioveiligheidskast die wordt gebruikt voor iPSC-afgeleide celculturen. Dit omvat het steriel filteren van 70% EtOH en dH2O die worden gebruikt bij de greenlight- en printprocedures, het houden van deksels op de cartridges en platen terwijl de handen in en uit de bioprinter worden bewogen, en het ontsmetten van oppervlakken in de bioprinter met 70% ethanoldoekjes voor en na het printen.
De biogeprinte hydrogelsteiger, gevormd uit bio-inkt en activatoroplossingen, geselecteerd om dit model te ontwikkelen, is geselecteerd uit een reeks bio-inkten en activatoroplossingen die door Inventia Life Science zijn ontwikkeld voor gebruik in de RASTRUM-bioprinter. Laminine en hyaluronzuur werden geïdentificeerd als moleculen die relevant zijn voor iPSC-afgeleide neuronale rijping vanwege hun rol bij axonale geleiding, synapsvorming en vorming van het perineuronale net26,27. Verder werd gekozen voor een biomechanische stijfheid van 1,1 kPa, omdat is aangetoond dat hydrogels met een lagere dichtheid een betere uitgroei van neurieten uit neuronen mogelijk maken12. Als er wijzigingen in het protocol worden aangebracht door gebruik te maken van neuronen en astrocyten die intern of van een andere commerciële leverancier zijn gedifferentieerd, wordt aanbevolen om een matrixselectietest uit te voeren om de meest ondersteunende hydrogelsteiger te bepalen15. Bovendien kan het ook nodig zijn om de celdichtheid te optimaliseren als er wijzigingen in de celbronnen worden aangebracht om een optimale levensvatbaarheid te garanderen en overbevolking van hydrogel te voorkomen. Voor alle wijzigingen en probleemoplossing met betrekking tot de bioprinterfunctie raden de auteurs aan contact op te nemen met fabrikanten en te verwijzen naar de protocollen van de fabrikant.
Het CZS bevat een breed scala aan neuronale subtypes en gliacellen, die allemaal in verschillende hersenniches bestaan en specifieke rollen hebben die bijdragen aan de neurale functie28. Binnen de context van deze brede reikwijdte vertegenwoordigt dit model alleen de twee meest voorkomende celtypen (astrocyten en excitatoire glutamaterge neuronen). Belangrijke celtypen zoals microglia, oligodendrocyten en bloed-hersenbarrièrevormende endotheelcellen worden uit dit systeem weggelaten. De opname van microglia zou van belang kunnen zijn bij de focus op neuro-immuuninteracties, en oligodendrocyten zouden van belang kunnen zijn bij ziekten die centrale myelinisatie beïnvloeden. Naast hun rol in de pathologie scheiden cellen zoals bloed-hersenbarrièrevormende endotheelcellen geneesmiddelmetaboliserende enzymen uit, wat het gebruik van dit model voor farmacokinetische assays zou kunnen beïnvloeden29. Een verdere beperking van het model kan de verhouding tussen astrocyten en neuronen zijn; De verhouding tussen astrocyten en neuronen varieert sterk tussen hersengebieden, met voorgestelde waarden tussen 1:1 en 1:330,31. Dit model heeft een geschatte verhouding van 1:1,5 astrocyten tot neuronen; Dit model is dus mogelijk niet relevant voor het modelleren van hersengebieden waar astrocyten overvloediger voorkomen, zoals in gebieden met wittestof30.
Andere protocollen om 3D-biogeprinte cocultuurmodellen te ontwikkelen, zijn de afgelopen jaren gepubliceerd. Een publicatie van Sullivan et al., 2021, presenteerde een 3D-biogeprint neuraal model met behulp van iPSC-afgeleide neurale voorlopercellen, dat een hoge levensvatbaarheid na het printen en verbetering van de neuronale functie aantoont in vergelijking met 2D-culturen32. In dit protocol werden neurale voorlopercellen echter gebruikt als celbron en werden ze gedurende 4 weken in kweek gehouden. In dit protocol werden in de handel verkrijgbare iPSC-afgeleide glutamaterge neuronen en astrocyten gebruikt. Hierdoor kan in slechts 7 dagen een 3D-netwerk van co-gekweekte cellen worden opgezet; Zoals aangetoond door de analyse van de neurietgroei, begint de uitgroei van neurieten binnen 24 uur en gaat deze lineair door gedurende de periode van 156 uur waarin de celgroei werd gevolgd. De snelle oprichting van deze netwerken kan gedeeltelijk worden toegeschreven aan het gebruik van glutamaterge neuronen die gebruik maken van geoptimaliseerde doxycycline-induceerbare genexpressie van NGN2, die expressie van volwassen neuronale subtypemarkers binnen 7 dagen vertoont, zelfs in 2D-cultuur33. Het verkorten van deze groeiperiode met behulp van deze techniek is belangrijk voor het implementeren van modellen binnen de biofarmaceutische industrie, aangezien de ontwikkeling van tests een snelle doorlooptijd en ontwikkeling van celmodellenvereist15.
Concluderend toont dit model potentieel voor een 3D-model van neuronen en astrocyten, dat snel en gemakkelijk kan worden opgesteld voor screeningsdoeleinden. Toekomstige toepassingen voor dit modeltype zouden kunnen zijn voor het ontdekken van geneesmiddelen voor verschillende CZS-ziekten, met de mogelijkheid om uit te breiden naar verschillende ziekten met behulp van iPSC-lijnen voor patiënten of gen-bewerkte ziekten. Bovendien zorgt het gebruik van doxycycline-induceerbare NGN2-expressie iPSC-afgeleide glutamaterge neuronen ervoor dat cellen in minder tijd volwassen kunnen worden, wat kan worden gebruikt voor het ontwikkelen van modellen van het ouder wordende brein voor neurodegeneratieonderzoek. Dit systeem kan ook worden uitgebreid door het gebruik van extra celtypen in cocultuur, waaronder microglia en oligodendrocyten.
Disclosures
The authors have nothing to disclose.
Acknowledgements
De auteurs willen Alex Volkerling, Martin Engel en Rachel Bleach bedanken voor hun hulp bij het ontwikkelen van het protocol en de feedback op het manuscript.
Materials
| 2-mercaptoethanol | Thermofisher | 31350010 | |
| 384-well plate | PerkinElmer | 6057300 | |
| 96-well plate | PerkinElmer | 6055300 | |
| Activator fluid F299 | Inventia Life Science | N/A | |
| Activator fluid F3 | Inventia Life Science | N/A | |
| B27 (50x) minus Vit A | Thermofisher | 12587010 | |
| Bioink fluid F261 | Inventia Life Science | N/A | |
| Bioink fluid F32 | Inventia Life Science | N/A | |
| Doxycycline hyclate | Sigma Aldrich | D5207 | |
| GlutaMAX (100x) | Thermofisher | 35050061 | |
| Goat anti-mouse IgG H&L Alexa Fluor 647 | Abcam | ab150115 | |
| Goat anti-rabbit IgG H&L Alexa Fluor 488 | Abcam | ab150077 | |
| Hoechst | Abcam | ab228551 | |
| Human BDNF Recombinant Protein | Thermofisher | PHC7074 | |
| Human NT3 Recombinant Protein | Thermofisher | PHC7036 | |
| iCell Astrocytes | Fujifilm CDI | 1434 | |
| INCell Analyser 6500HS | Molecular Devices | N/A | high content imaging system |
| Incucyte S3 | Sartorius | N/A | |
| ioGlutamatergic Neurons (Large vial) | Bit.bio | e001 | |
| Laminin (1 mg/mL) | Sigma Aldrich | L2020 | |
| Live/dead kit (Calcein-AM, Ethidium homo-dimer-1) | Invitrogen | L3224 | |
| Mouse anti-BIII tubulin NL637 conjugated | R&D systems | SC024 | |
| Neurobasal media | Thermofisher | 21103049 | |
| Normal Donkey Serum | Abcam | ab7475 | |
| NucBlue Live (Hoechst 33342) | Thermofisher | R37605 | |
| Opti-MEM | Thermofisher | 11058021 | |
| Paraformaldehyde | Sigma Aldrich | P6148 | |
| PEI 50% in H2O | Sigma Aldrich | 181978 | |
| Pierce Borate Buffer 20x | Thermofisher | 28341 | |
| Prism | GraphPad | Data analysis software | |
| Rabbit anti-ionotropic glutamatre receptor 2 (GluR2) | Abcam | ab206293 | |
| RASTRUM(TM) Bioprinter | Inventia Life Science | N/A | Bioprinter |
| RASTRUM(TM) Bioprinter Cartridges | Inventia Life Science | N/A | Bioprinter Cartridges |
| RASTRUM(TM) Targeting plate | Inventia Life Science | N/A | Targeting plate |
| Rho kinase (ROCK) inhibitor | Abcam | ab120129 | |
| Sheep anti-GFAP NL493 conjugated | R&D systems | SC024 | |
| Signals Image Artist | PerkinElmer | N/A | Image analysis platform |
| Triton X-100 | Thermofisher | HFH10 | |
| Zeiss Axio Observer | Zeiss | N/A | Inverted microscope platform |
References
- Jung, Y. L., Hwang, J., Yoo, H. S. Disease burden metrics the innovations of leading pharmaceutical companies: a global and regional comparative study. Globalization and Health. 16 (1), 80-80 (2020).
- Potkin, S. G., et al. The neurobiology of treatment-resistant schizophrenia: paths to antipsychotic resistance and a roadmap for future research. npj Schizophrenia. 6, 1 (2020).
- Zahra, W., et al., Keswani, C., et al. The Global Economic Impact of Neurodegenerative Diseases: Opportunities and Challenges. Bioeconomy for Sustainable Development. , (2019).
- Perucca, E. The pharmacological treatment of epilepsy: recent advances and future perspectives. Acta Epileptologica. 3 (1), 22 (2021).
- Nikolakopoulou, P., et al. Recent progress in translational engineered in vitro models of the central nervous system. Brain. 143 (11), 3181-3213 (2020).
- Whitehouse, C., Corbett, N., Brownlees, J. 3D models of neurodegeneration: implementation in drug discovery. Trends in Pharmacological Sciences. 44 (4), 208-221 (2023).
- Rauti, R., Renous, N., Maoz, B. M. Mimicking the brain extracellular matrix in vitro: A review of current methodologies and challenges. Israel Journal of Chemistry. 60 (12), 1141-1151 (2020).
- Fawcett, J. W., Oohashi, T., Pizzorusso, T. The roles of perineuronal nets and the perinodal extracellular matrix in neuronal function. Nature Reviews Neuroscience. 20 (8), 451-465 (2019).
- Lam, D., et al. Tissue-specific extracellular matrix accelerates the formation of neural networks and communities in a neuron-glia co-culture on a multi-electrode array. Scientific Reports. 9, 4159 (2019).
- Roll, L., Lessmann, K., Brüstle, O., Faissner, A. Cerebral organoids maintain the expression of neural stem cell-associated glycoepitopes and extracellular matrix. Cells. 11 (5), 760 (2022).
- Yan, Y., Bejoy, J., Marzano, M., Li, Y. The use of pluripotent stem cell-derived organoids to study extracellular matrix development during neural degeneration. Cells. 8 (3), 242 (2019).
- Ma, L., et al. 3D bioprinted hyaluronic acid-based cell-laden scaffold for brain microenvironment simulation. Bio-Design and Manufacturing. 3 (3), 164-174 (2020).
- Liaw, C. -. Y., Ji, S., Guvendiren, M. Engineering 3D hydrogels for personalized in vitro human tissue models. Advanced Healthcare Materials. 7 (4), 1701165 (2018).
- Ma, J., Huang, C. Composition and mechanism of three-dimensional hydrogel system in regulating stem cell fate. Tissue Engineering Part B: Reviews. 26 (6), 498-518 (2020).
- Belfiore, L., et al. Generation and analysis of 3D cell culture models for drug discovery. European Journal of Pharmaceutical Sciences. 163, 105876 (2021).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6 (2018).
- Engel, M., Belfiore, L., Aghaei, B., Sutija, M. Enabling high throughput drug discovery in 3D cell cultures through a novel bioprinting workflow. SLAS Technology. 27 (1), 32-38 (2022).
- Takamura, T., et al. Influence of age on global and regional brain stiffness in young and middle-aged adults. Journal of Magnetic Resonance Imaging. 51 (3), 727-733 (2020).
- Slanzi, A., Iannoto, G., Rossi, B., Zenaro, E., Constantin, G. In vitro models of neurodegenerative diseases. Frontiers in Cell and Developmental Biology. 8, 328 (2020).
- de Souza, N. Organoid variability examined. Nature Methods. 14 (7), 655-655 (2017).
- Hernández, D., et al. Culture variabilities of human iPSC-derived cerebral organoids are a major issue for the modelling of phenotypes observed in Alzheimer’s disease. Stem Cell Review and Reports. 18 (2), 718-731 (2022).
- Li, R., et al. Differentiation of human iPS cells into sensory neurons exhibits developmental stage-specific cryopreservation challenges. Frontiers in Cell and Developmental Biology. 9, 796960 (2021).
- Nishiyama, Y., et al. Safe and efficient method for cryopreservation of human induced pluripotent stem cell-derived neural stem and progenitor cells by a programmed freezer with a magnetic field. Neuroscience Research. 107, 20-29 (2016).
- Uhrig, M., Ezquer, F., Ezquer, M. Improving cell recovery: Freezing and thawing optimization of induced pluripotent stem cells. Cells. 11 (5), 799 (2022).
- Harbom, L. J., et al. The effect of rho kinase inhibition on morphological and electrophysiological maturity in iPSC-derived neurons. Cell and Tissue Research. 375 (3), 641-654 (2019).
- Koh, H. S., Yong, T., Chan, C. K., Ramakrishna, S. Enhancement of neurite outgrowth using nano-structured scaffolds coupled with laminin. Biomaterials. 29 (26), 3574-3582 (2008).
- Tarus, D., et al. Design of hyaluronic acid hydrogels to promote neurite outgrowth in three dimensions. ACS Applied Materials & Interfaces. 8 (38), 25051-25059 (2016).
- Brain Initiative Cell Census Network (BICCN). Initiative Cell Census Network (BICCN). A multimodal cell census and atlas of the mammalian primary motor cortex. Nature. 598 (7879), 86-102 (2021).
- Dauchy, S., et al. Expression and transcriptional regulation of ABC transporters and cytochromes P450 in hCMEC/D3 human cerebral microvascular endothelial cells. Biochemical Pharmacology. 77 (5), 897-909 (2009).
- Herculano-Houzel, S. The glia/neuron ratio: How it varies uniformly across brain structures and species and what that means for brain physiology and evolution. Glia. 62 (9), 1377-1391 (2014).
- von Bartheld, C. S., Bahney, J., Herculano-Houzel, S. The search for true numbers of neurons and glial cells in the human brain: A review of 150 years of cell counting. The Journal of Comparative Neurology. 524 (18), 3865-3895 (2016).
- Sullivan, M. A., et al. 3D bioprinting of stem cell-derived central nervous system cells enables astrocyte growth, vasculogenesis and enhances neural differentiation/function. bioRxiv. , (2022).
- Pawlowski, M., et al. Inducible and deterministic forward programming of human pluripotent stem cells into neurons, skeletal myocytes, and oligodendrocytes. Stem Cell Reports. 8 (4), 803-812 (2017).

