Introduction
Et væld af eksperimentelle data har illustreret, at epikardiet påvirker kritiske trin i hjertets udvikling. Under udvikling, septum transversum giver anledning til en klump af mesotelceller kendt som proepicardium 1-4. Celler fra proepicardium derefter migrere og kuvert myokardiet danner epicardium. Efter denne, en delmængde af epikardiale celler undergår EMT giver anledning til en vandrende population af epikardiet-afledte celler (EPDCs), der efterfølgende invadere myokardiet. Genetisk samt retroviral afstamning opsporing eksperimenter har vist, at EPDCs differentiere til forskellige slægter, herunder glatte muskelceller, fibroblaster, endotelceller og cardiomyocytter (hvis nogen). Derfor EPDCs bidrage væsentligt til udviklingen af den koronare kar og myokardie arkitektur 1,2,4-9. Endvidere epicardiet er afgørende for udviklingen af den ventrikulære kompakt lag 10-12. Til eKSEMPEL Gittenberger-de Groot et al. viste, at inhibering af udvækst af proepicardium fører til en matrix af defekter, såsom en tynd myocardium, mangelfuld dublering af hjertet og unormal interventricular septum formation og som et resultat, embryonisk letalitet 13. Parakrine faktorer secerneret fra den embryoniske epicardium modulere cardiomyocyte proliferation og differentiering. I overensstemmelse hermed epicardium-specifik deletion af signalveje, såsom retinsyre (RA), fibroblastvækstfaktorer (FGF'er) og Wnt / β-catenin resulterede i defekt myocardial vækst og embryonale letalitet 14-16.
Selvom epicardium mentes at være hvilende i voksne hjerter, de seneste undersøgelser har vist, at den udviklingsmæssige program genaktiveres i epikardiet efter kardiel skade 17,18. Ved aktivering cellerne undergå hurtig proliferation og EMT, der resulterer i EPDC formation. Disse celler udviser den capacity at differentiere til fibroblast og glatte muskelceller, men ikke cardiomyocytter eller endotelceller 18. Desuden EPDCs udskiller proangiogene faktorer, støtte i vaskularisering af det skadede område og dermed lette forbedret hjertefunktion ved at reducere infarkt størrelse. På grund af disse resultater, har epicardiet fået interesse for studiet af kardiovaskulær udvikling, sygdom og regenerering.
Transgen teknologi har revolutioneret den medicinske forskning i det 21. århundrede. Ved hjælp af transgene teknologier, har syge musemodeller efterligner den menneskelige tilstand metabolisk og patofysiologisk blevet udviklet. Imidlertid studere epikardial celle adfærd i disse mutanter har været en udfordring hovedsageligt på grund af den tidlige embryonale letalitet. I betragtning af den betydelige rolle, som epikardiet spiller i hjertets udvikling og regeneration, har vi etableret et in vitro system til mus epicardia kulturL-celler. Denne fremgangsmåde tillader langtidsdyrkning af de epikardielle celler og letter detaljeret undersøgelse af de to vigtige egenskaber ved epicardiet: dens evne til at migrere og differentiere. Det udskårne ventrikler fra musen kunne dyrkes på kollagengeler, som kan anvendes til at udføre migration assays. Dyrkes i en 3D matrix, der replikerer kollagen-rige ekstracellulære matrix subepicardial lag bedre rekapitulerer in vivo celle fysiologi. Alternativt kan de dyrkes på kammerobjektglas for at etablere en epikardial monolag, som derefter kan anvendes til en række af efterfølgende anvendelser. Dette monolag kan anvendes til farvning for tight junction-proteiner, som vil give indsigt på evnen af epicardiet at undergå EMT som er afgørende for migration. Desuden kan differentieringsfaktorer eksperimenter også udføres på disse celler. Endvidere kan genekspressionsprofil analyseres ved at ekstrahere RNA fra cellerne ogudfører kvantitativ polymerasekædereaktion (qPCR). Endelig kunne monolagene også behandles med midler, efterfulgt af en molekylær analyse til at teste for potentielle lægemidler. Sammensæt dette epikardial kultur system giver os mulighed for at visualisere og indsamle molekylære data, der fremmer vores forståelse om epikardial udvikling.
Et andet ønskeligt træk ved denne fremgangsmåde er, at det er ligetil og ingen store konfiguration er nødvendig. Kort fortalt er de embryoner høstet ved E11.5 eller E12.5 hvorefter hjertet udskæres. Hjertekamrene dyrkes derefter enten kollagengel eller kammerskiver. Efterfølgende kan disse celler anvendes til at udføre nedstrøms eksperimenter.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Alle forsøg blev godkendt af Duke-NUS Graduate Medical School Institutional Animal Care og brug Udvalg.
1. Henter den Embryonale ventriklerne
- Sacrifice en tidsindstillet gravid musen på det ønskede fosterstadiet (E11.5 eller E12.5) ved hjælp af en eutanasi kammer med kuldioxid gasforsyning eller en anden godkendt eutanasi metode.
- Placer musen på ryggen på en dissekere bord. Desinficere maven af hun med 70% ethanol. Løft huden over maven og lave et lille snit (1-2 cm) med en kniv, så hold huden med begge hænder og trække væk for at eksponere bugvæggen.
- Nu sender en bugvæggen for at blotlægge den uterine horn. Brug steril pincet til at løfte den uterine horn og omhyggeligt skåret væk fedtvæv og blodkar knyttet til den uterine horn. Skæres ved livmoderhalsen at hente livmoderen.
- Placer uterine horn i en petriskål indeholdende steril kold 1x Phosphate Buff ob- saltvand (PBS) og skyl forsigtigt. Placer petriskål på is.
- Brug en saks til at skære igennem midterlinjen af uterine horn (modsat det sted, hvor moderkagen er placeret) at eksponere embryoner, der stadig er inde i blommesækken og fastgjort til livmodervæggen gennem moderkagen.
- Anvendelse af steril pincet, skar den embryoniske blommesækken at frigøre embryoet.
- Placer embryo i en ny petriskål indeholdende steril kold 1x PBS. Halshugge fosteret og placere den på ryggen. Skåret op brystvæggen for at blotlægge hjertet.
- Brug sterile pincet til at løfte hjerte og skåret væk skibene omkring det at frigøre hjertet fra brystvæggen. Vær særlig opmærksom på ikke at beskadige epikardiet af hjertet med de kirurgiske værktøjer.
- Skær udstrømningen tarmkanalen og begge forkamre. Overfør ventriklen til en anden skål med kold 1x PBS. Sæt fadet på is.
- Gentag trin 1,6-1,9 Til alle hjertekamrene skal hentes.
Bemærk: Kultur disse epikardielle eksplantater enten på glas kammer dias eller på kollagen gel til efterfølgende anvendelser.
- Glas Chamber Slides
- Til fremstilling af dyrkningsmedier, der tilsættes 10% føtalt bovint serum (FBS), 1% penicillin / streptomycin og 2 ng / ml rekombinant fibroblastvækstfaktor 2 (FGF2) til Dulbeccos modificerede Eagles medium (DMEM). Udfør alle trin i laminar flow hætte.
- Tilføj 500 pi dyrkningsmedier til hver brønd af en 8-brønds kammer.
- Sted hvert udskåret ventrikel i centrum af en brønd. Orientere ventrikel for at holde det dissekerede side nedad på den nedre overflade af brønden.
- Læg forsigtigt pladen i en 37 ° C, 5% CO2 cellekultur inkubator.
- Oprethold kulturen med minimal forstyrrelse for at give eksplantaterne til at overholde. Dannelse af epicardiale monolag kan observeres efter 48-72 timer.
- For differentiering af epicardial celler i glatte muskelceller, kultur de epicardiale monolag celler i differentiering medier til yderligere 6 dage. Til fremstilling af differentiering medier, tilsættes 10% FBS, 1% penicillin / streptomycin og 50 ng / ml rekombinant transformerende vækstfaktor beta 1 (TGF-β1) til DMEM.
- Skift dyrkningsmediet hver anden dag.
- collagen Gel
- Forbered kollagengelen i en 96-brønds plade under anvendelse af et kommercielt 3D Collagen Culture kit ifølge producentens protokol.
- Til fremstilling af den ønskede mængde af kollagengel, blandes den passende mængde af kollagen opløsning med 5x DMEM og pipette op og ned. Opløsningen skal blive gul.
- Tilføj et tilsvarende volumen af neutralisering opløsning og bland godt straks ved pipettering op og ned. Løsningen bliver lyserød.
- Afpipetteres 100 ul af denne blanding i hver brønd på en plade med 96 brønde. Pladen anbringes i en 37 ° C, 5% CO2 inkubator i 30-60 min til allav gelen til at polymerisere.
- Tilsæt 200 pi dyrkningsmedier er beskrevet ovenfor til hver brønd.
- Sted hvert udskåret ventrikel i centrum af en brønd. Orient ventriklen at holde det dissekerede side nedad på kollagengelen (apex af ventriklen skal vende forsøgslederen). Sæt forsigtigt pladen tilbage i cellekultur inkubator.
- Efter 3 dage, fjerne hjertekamrene. Sæt pladen tilbage i cellekultur inkubator i yderligere 2 dage.
- Skift dyrkningsmediet hver anden dag.
3. Fiksering og visualisering
Bemærk: Epikardielle celler kan visualiseres på enten glas kammerskiver eller kollagengel.
- Aspirer ud dyrkningsmediet og tilsættes samme volumen sterilt 1x PBS for at vaske cellerne.
- Tilføj lige nok 4% paraformaldehyd (PFA) til dækning af cellerne. Fikseres cellerne i 10 minutter ved 4 ° C.
- Fjern PFA og vask eksplantater med 1x PBST (1x PBS med0,1% Triton X-100) for at permeabilisere cellerne.
- Immunfarvning med ønskede antistof (f.eks Alexa Fluor 488-phalloidin; ZO-1, α-tubulin og α-glatmuskelactin) 7.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Ved hjælp af denne kultur-protokol, kan primære epikardielle celler isoleres med høj renhed til efterfølgende anvendelser. De dyrkede celler er i stand til at undergå EMT, migrere og differentiere lige så epikardiale celler gør in vivo.
For at bestemme renheden af vores primære epikardial cellekultur, vi analyserede epikardielle eksplantaterne genereret fra Sema3d GFPCre / +; R26 Tom / + fostre. Sema3d udtrykkes i epikardielle celler under tidlig hjerte-udvikling, således epikardielle celler afledt af disse embryoner vil være RFP mærkes. Vi isoleret hjertekamrene fra Sema3d GFPCre / +; R26 Tom / + embryoner til epikardielle eksplantater. Efter 48-72 timer, var vi i stand til at se et monolag af epikardielle celler. Indkopiering RFP immunofluorescens og lysfelt billeder viste, at et flertalDe celler, der migrerede fra hjertekamrene er af epicardiale oprindelse (figur 1A - C). Vi yderligere valideret vores resultater ved at isolere RNA fra primære epikardiale celler og udføre qPCR der viste en stærk ekspression af epikardielle specifikke gener (Tbx18 og WT1) i modsætning til en cardiomyocyte markørgen (Nkx2.5) (figur 1C).
Næste undersøgte vi evnen hos cellerne til at undergå EMT ved at analysere cellepolaritet og celle-celle-kontakt af epikardielle celler. EMT er en biologisk proces, der giver en epitelcelle at miste sin celle polaritet og celle-celle-kontakt for at omdanne sig til en vandrende mesenchymal celle. Det første trin i EMT er udstationering af celle-celle kontakter. Vi immunfarvet epikardiale celler med ZO-1 (også kendt som Tjp1, Tight junction protein 1), som viste lokalisering af ZO-1 til plasmamembranen indikerer, at celler harendnu at undergå EMT (figur 2A). Næste vi spillede immunfarvning for α-tubulin (Figur 2B), således at observere organiseringen af mikrotubuli i epikardielle eksplantater, som viste et polariseret tilpasning, der letter retningsbestemt vandring af epikardielle celler. Desuden at bestemme differentiering potentiale epikardiale celler, dyrkede vi dem i 6 dage i en differentiering medier indeholdende rekombinant TGF-β1. Immunfarvning for SMA demonstrerede vellykket differentiering af epikardiale celler i glatte muskelceller (figur 2C).
Endelig at analysere epikardiet-afledt celle migration og epikardial EMT, udførte vi også en kollagengel invasion assay. Epicardium-afledte celler blev visualiseret ved phalloidin immunfarvning. Vellykket migrering af epikardiet-afledte celler kan ses rundt omkring eksplantatet (figur 3A). For at bestemme depth af celle indtrængen i kollagenmatrix blev 3D-rekonstruktion genereret fra konfokale billeder. Penetration af epicardium-afledte celler kan ses i z-stakke (figur 3B).
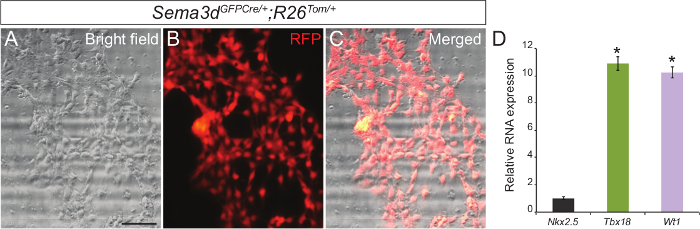
. Figur 1: Primær kultur af Epikardielle Celler fra Embryonale Mouse Hearts repræsentant lysfelt (A) og RFP immunofluorescens (B) billeder af primære epikardiale celler genereret fra E12.5 Sema3d GFPCre / +; R26 Tom / + hjerter. Merged lysfelt og immunofluorescens billede (C). Relative mRNA ekspressionsniveauer af epikardiale markører (Tbx18 og WT1) og cardiomyocyte markør (Nkx2.5) i primære epikardiale celler (D). Resultaterne blev normaliseret til GAPDH udtryk, og relative ekspressionsniveauer er givet som en fold forskel i forhold til Nkx2.5 ekspression (n = 3). Dataene er præsenteret som middelværdi ± SD. Scale bar = 200 um. *, P <0,05. Klik her for at se en større version af dette tal.
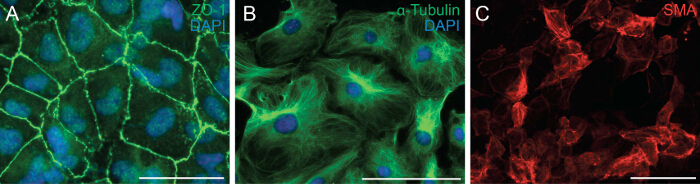
Figur 2: Primær Epikardielle Cells bevarer deres evne til at undergå EMT og Differentiering Immunfarvning om epikardielle eksplantater for ZO-1 (A, grøn) eller α-tubulin (B, grøn).. DAPI blev anvendt til at visualisere cellekerner (blå). Epikardielle celler blev differentieret i glatte muskelceller i 6 dage og farvet med α-glatmuskelactin (SMA) (C, rød). Scale bar = 100 um.3993fig2large.jpg "target =" _ blank "> Klik her for at se en større version af dette tal.

Figur 3:. Epikardial cellevandring på kollagengelen Surface hjertekamrene fra E12.5 embryoer blev dyrket på en tredimensional kollagen gelmatrix og farvet med Alexa Fluor 488-phalloidin at visualisere epikardiet-afledt celle migration og penetration (A). Konfokale billeder blev anvendt til at konstruere et tredimensionalt billede til bestemmelse cellepenetration langs z-aksen (B). Scale bar = 50 um. Klik her for at se en større version af dette tal.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Det er afgørende at udvikle teknikker, som letter undersøgelsen af epicardiet at imødekomme den stigende betydning af epicardiet i hjertets udvikling og regeneration. Det epikardial kultur-systemet udgør betydelige fordele for epikardial forskning.
En alternativ måde at isolere epikardielle celler er at anvende fluorescensaktiveret cellesortering (FACS). Denne metode bygger på anvendelsen af epikardiale markører (eller epicardium-cellespecifik transgen ekspression af en fluorescerende protein) for at adskille epikardielle celler fra andre afstamninger. Men en stigende mængde beviser har vist, at epikardiale markører ikke udelukkende udtrykkes i epicardiet. For eksempel er Tbx18 udtrykt i myokardiet af interventricular septum (IVS), mens WT1 udtrykkes i endothelium 19-21. Derfor er renheden af populationen af epikardiale celler isoleret er tvivlsom. I modsætning hertil dyrkningsmetode beskrevet her tager endvantage af vandrende karakter epikardielle celler. Dette muliggør isolering af en meget ren population af epikardiale celler som vist ved vores genetiske eksperimenter mærkning. En anden måde at opnå epikardielle celler ville være differentieringen af humane pluripotente stamceller (hPSCs) i epikardiale celler ved at modulere primært BMP, WNT og retinsyre signalveje. Disse differentierede celler ligner de fysiske og molekylære karakteristika af embryonale epikardielle celler. De er ikke kun i stand til at undergå EMT men er også i stand til at differentiere til fibroblaster og glatte muskelceller 22,23. Selvom denne metode er meget lovende, det er betydeligt mere kompliceret og tidskrævende end den epikardial kultur beskrevet i dette dokument.
Hertil kommer, at denne kultur teknik ikke kræve yderligere specialiseret udstyr og en eksisterende vævskultur opsætning er tilstrækkelig. Mens efter denne protokol, er det afgørende at betale sÆRLIGE opmærksom på ikke at beskadige epikardiet med kirurgiske værktøjer, når du henter hjertet. Desuden er det kritisk at orientere udskåret ventrikel med det dissekerede side vendende enten overfladen af kollagen gel eller kammer slide for at lette epikardiel cellemigrering. Endelig bør kulturen vedligeholdes med minimal forstyrrelse, således at eksplantatet at klæbe til dyrkningsskålen.
Populationen af celler opnået kan derefter anvendes til at udføre en række downstream eksperimenter, som vil fremme vores forståelse af epikardiel cellebiologi. Dyrkning eksplantaterne på kammeret dias giver epikardielle monolag til forskellige forsøg, herunder epikardial celleproliferation, overlevelse, migration, EMT og differentiering i hjerte-slægter. Det giver også en mulighed for at teste virkningen af lægemidler på de cellulære egenskaber epicardiet samt genekspression forandringer forbundet med lægemiddelbehandling. Desuden culturing epicardiet på kollagengeler muliggør analysen af cellerne i en 3D matrix i stedet for den traditionelle 2D matrix, som tilvejebringer en mere nøjagtig illustration af in vivo fysiologi.
En ulempe ved denne teknik, vil imidlertid være, at denne metode kun kan anvendes til dyrkning af epikardielle celler fra embryonale hjerte mellem E11.5-E12.5. Under senere drægtighed eller i den neonatale periode epicardium mister evnen til at formere sig og migrere. Det er således vanskeligt at anvende denne dyrkningsmetode til isolering epikardielle celler fra senere fosterstadier eller voksne mus.
Trods denne begrænsning, denne teknik anvender grundlæggende dyrkningsbetingelser færdigheder og opsætning for at lette væksten af epikardiale celler ex vivo, hvilket ville være meget gavnligt for studiet af epicardiet og dens roller i hjertefunktion udvikling og regeneration.
Subscription Required. Please recommend JoVE to your librarian.
Acknowledgments
Dette arbejde blev støttet af midler fra DUKE-NUS Graduate Medical School Singapore, Goh fundament og Singapore NRF fællesskab (NRF-NRFF2016-01) til Manvendra K. Singh.
Materials
| Name | Company | Catalog Number | Comments |
| Dulbecco’s modified Eagle’s medium (DMEM) | Life tech invitrogen | 11995065 | |
| Penicillin/streptomycin solution | Life tech invitrogen | 15140122 | |
| Fetal bovine serum (FBS) | Life tech invitrogen | 10500064 | |
| Paraformaldehyde | Sigma | P6148-5KG | |
| Recombinant fibroblast growth factor 2 (FGF2) | PeproTech | 450-33 | |
| Recombinant transforming growth factor beta 1 (TGF-β1) | PeproTech | 100-21 | |
| ZO-1 antibody | Life tech invitrogen | 40-2200 | |
| α-Tubulin antibody | Sigma | T 6074 | |
| α-smooth muscle actin (SMA) antibody | Sigma | A 2547 | |
| Phalloidin antibody | Life tech invitrogen | A12379 | |
| 3D Collagen Culture kit | Millipore | ECM 675 | |
| 8-well chamber slide | Fisher Scientific | NNU 154534-PK | |
| Trizol reagent | Life Technologies | 15596-018 | |
| ViiA 7 Real-Time PCR System | Life Technologies | 4453536 | |
| Superscript First Strand Synthesis kit | Life Technologies | 11904-018 |
References
- Mikawa, T., Fischman, D. A. Retroviral analysis of cardiac morphogenesis: discontinuous formation of coronary vessels. Proc Natl Acad Sci U S A. 89, 9504-9508 (1992).
- Mikawa, T., Gourdie, R. G. Pericardial mesoderm generates a population of coronary smooth muscle cells migrating into the heart along with ingrowth of the epicardial organ. Dev Biol. 174, 221-232 (1996).
- Manner, J., Perez-Pomares, J. M., Macias, D., Munoz-Chapuli, R. The origin, formation and developmental significance of the epicardium: a review. Cells Tissues Organs. 169, 89-103 (2001).
- Gittenberger-de Groot, A. C., Vrancken Peeters, M. P., Mentink, M. M., Gourdie, R. G., Poelmann, R. E. Epicardium-derived cells contribute a novel population to the myocardial wall and the atrioventricular cushions. Circ Res. 82, 1043-1052 (1998).
- von Gise, A., Pu, W. T. Endocardial and epicardial epithelial to mesenchymal transitions in heart development and disease. Circ Res. 110, 1628-1645 (2012).
- Katz, T. C., et al. Distinct compartments of the proepicardial organ give rise to coronary vascular endothelial cells. Dev Cell. 22, 639-650 (2012).
- Singh, M. K., Lu, M. M., Massera, D., Epstein, J. A. MicroRNA-processing enzyme Dicer is required in epicardium for coronary vasculature development. J Biol Chem. 286, 41036-41045 (2011).
- Degenhardt, K., Singh, M. K., Epstein, J. A. New approaches under development: cardiovascular embryology applied to heart disease. J Clin Invest. 123, 71-74 (2013).
- Singh, M. K., Epstein, J. A. Epicardium-derived cardiac mesenchymal stem cells: expanding the outer limit of heart repair. Circ Res. 110, 904-906 (2012).
- Manner, J. Experimental study on the formation of the epicardium in chick embryos. Anat Embryol (Berl). 187, 281-289 (1993).
- Manner, J., Schlueter, J., Brand, T. Experimental analyses of the function of the proepicardium using a new microsurgical procedure to induce loss-of-proepicardial-function in chick embryos. Dev Dyn. 233, 1454-1463 (2005).
- Pennisi, D. J., Ballard, V. L., Mikawa, T. Epicardium is required for the full rate of myocyte proliferation and levels of expression of myocyte mitogenic factors FGF2 and its receptor, FGFR-1, but not for transmural myocardial patterning in the embryonic chick heart. Dev Dyn. 228, 161-172 (2003).
- Gittenberger-de Groot, A. C., Vrancken Peeters, M. P., Bergwerff, M., Mentink, M. M., Poelmann, R. E. Epicardial outgrowth inhibition leads to compensatory mesothelial outflow tract collar and abnormal cardiac septation and coronary formation. Circ Res. 87, 969-971 (2000).
- Lavine, K. J., et al. Endocardial and epicardial derived FGF signals regulate myocardial proliferation and differentiation in vivo. Dev Cell. 8, 85-95 (2005).
- Merki, E., et al. Epicardial retinoid X receptor alpha is required for myocardial growth and coronary artery formation. Proc Natl Acad Sci U S A. 102, 18455-18460 (2005).
- Stuckmann, I., Evans, S., Lassar, A. B. Erythropoietin and retinoic acid, secreted from the epicardium, are required for cardiac myocyte proliferation. Dev Biol. 255, 334-349 (2003).
- Huang, G. N., et al. C/EBP transcription factors mediate epicardial activation during heart development and injury. Science. 338, 1599-1603 (2012).
- Zhou, B., et al. Adult mouse epicardium modulates myocardial injury by secreting paracrine factors. J Clin Invest. 121, 1894-1904 (2011).
- Christoffels, V. M., et al. Tbx18 and the fate of epicardial progenitors. Nature. 458, 8-9 (2009).
- Rudat, C., Kispert, A. Wt1 and epicardial fate mapping. Circ Res. 111, 165-169 (2012).
- Duim, S. N., Kurakula, K., Goumans, M. J., Kruithof, B. P. Cardiac endothelial cells express Wilms' tumor-1: Wt1 expression in the developing, adult and infarcted heart. J Mol Cell Cardiol. 81, 127-135 (2015).
- Iyer, D., et al. Robust derivation of epicardium and its differentiated smooth muscle cell progeny from human pluripotent stem cells. Development. 142, 1528-1541 (2015).
- Witty, A. D., et al. Generation of the epicardial lineage from human pluripotent stem cells. Nat Biotechnol. 32, 1026-1035 (2014).



