ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
يوضح هذا البروتوكول الموجات فوق الصوتية الروبوتية (الولايات المتحدة) كبديل عملي وفعال من حيث التكلفة وسريع لطرق الصور التقليدية غير الغازية.
Abstract
تشمل الطرائق الشائعة للتصوير في الجسم الحي للقوارض التصوير المقطعي بالإصدار البوزيتروني (PET) ، والتصوير المقطعي المحوسب (CT) ، والتصوير بالرنين المغناطيسي (MRI) ، والموجات فوق الصوتية (الولايات المتحدة). كل طريقة لها قيود ومزايا ، بما في ذلك التوافر وسهولة الاستخدام والتكلفة والحجم واستخدام الإشعاع المؤين أو المجالات المغناطيسية. يصف هذا البروتوكول استخدام الولايات المتحدة الروبوتية 3D للتصوير في الجسم الحي للكلى والقلب القوارض ، وتحليل البيانات اللاحقة ، والتطبيقات البحثية المحتملة. التطبيقات العملية للولايات المتحدة الروبوتية هي تحديد حجم الكلى الكلي (TKV) ، وكذلك قياس الخراجات والأورام والأوعية الدموية. على الرغم من أن الدقة ليست عالية مثل الطرائق الأخرى ، إلا أن الولايات المتحدة الروبوتية تسمح بجمع بيانات أكثر عملية عالية الإنتاجية. علاوة على ذلك ، باستخدام التصوير الأمريكي M-mode ، يمكن تحديد وظيفة القلب كميا. نظرا لأن الكلى تتلقى 20٪ -25٪ من الناتج القلبي ، فإن تقييم وظائف القلب أمر بالغ الأهمية لفهم فسيولوجيا الكلى والفيزيولوجيا المرضية.
Introduction
تشمل الطرائق الأكثر شيوعا لتصوير القوارض في الجسم الحي التصوير المقطعي بالإصدار البوزيتروني (PET) ، والتصوير البصري (OI) ، والتصوير المقطعي المحوسب (CT) ، والتصوير بالرنين المغناطيسي (MRI) ، والموجات فوق الصوتية (الولايات المتحدة). توفر هذه التقنيات صورا عالية الدقة في الجسم الحي ، مما يسمح للمحققين بالتقييم الكمي واتباع نماذج الأمراض طوليا بشكل غير جراحي1. في حين أن كل طريقة تصوير لها قيود ، إلا أنها توفر أيضا أدوات لا تقدر بثمن للبحث قبل السريري.
هنا ، تفصل الدراسة نظاما أمريكيا وتقدم بروتوكول التصوير الآلي والقوارض 3D. يتم إنتاج الموجات الأمريكية بواسطة مسبار يسمى محول الطاقة ، والذي عادة ما يكون محمولا باليد. تنعكس الموجات الصوتية مرة أخرى أثناء تفاعلها مع الأنسجة، ويتم إعادة بناء الأصداء في صور2. سيركز البروتوكول الموصوف هنا على تصوير الكلى والقلب باستخدام محول طاقة يتم التحكم فيه آليا واستخدام برنامج يسمح بإعادة بناء 3D السريع للتقييم الكمي.
الولايات المتحدة الروبوتية هي طريقة تصوير سريعة وموثوقة وغير غازية تسمح للمحققين بإجراء دراسات طولية عالية الإنتاجية. بالمقارنة مع الطرق الأمريكية المحمولة باليد ، فإن الطريقة الأمريكية الروبوتية فعالة من حيث الوقت ، حيث يمكن مسح ما يصل إلى ثلاثة في غضون دقائق. تشير الإنتاجية العالية لقياسات الكلى إلى أنه يمكن تصوير ما يصل إلى 20 فأرا في الساعة. تقع محولات الطاقة الروبوتية تحت الأغشية الصوتية وتتحرك بشكل مستقل عن الحيوان بدرجتين من الحرية (الشكل 1A). يسمح هذا للمستخدمين المبتدئين بالحصول على صور عالية الجودة ، في حين أن الطرق الأمريكية المحمولة باليد أكثر عرضة لخطأ المستخدم. يسمح البرنامج المقترن بإعادة بناء الكلى 3D بكفاءة وفي الوقت الفعلي. في السابق ، كان التصوير بالرنين المغناطيسي (MRI) طريقة سائدة للتصوير غير الغازي بسبب التباين الممتاز للأنسجة الرخوة ، ونقص النشاط الإشعاعي ، وعمق الاختراق. ومع ذلك ، غالبا ما يتطلب التصوير بالرنين المغناطيسي أوقات اكتساب طويلة ومكلفا لتنفيذه. تم تقييم الولايات المتحدة كبديل موثوق به وأكثر سرعة للتصوير بالرنين المغناطيسي في تقييم إجمالي حجم الكلى (TKV)3.
Protocol
تتوافق جميع الخطوات الواردة في هذا البروتوكول مع إرشادات استخدام الحيوانات في Mayo Clinic (روتشستر، مينيسوتا) وقد تمت الموافقة عليها من قبل لجنة Mayo Clinic المؤسسية لرعاية الحيوانات واستخدامها.
1. نموذج حيواني
- الحصول على الفئران من مصادر تجارية.
ملاحظة: تم استخدام C57BL/6J (العمر = 18 شهرا؛ n = 22 (7 ذكور، 15 أنثى)) (جدول المواد) و Pkd1 (RC/RC ) (العمر = 18 شهرا؛ n = 9 (3 ذكور، 6 إناث))4 للدراسة.
2. إزالة الشعر
- تخدير الحيوان باستخدام الأيزوفلوران المتبخر (2٪ -3٪) في غرفة التخدير. تأكد من تخدير الحيوان بما فيه الكفاية عن طريق إجراء قرصة إصبع القدم. تأكد من أن الماوس يتنفس بمعدل 60-90 نفسا تقريبا / دقيقة دون ابتلاع هواء واضح.
ملاحظة: تم اختيار الأيزوفلوران المتبخر بسبب القدرة على التحكم في مستوى تخدير الحيوان وضبطه. تم استخدام Isoflurane مختلطة مع الأكسجين 100 ٪. - استخدم ماكينة حلاقة كهربائية لحلق منطقة الجلد المطلوبة للقياسات الأمريكية.
ملاحظة: في هذه الدراسة ، ينصب التركيز على قياسات الكلى والقلب ، لذلك تم حلق صدر الحيوان وظهره. - ضع كريم إزالة الشعر على جلد الحيوان الحليق باستخدام قضيب ذو رؤوس قطنية. امسح الكريم بعد 30-60 ثانية باستخدام منشفة ورقية جافة. ثم ، استمر في مسح بقايا كريم إزالة الشعر باستخدام وسادات الشاش الرطبة. تأكد من اكتمال إزالة الشعر قبل البدء في الفحص.
ملاحظة: أي شعر متبقي سوف يتداخل مع جودة الصورة. إزالة الشعر بالكامل أمر بالغ الأهمية. ومع ذلك ، فمن الضروري مسح كريم إزالة الشعر في غضون دقيقة لمنع إصابة جلد الحيوان. كريم إزالة الشعر المتبقي على الحيوان يمكن أن يلطخ غشاء التصوير للآلة الأمريكية. تأكد من التنظيف السليم للحيوان باستخدام منصات الشاش الرطب.
3. تحديد المواقع الحيوانية
- قم بتشغيل الجهاز الأمريكي ومفتاح عنصر التسخين الداخلي للخلجان الأمريكية. قم بتشغيل صمامات التخدير المناسبة للخلجان الأمريكية المقابلة التي سيتم استخدامها.
ملاحظة: يجب تشغيل الجهاز الأمريكي قبل بدء تشغيل برنامج التصوير في الولايات المتحدة. - املأ الخلجان بما يكفي من الماء لتغطية الغشاء. ضع الحيوان المخدر في مخروط الأنف.
- بالنسبة للقياسات القلبية ، ضع الحيوان في وضع عرضة وزاويته حوالي 30 درجة إلى اليمين.
- لقياسات الكلى ، ضع الحيوان في وضع مستقيم وضعيف. قم بتسطيح جسم الحيوان بلطف لتقليل جيوب الهواء بين الحيوان والغشاء (الشكل 1B).
ملاحظة: يمكن أن يؤدي تشغيل إصبع بجانب جسم الحيوان إلى إزالة أي فقاعات هواء تلتصق بالجلد ، مما يتداخل مع التصوير. استخدام الماء أو جل المالحة الأمريكية كوسط أمريكي ؛ لكن الماء يسهل التصوير السريع الذي تمت مناقشته هنا.
4. قياسات الموجات فوق الصوتية
- في برنامج التصوير الأمريكي، حدد الاستحواذ الأمريكي واسمح للأداة بالتهيئة.
- تصوير الكلى باستخدام الوضع B.
- أدخل اسما للدراسة في مربع الحوار المناسب.
- أدخل معرف الحيوان في مربع الحوار المناسب.
ملاحظة: يمكن تصوير ما يصل إلى ثلاثة بالتتابع. - انقر فوق علامة التبويب المسماة 3D لتهيئة المسح الضوئي ثلاثي الأبعاد.
- باستخدام تغذية الكاميرا المباشرة، حرك مربع المنطقة ذات الأهمية (ROI) لاحتواء الكلى.
ملاحظة: قد يتم ضبط حجم عائد الاستثمار اعتمادا على حجم هدف الصورة. زيادة حجم عائد الاستثمار سيزيد قليلا من وقت المسح الضوئي (الشكل 1C). اعتمادا على حجم عائد الاستثمار، سيقوم الماسح الضوئي تلقائيا بضبط عدد التمريرات المطلوبة لمحول الطاقة لمسح عائد الاستثمار بالكامل. - بناء على نوع الصورة المطلوبة، حدد صفيف خطي أو متذبذب، لاختيار محول الطاقة. اختر من بين المسح الضوئي السريع أو المحسن لأي من الترجام.
ملاحظة: الصفيف الخطي أسرع وعادة ما يوفر التصوير الكافي. يمكن استخدام محول الطاقة المتذبذب إذا لم يتمكن من الحصول على جودة الصورة المطلوبة باستخدام الصفيف الخطي. يستخدم محول الطاقة المتذبذب طولا موجيا أعلى ترددا وبالتالي يوفر المزيد من الوضوح في الصور. يكتسب خيار المسح الضوئي السريع صورا متوسطة الجودة بدون تصحيح للتنفس بسرعة أعلى. على الرغم من أن الخيار الأمثل يتطلب وقتا أطول قليلا ، إلا أنه يوفر جودة صورة أفضل ويسمح بتصحيح التنفس. ستركز هذه المخطوطة على استخدام الإعداد المسبق للصفيف الخطي الأمثل. - انقر على العرض المباشر لرؤية صورة حية لمنطقة العرض المطلوبة.
- لتحريك محول الطاقة ، انقر فوق الزر " انتقال إلى" الدائري ، ثم انقر فوق منطقة الماوس المراد تصويره. استخدم الأسهم الاتجاهية ذات أحجام الخطوات المحددة مسبقا لضبط موضع محول الطاقة بدقة.
- انقر فوق السهم الموجود على جانب نافذة لوحة التحكم لفتح درج الإعدادات. انقر فوق بروتوكول المسح الضوئي لفتح إعدادات المسح.
- حدد العمق البؤري المثالي واضبط أشرطة التمرير ل TGC (تعويض كسب الوقت) لتغيير تباين الصورة لعرض الكلى بشكل أفضل. بعد تحقيق الإعدادات المطلوبة ، انقر فوق السهم مرة أخرى لإغلاق علبة الإعدادات.
- اضغط على الزر الحصول على ثابت لبدء المسح الضوئي 3D.
ملاحظة: تتم الإشارة إلى تقدم الفحص عبر شريط تقدم في أسفل يسار البرنامج. - بمجرد اكتمال المسح الضوئي ، تحقق من جودة الصورة بالنقر فوق سهم التنزيل الأزرق لفتح المسح الضوئي في وضع المعاينة. انتقل عبر إطارات 3D للمسح الضوئي عن طريق سحب السهم الأحمر في الجزء العلوي من النافذة. للتكبير أو التصغير، اضغط باستمرار على المفتاح Ctrl واستخدم زر التمرير على الماوس.
- لفحص إضافية، قم بتحديث مربعات الحوار معرف الحيوان، وأدخل المعرفات الجديدة، ثم كرر الخطوات المذكورة أعلاه.
ملاحظة: عند اكتمال عمليات المسح ، قم بتجفيف الحيوانات وإعادتها إلى أقفاصها المنزلية.
- تصوير القلب باستخدام وضع M.
ملاحظة: وضع M هو عرض موجة الموجات فوق الصوتية على طول خط الموجات فوق الصوتية المحدد والمختار.- انقر فوق علامة التبويب M Mode لتنشيط تصوير القلب.
ملاحظة: يمكن تصوير واحد فقط في المرة الواحدة. - تأكد من أن الحيوان في الموضع المناسب لمسح القلب (الخطوة 2.2). انقل عائد الاستثمار إلى الموقع التقريبي للقلب.
- اضغط على زر " الباحث عن القلب" لتحديد موقع القلب. استخدم الخريطة الحرارية لتحسين موقع الترجام. استخدم الزر "الانتقال إلى" الدائري لتحريك الترجام إلى البطين الأيسر (الشكل 2A).
- انتقل إلى العرض المباشر واستخدم أزرار الأسهم لوضع محول الطاقة بين العضلات الحليمية (الشكل 2B). للتحقق من الموضع المناسب لمحول الطاقة، قم بعرض تتبع M Mode المباشر (الشكل 2D).
- بمجرد أن يكون محول الطاقة في الموضع المناسب ، انقر فوق اكتساب التسلسل. انقر على سهم التنزيل الأزرق لعرض الفحص المكتمل.
- انقر فوق علامة التبويب M Mode لتنشيط تصوير القلب.
5. تحليل الكلى (ميكانيكا التحليل)
- افتح علامة التبويب تحليل الصور وحدد الزر تحميل وحدة (مجلدات) لإدخال ملفات/مجلدات الصور.
- تجزئه
- حرك الخطوط الملونة التي تمثل المستويات المختلفة للعثور على الكلى في جميع الطائرات.
- انقر على إضافة لإضافة تجزئة جديدة. قم بتوفير اسم ترميز للملف.
- استخدم الزر Surface Cut لإضافة نقاط حول الحافة الخارجية للكلية في مستويات متعددة. انقر فوق تطبيق لتوليد تجزئة من خلال الكلى بأكملها (الشكل 3A).
- قم بالتمرير عبر الإطارات المختلفة في كل مستوى وقم بتحرير أي مناطق غير دقيقة بالنقر فوق تحرير وسحب النقاط إلى الموقع الصحيح.
- بدلا من ذلك ، إذا كانت الكلى غير منتظمة الشكل ، فاستخدم وظيفة Draw لإنشاء أثر غير منتظم الشكل حول الكلى. إما أن تنقر فوق النقاط حول الحافة أو اضغط باستمرار على النقرة اليسرى لرسم التتبع بحرية.
- لإكمال التتبع باستخدام الزر رسم ، انقر بزر الماوس الأيمن. قم بالتمرير للأمام إطارات متعددة وكرر عملية التتبع.
- كرر ذلك حتى يتم تتبع الإطارات في جميع أنحاء المنطقة بأكملها محل الاهتمام.
- إذا تم استخدام وظيفة الرسم ، فحدد تعبئة بين الشرائح للتحقق من التتبع وضبطه. انقر فوق تهيئة لرؤية معاينة. إذا كانت المعاينة مقبولة ، فانقر فوق تطبيق. إذا لم يكن الأمر كذلك ، فانقر فوق إلغاء الأمر وقم بتعديل عمليات التتبع.
ملاحظة: سيسمح الزر مسح بحذف منطقة داخل تتبع. يعمل الزر " تنعيم" على تنعيم الحواف الخشنة للتتبع. - عندما يكون تحليل الصورة مرضيا، حدد حفظ لحفظ التحليل في ملف الصورة الأصلي.
- قياس
- استخدم وظيفة الفرجار لقياس المعالم داخل الصورة. انقر على زر الفرجار وانقر بزر الماوس الأيسر فوق نقطتي المسافة المراد قياسها (الشكل 3B).
- احفظ القياس بالنقر فوق زر القرص أعلى الشاشة.
- تجزئه
6. تحليل القلب
- حدد تحميل وحدات التخزين لإدخال الملف (الملفات) لتحليله.
- حدد الخيار إضافة .
- استخدم أداة وضع النقطة لتتبع الانقباض والانبساط لكل طبقة من أنسجة القلب. استمر مع الطبقات الأخرى من أنسجة القلب. استخدم الدالة تحرير لتعديل الآثار (الشكل 2C,D).
ملاحظة: إذا كان تتبع الوضع M واضحا جدا، فاستخدم الزر إضافة (تلقائي) لإنشاء عمليات تتبع لكل طبقة تلقائيا. - حدد تطبيق لحساب معلمات القلب. اعرض علامة التبويب تحديد كمي وحدد تصدير الإحصاءات لتصدير جميع البيانات كملف *.csv (الشكل 2E).
Representative Results
نتائج تحليل الكلى
يتم الحصول على بيانات المساحة السطحية والحجم من تجزئة الكلى. يمكن استخدام هذه المعلومات لمقارنة النماذج التجريبية ونماذج التحكم أو تتبع التغييرات بمرور الوقت. أداة الفرجار مفيدة لقياس التشوهات بسرعة (أي الخراجات والأورام) وكيف تتغير في الطول بمرور الوقت. يشير الشكل 3 إلى أنه يمكن استخدام كل من طريقتي التجزئة والفرجار لقياس أحجام الكيس بدقة. يوضح الشكل 4 اختلافا واضحا في إجمالي حجم الكلى (TKV) بين الفئران الضابطة المتطابقة مع العمر والفئران التجريبية (Pkd1RC / RC). يمكن إجراء تصور ثلاثي الأبعاد لعروض الحجم هذه داخل النظام ، بما في ذلك الدوران داخل مساحة ثلاثية الأبعاد (الشكل 5). ثم يتم استخدام عمليات إعادة الإعمار ثلاثية الأبعاد هذه لحساب TKV (mm3; الشكل 4) وكذلك حجم الكيس الكبير الفردي.
نتائج تحليل القلب
يتم الحصول على العديد من المعلمات المفيدة من تحليل صور M Mode. توفر هذه البيانات لقطة جيدة لوظيفة قلب البطين الأيسر (LV) في تلك المرحلة الزمنية. يتضمن إخراج البيانات القطر الداخلي LV ، والجدار الخلفي LV ، وقطر الجدار الأمامي LV ، والكسر القذفي ، والتقصير الكسري ، وحجم السكتة الدماغية ، ومعدل ضربات القلب ، والناتج القلبي ، وحجم LV ، وكتلة LV. يعتمد نجاح تحليل القلب على التقسيم الدقيق للطبقات على صورة M Mode. يتم حساب معظم نتائج القلب والأوعية الدموية من خلال ذروة المراحل الانقباضية والانبساطية لطبقات الشغاف الخلفية والأمامية. تظهر طبقة الشغاف الخلفية بيضاء زاهية وتتبع نمطا مشابها لطبقة الشغاف الخلفية. يجب وضع تتبع طبقة الشغاف الخلفية على أدنى كفاف. يجب تتبع طبقة الشغاف الأمامية على طول أعلى كفاف لتلك الطبقة. تظهر طبقة فوق القلب الأمامية خطية في أسفل الصورة بسبب وضع الحيوان الضعيف (الشكل 2D). يوضح الشكل 6 مثالا على دراسة واحدة مع عدم وجود فرق كبير في الناتج القلبي بين الفئران التجريبية والضابطة. كما هو الحال مع التصوير الكلوي ، فإن تصور القلب 3D ممكن. ومع ذلك ، فإن التصور 4D للدورة القلبية (الشكل التكميلي 1) يسمح للباحث بتصور وتحديد كل من التشوهات المورفولوجية والديناميكية للدورة في الحيوان الذي تم تقييمه.
تقييم المورفولوجيا
للحصول على تقييم سريع وغير مكلف ، يمكن للولايات المتحدة مراقبة المعلمات الفسيولوجية بشكل فعال طوليا. ومع ذلك ، ترغب العديد من الدراسات في تحديد الخصائص المورفولوجية الدقيقة ، على سبيل المثال ، عدد وأحجام الخراجات ، أو التكلسات (حصوات الكلى) ، أو الأوعية الدموية ، أو درجة التليف. يقارن الشكل 7 كلية الفأر الطبيعية بكلية الفأر الكيسي بكلية الفأر المتكلسة بشكل معتدل. من خلال زيادة تردد مركز الولايات المتحدة (10 ميجاهرتز مع الصفيف الخطي) إلى 35 ميجاهرتز (مكبر صوت متذبذب) ، يمكن الحصول على صور لمزيد من التفاصيل.

الشكل 1: نظام الموجات فوق الصوتية ووضع الماوس. (أ) رسم تخطيطي لنظام الموجات فوق الصوتية وموقع محولات الطاقة. (ب) عرض الفئران في وضع ضعيف على منصة الموجات فوق الصوتية. (ج) مثال على منطقة الاهتمام (ROI) المعمول بها لمنطقة الاهتمام (الكلى) مع بطاقات هوية الحيوانات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: التصوير بالموجات فوق الصوتية للقلب للحصول على معلمات فسيولوجية . (أ) استخدام صورة الخريطة الحرارية ل Heart Finder لوضع محول الطاقة في البطين الأيسر للتصوير M-Mode. يشار إلى موقع محول الطاقة في البطين الأيسر بالنقطة الخضراء الكبيرة. (ب) عرض محول الطاقة عند وضعه بشكل صحيح فوق العضلات الحليمية (مربع منقط). (ج) عرض مثال للطبقات اللازمة لقياس معلمات القلب. (D) عرض صورة M-Mode الحية مع طبقات معينة كما في اللوحة C. (الطبقات من الأعلى إلى الأسفل: فوق القلب الخلفي ، الشغاف الخلفي ، الشغاف الأمامي ، و epicardial الأمامي.) (ه) مثال على نتائج الإحصاءات المستمدة من قياسات القلب. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: استخدام أدوات التجزئة والفرجار لقياس الكلى والكيس. (أ) مثال على التقسيمات (العرض المحوري) لكل من الكلى (التظليل الأزرق والبرتقالي) والكيس الكبير (الأصفر) مع الأحجام المدرجة أدناه. يتم عرض طرق العرض غير المجزأة أدناه بحيث يمكن عرض الولايات المتحدة غير الغامضة. (ب) مثال على استخدام الفرجار لقياس نفس الكيس (المنظر السهمي) من الشكل 3A مع القياسات أدناه. تم حساب الحجم باستخدام صيغة القطع الناقص (الحجم = (4/3)π x a x b x c ، حيث a و b و c هي نسبة x و y و z على التوالي). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: توزيعات TKV ل WT والكلى الفأرة الكيسية. تمثيل TKVs للفئران من النوع البري (WT) (C57BL/6J) والفئران المريضة (Pkd1RC/RC). n = 22 (WT) n = 9 (Pkd1RC/RC)؛ نتائج اختبار t ثنائي الذيل: p < 0.0001. يعرض المربع القيم المئوية 25-75 وتظهر الشعيرات 1.5 مرة النطاق الربيعي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: إعادة بناء 3D المتحركة للكلى المجزأة والكيس. باستخدام البرنامج ، قد يتم تدوير الإسقاطات ثلاثية الأبعاد للكلى والكيس أو هزها في الفضاء ثلاثي الأبعاد (الأزرق = الكلى اليسرى ؛ الأصفر = الكيس الكبير ؛ البرتقالي = الكلى اليمنى). يرجى النقر هنا لتنزيل هذا الرقم.

الشكل 6: المعلمات الفسيولوجية القلبية من القياسات الأمريكية. تمثيل الناتج القلبي (مل / دقيقة) للفئران WT والمريضة (Pkd1RC / RC). n = 22 (WT) n = 9 (Pkd1RC/RC). تظهر البيانات المجدولة السفلية أنه لا يوجد فرق كبير لهاتين المجموعتين في الكسر القذفي أو حجم السكتة الدماغية أو معدل ضربات القلب (HR) أو الناتج القلبي (CO). نتائج اختبار t ثنائي الذيل: p > 0.05. يعرض المربع القيم المئوية 25-75. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 7: مقارنة بين الأقسام السهمية الأمريكية من الأمراض الطبيعية والمرضين . (أ) الكلى من النوع البري (سلالة C57BL / 6J) (TKV = 143.202 مم 3). (ب) الكلى الكيسية مع زيادة TKV (Pkd1RC / RC الماوس) (TKV = 333.158 mm3). يشار إلى الخراجات بواسطة الأسهم الصفراء. (ج) الكلى مع تكلسات الأوعية الدموية (نموذج = نقص مستقبلات البروتين الدهني منخفض الكثافة، والفأر Apolipoprotein B100 فقط تغذية نظام غذائي غربي لمدة 12 شهرا5) (TKV = 127.376 mm3). يشار إلى حصوات الكلى بالأسهم الخضراء. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي 1: فيلم دورة القلب 4D من القياسات الأمريكية. باستخدام البرنامج ، يتم التقاط تمثيل للقلب النابض في 3D US وإسقاطه من خلال دورة القلب. يشير السهم الأخضر إلى الصمام الأبهري. (نموذج = نقص مستقبلات البروتين الدهني منخفض الكثافة، فأر البروتين الشحمي B100 فقط، تغذية نظام غذائي غربي لمدة 12 شهرا5). يولد هذا النموذج تكلسات الأوعية الدموية مما يتيح تصورا أسهل للقلب والصمامات بسبب الانعكاسية الصوتية الأكبر للتكلسات في الولايات المتحدة. إعادة بناء 4D مماثلة ممكنة مع الفئران WT. ومع ذلك ، فإن التباين الصوتي الذي تم التقاطه لن يكون مرتفعا. يرجى النقر هنا لتنزيل هذا الملف.
Discussion
تستخدم الموجات فوق الصوتية الموجات الصوتية ، وأي حواجز أمام انتشار الموجات الصوتية سوف تتداخل مع جودة الصورة. وبالتالي ، فإن إزالة الشعر بالكامل من المنطقة المراد تصويرها أمر بالغ الأهمية. من المهم أيضا ضمان الإزالة الكاملة لكريم إزالة الشعر لأنه يمكن أن يسبب حروقا / تهيج جلد الحيوان وتغيير لون الغشاء الشفاف للماسح الضوئي. مستويات المياه الكافية في الخلجان ضرورية لنشر الموجات الصوتية المثلى ، وبالتالي فهي مطلوبة للحصول على أعلى دقة للصورة. ومع ذلك ، عندما يكون الحيوان في وضع عرضة ، تأكد من أن خطم الحيوان أعلى من مستوى الماء أو أن الحيوان معرض لخطر استنشاق الماء. يعد تحسين معلمات التصوير ، وخاصة العمق البؤري ، أمرا بالغ الأهمية للحصول على صور عالية الجودة. قد تكون التعديلات على المعلمات ضرورية للحيوانات الفردية.
توفر الولايات المتحدة الروبوتية العديد من المزايا مقارنة بالطرائق الأمريكية التقليدية المحمولة باليد. أولا ، يستخدم النظام واجهة بسيطة تعتمد على الكاميرا بالإشارة والنقر. تعالج هذه الميزة تعقيد الولايات المتحدة التقليدية وتنتج بيانات متسقة حتى عند تشغيلها بواسطة مستخدم مبتدئ6. ثانيا ، يسمح النظام باستخدام الماء بدلا من الهلام الأمريكي التقليدي كوسيط صوتي. في السابق ، سمح استخدام الجل الأمريكي بتكوين فقاعات تتداخل مع اكتساب صور عالية الجودة. أيضا ، الجل الأمريكي فوضوي ويوفر تحديات للتنظيف. علاوة على ذلك ، يتم تسخين الماء بواسطة مصباح الحرارة ويساعد في الحفاظ على درجة حرارة جسم الحيوان. ثالثا ، الولايات المتحدة الروبوتية أسرع ، لذا فإن القطع الأثرية من حركة الجهاز التنفسي ليست مشكلة. تسمح سرعة التصوير المتزايدة بالإكمال العملي لجمع البيانات عالية الإنتاجية. رابعا ، تحصل الولايات المتحدة الروبوتية على صور ثلاثية الأبعاد ، وبالتالي تجعل إعادة بناء الأشياء ثلاثية الأبعاد بسيطة (الشكل 4). التصوير بالرنين المغناطيسي والطرائق الأخرى باهظة الثمن وتستغرق وقتا طويلا وغير متوفرة دائما. الأهم من ذلك ، أن النظام الأمريكي الآلي يناسب طاولة أو مقعد وهو أكثر فعالية من حيث التكلفة. وأخيرا، أظهرت الأعمال السابقة أن الولايات المتحدة الروبوتية يمكن أن توفر بيانات قياس قابلة للمقارنة لطرائق أكثر تكلفة، مثل التصوير بالرنين المغناطيسي 3.
في حين أن جودة الصورة ودقة النظام الأمريكي الآلي الموصوف في هذا العمل كانت كافية للتطبيق المقترح (الشكل 7) ، إلا أن هناك عدة طرق يمكن من خلالها تحسين جودة الصورة في المستقبل. على سبيل المثال، سيؤدي استخدام محولات التردد العالي (على سبيل المثال، MHz 70-50) إلى صور عالية الدقة مع تعريف أفضل للميزات. في حين أن استخدام ترددات أعلى من شأنه أن يؤدي إلى عمق اختراق أضعف ، يجب أن تكون الصور كافية للتصوير في الجسم الحي للأعضاء السطحية ، مثل كلية الفأر. كما هو الحال مع طرق التصوير الأخرى ، يمكن استخدام عوامل التباين لتحسين ميزات محددة. بالنسبة للولايات المتحدة ، هذا يعني عادة استخدام شيء يعكس بشكل كبير الموجات الصوتية. الفقاعات الدقيقة داخل الأوعية الدموية التي تحيط فيها الدهون بفقاعات الغاز الصغيرة جدا هي واحدة من هذه العوامل. فقاعات الغاز بحجم ميكرون عاكسة للغاية وبالتالي توفر إشارة مميزة ثانية تترجم إلى دقة عالية للأوعية الدموية7. في حين أن تقنية التباين الصوتي هذه قد تكون مفيدة للغاية ، إلا أنها يمكن أن يكون لها العديد من الجوانب السلبية. أولا ، يجب أن تكون الفقاعات الدقيقة طازجة وتستمر فقط في الجسم الحي لمدة 5-10 دقائق. ثانيا ، يتطلب الحقن داخل الأوعية الدموية في الجسم الحي عادة قسطرة حجاب الذيل للحقن ، وهذا يمكن أن يكون تحديا تقنيا. في ظل ظروف معينة وأنظمة نابضة، يمكن أن يؤدي تصوير الفقاعات الدقيقة في حد ذاته إلى تلف الأوعية الدموية الكلوية8.
هناك أيضا بعض القيود الأكثر عمومية للنظام الأمريكي المعين المستخدم. أولا ، يتم تضمين صفيف خطي واحد فقط (يتمركز عند 18 ميجاهرتز) في الهيكل الروبوتي ، لذلك لا يمكن حاليا التبديل إلى مجسات ذات تردد أعلى أو أقل. قد يؤثر ذلك على اتساع النماذج (سواء كانت أكبر أو أصغر) التي يمكن تقييمها باستخدام النظام. يجب أن تتضمن التكرارات المستقبلية للأداة صفائف خطية متعددة لتغطية مجموعة كاملة من النماذج الحيوانية قبل السريرية. ثانيا ، لا يمكن التحكم في زاوية محول الطاقة بالنسبة للموضوع الحيواني. لذلك ، فإن إجراء تقنيات التصوير المعتمدة على الزاوية ، مثل دوبلر ، أو تحقيق مناظر بديلة داخل الطائرة لأعضاء معينة (على سبيل المثال ، رؤية المحور الطويل للكلية) يتطلب إعادة وضع الحيوان ويمكن أن يكون من الصعب تحقيقه. ويمكن إضافة درجات إضافية من الحرية إلى الحركة الروبوتية لتخفيف هذا التحدي. ثالثا ، في بعض الأحيان ، لاحظنا تحف صدى ناشئة عن الغشاء الصوتي الذي يفصل الحيوان عن محول الطاقة الذي يمكن أن يحجب تصور السمات والحدود السطحية. في هذه الحالات ، يمكن أن يؤدي استخدام مواجهة هلامية لرفع الحيوان بعيدا عن الغشاء إلى علاج الموقف. أخيرا ، التحكم في درجة الحرارة عبر مصباح الحرارة غير دقيق ، وبالتالي يجب إيلاء اهتمام وثيق لدرجة حرارة جسم الحيوان الأساسية أثناء التصوير. من المرجح أن تؤدي آليات التدفئة الأكثر تحكما ، مثل وسادة التدفئة المتكاملة ، إلى تحسين إدارة التوازن وإنتاجية التصوير.
قد يكون استخدام الولايات المتحدة الروبوتية قابلا للتطبيق على مختلف مجالات البحث. تمكن هذه التقنية من تصور هياكل الأنسجة الإجمالية ، وبالتالي يمكن استخدامها لتتبع تطور الورم والعلاجات المحتملة 6,9 وكذلك مورفولوجيا الكلى كما هو موضح هنا. القدرة على تقسيم الميزات المحددة للصور يجعلها أداة جذابة لدراسة نماذج مرض الكلى المتعدد الكيسات (PKD)3. تسمح صور الوضع M بتحديد كمي بسيط للعديد من معلمات القلب المهمة التي تمكن من تقييم فسيولوجيا القلب في الجسم الحي. نظرا لأن الكلى تتلقى 20٪ -25٪ من الناتج القلبي10 ، فإن فهم وظيفة القلب أثناء التقييم الطولي لأمراض الكلى أمر مهم. من خلال هذه البروتوكولات الأمريكية ، حاولنا توضيح أن التصوير الأمريكي ليس عمليا فقط في دراسات الكلى الحية والطولية ولكن أيضا أن الأدوات الأمريكية المتزايدة تمكن من التقييم المورفولوجي والفسيولوجي للفئران في الدراسات قبل السريرية.
Disclosures
يتم توظيف العديد من المؤلفين أو لديهم مصلحة مالية كبيرة في براءات الاختراع المرخصة من قبل SonoVol، Inc. (CJM، RCG، TJC).
Acknowledgments
تم دعم هذا العمل من قبل المعاهد الوطنية للصحة (R43-DK126607 ، TJC ، TLK ، MFR) ومؤسسة مايو.
Materials
| Name | Company | Catalog Number | Comments |
| Electric Razor | Braintree Scientific, Inc | CLP-9868 14 | |
| C57bk6j | The Jackson laboratory | https://www.jax.org/ | |
| Cotton gauze pads | Fisher Scientific | ||
| Cotton tipped applicators | Fisher Scientific | ||
| Depilatory cream | N/a | N/a | This study used Nair |
| Heat lamp | Included with SonoVol Vega system | ||
| Robotic Ultrasound System | SonoVol Inc | SonoVol Vega system includes anesthesia system | |
| SonoEQ Software | SonoVol | Included with SonoVol Vega system | |
| TERRELL Isoflurane | Piramal Critical Care, Inc | NDC 66794-019-10 |
References
- Cunha, L., et al. Preclinical imaging: an essential ally in modern biosciences. Molecular Diagnostics & Therapy. 18 (2), 153-173 (2014).
- Ultrasound. NIBIB. , Available from: https://www.nibib.nih.gov/science-education/science-topics/ultrasound#pid-936 (2016).
- Beaumont, N. J., et al. Assessing polycystic kidney disease in rodents: Comparison of robotic 3d ultrasound and magnetic resonance imaging. Kidney360. 1 (10), 1128-1136 (2020).
- Hopp, K., et al. Functional polycystin-1 dosage governs autosomal dominant polycystic kidney disease severity. The Journal of Clinical Investigation. 122 (11), 4257-4273 (2012).
- Weiss, R. M., Ohashi, M., Miller, J. D., Young, S. G., Heistad, D. D. Calcific aortic valve stenosis in old hypercholesterolemic mice. Circulation. 114 (19), 2065-2069 (2006).
- Czernuszewicz, T. J., et al. A new preclinical ultrasound platform for widefield 3D imaging of rodents. Review of Scientific Instruments. 89 (7), 075107 (2018).
- Chong, W. K., Papadopoulou, V., Dayton, P. A. Imaging with ultrasound contrast agents: current status and future. Abdominal Radiology (NY). 43 (4), 762-772 (2018).
- Nyankima, A. G., Kasoji, S., Cianciolo, R., Dayton, P. A., Chang, E. H. Histological and blood chemistry examination of the rodent kidney after exposure to flash-replenishment ultrasound contrast imaging. Ultrasonics. 98, 1-6 (2019).
- Rojas, J. D., et al. Ultrasound measurement of vascular density to evaluate response to anti-angiogenic therapy in renal cell carcinoma. IEEE Transactions on Biomedical Engineering. 66 (3), 873-880 (2019).
- Boron, W. F., Boulpaep, E. L. Medical Physiology. 3rd edn. , Elsevier. (2017).
Tags
الطب، العدد 174،Erratum
Formal Correction: Erratum: Use of 3D Robotic Ultrasound for In Vivo Analysis of Mouse Kidneys
Posted by JoVE Editors on 10/06/2021.
Citeable Link.
An erratum was issued for: Use of 3D Robotic Ultrasound for In Vivo Analysis of Mouse Kidneys. An author name was updated, along with the Protocol and Representative Results sections.
The name of an author was updated from:
Ryan C. Gesser
to:
Ryan C. Gessner
Step 3.1 of the Protocol was updated from:
Turn on the US machine and the heat lamp above the US platforms. Turn on the appropriate anesthesia valves for the corresponding US bays that will be used.
to:
Turn on the US machine and the switch for the internal heating element for the US bays. Turn on the appropriate anesthesia valves for the corresponding US bays that will be used.
Figue 1 in the Representative Results was updated from:
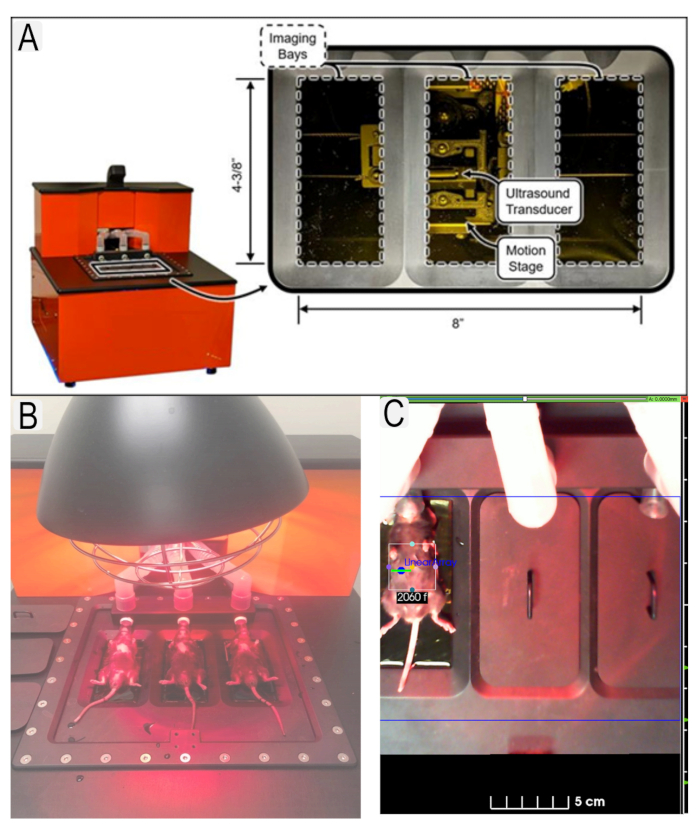
Figure 1: Ultrasound system and mouse placement. (A) Diagram of ultrasound system and location of transducers. (B) View of mice in supine position on ultrasound platform with heat lamp. (C) Example of region of interest (ROI)s in place for area of interest (kidneys) with animal IDs. Please click here to view a larger version of this figure.
to:

Figure 1: Ultrasound system and mouse placement. (A) Diagram of ultrasound system and location of transducers. (B) View of mice in supine position on ultrasound platform. (C) Example of region of interest (ROI)s in place for area of interest (kidneys) with animal IDs. Please click here to view a larger version of this figure.



