20.9:
Teoria del campo cristallino - Complessi planari tetraedrici e quadrati
20.9:
Teoria del campo cristallino - Complessi planari tetraedrici e quadrati
Complessi tetraedri
La teoria dei campi cristallini (CFT) è applicabile alle molecole in geometrie diverse dall’ottaedro. Nei complessi ottaedri, i lobi degli orbitali dx2−y2 e d z2 puntanodirettamente ai ligandi. Per i complessi tetraedri, gli orbitali d rimangono in posizione, ma con solo quattro ligandi situati tra gli assi. Nessuno degli orbitali punta direttamente ai ligandi tetraedri. Tuttavia, gli orbitali dx2−y2 e dz2 (lungo gli assi cartesiani) si sovrappongono ai ligandi inferiori agli orbitali dxy, dxz e dyz. Per analogia con il caso ottaedro, il diagramma di energia per gli orbitali d in un campo cristallino tetraedro può essere previsto come mostrato nella figura 1. Per evitare confusione, l’insieme octaedrale eg diventa un insieme e tetraedro, e l’insieme ottaedro t2g diventa un insieme t2.
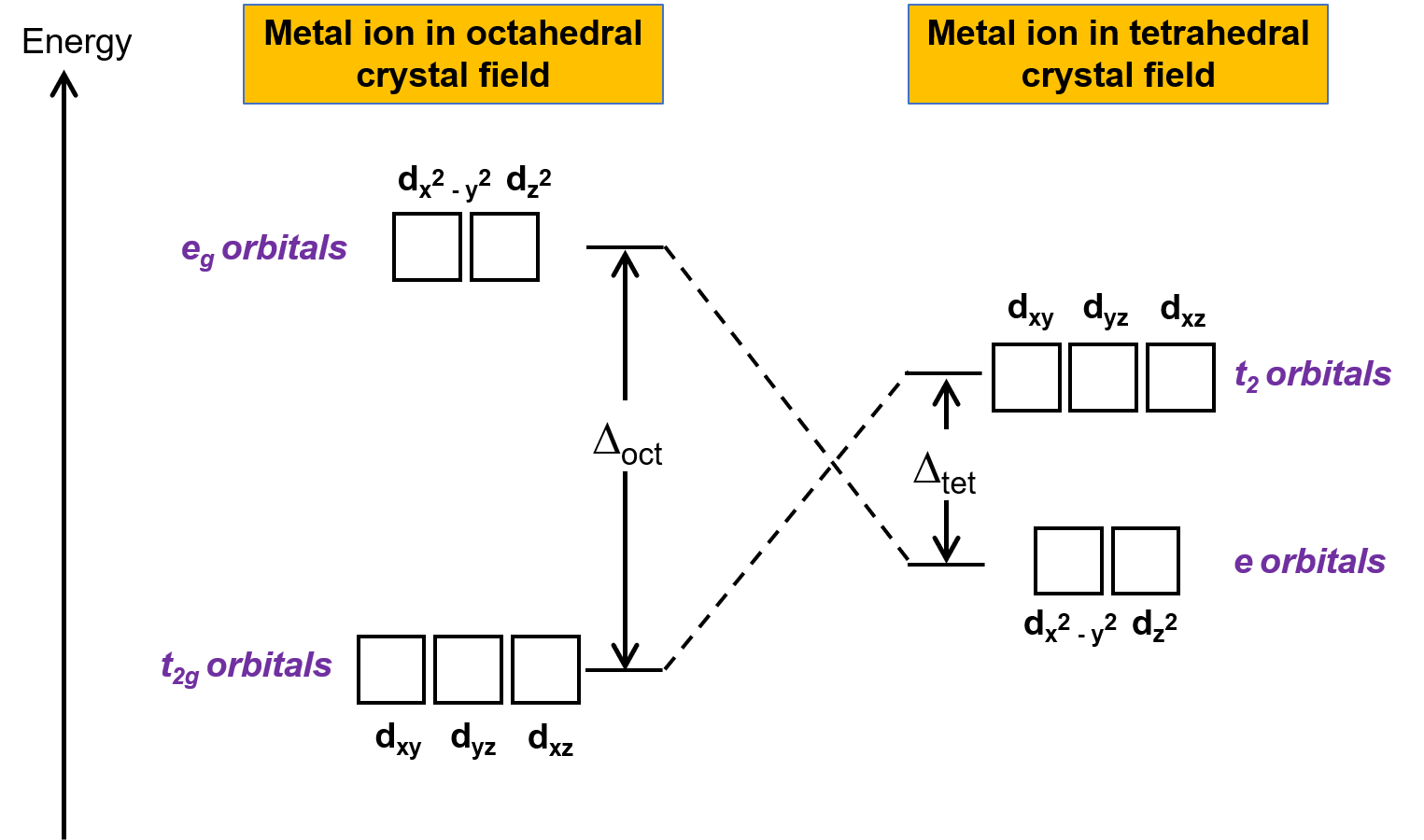
Figura 1. Suddivisione degli orbitali d dello ione metallico sotto campi di cristallo ottaedro e tetraedro. Rispetto al campo cristallino ottaedro, il modello di scissione nel campo cristallino tetraedro viene invertito. L’energia di scissione del campo cristallino del complesso ottaedro, o Δoct, è più grande dell’energia di scissione del campo cristallino del complesso tetraedro, Δtet .
Poiché la CFT è basata sulla repulsione elettrostatica, gli orbitali più vicini ai ligandi saranno destabilizzati e aumentati di energia rispetto all’altro insieme di orbitali. La scissione è minore che per i complessi ottaedri perché la sovrapposizione è minore, quindi il campo cristallino che divide l’energia, oΔ tet è solitamente piccolo.
Complessi planari quadrati
L’altra geometria comune è piana quadrata. È possibile considerare una geometria planare quadrata come una struttura ottaedrica con una coppia di ligandi trans rimossi. Si presume che i ligandi rimossi si trovano sull’asse z. Questo cambia la distribuzione degli orbitali d, man mano che gli orbitali sull’asse zo vicino a esso diventano più stabili, e quelli sugli assi x o ydiventano meno stabili. Ciò si traduce nell’ottaedro t2g e nell’e gimposta la scissione e dà un modello di scissione più complicato (Figura 2).
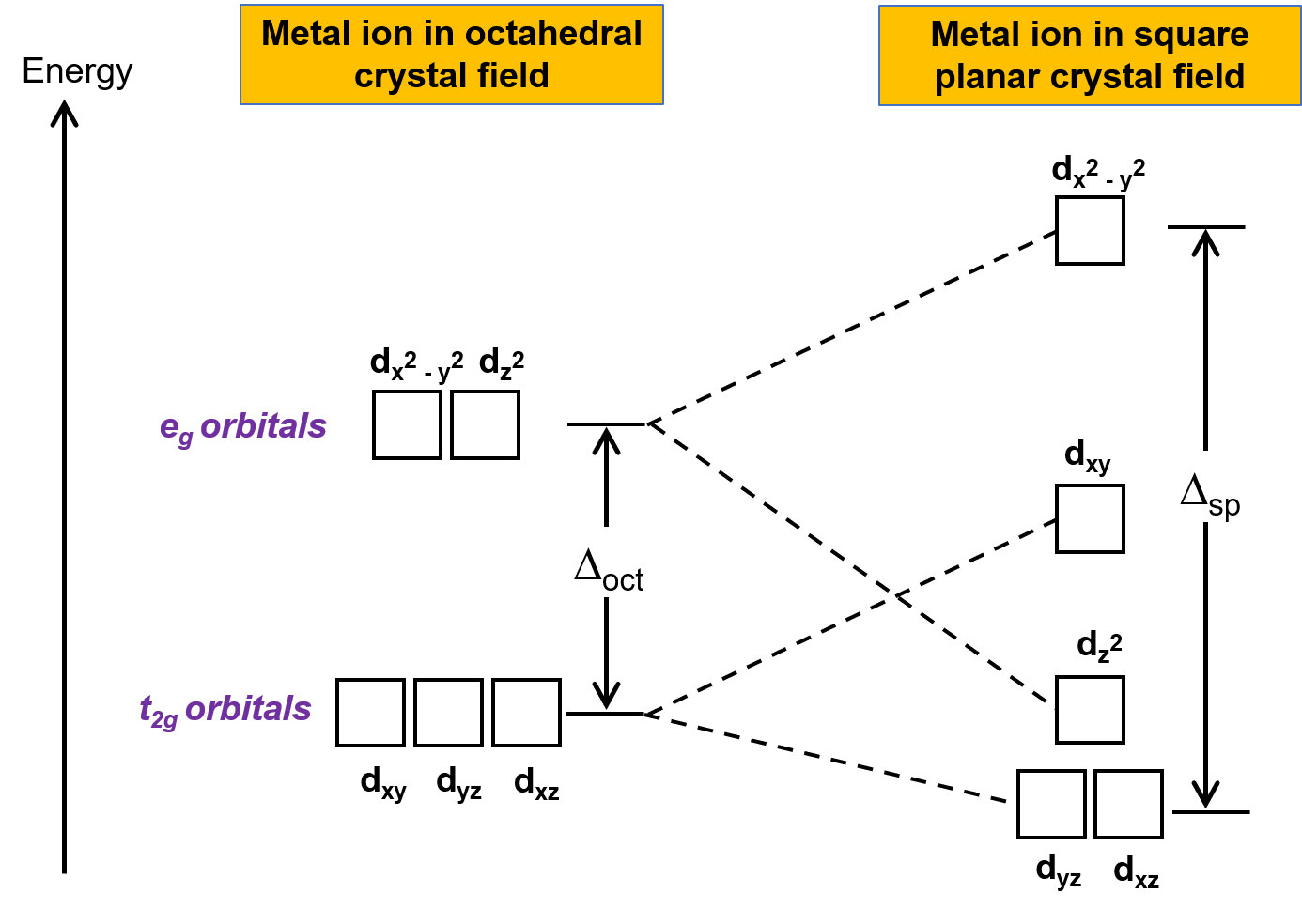
Figura 2. Scissione dell’insieme t2g e dell’insiemeg di orbitali in un campo cristallino planare quadrato. L’energia di divisione del campo cristallino dei complessi planari quadrati, o Δsp, è maggiore di Δoct.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 19.3: Proprietàpectroscopiche e magnetiche dei composti di coordinazione.
