Dans Expression in ovo de microARN dans ventrale Poussin mésencéphale
Summary
L'expression ectopique est une technique permettant d'éclaircir le rôle des microARN dans le développement du cerveau. Cependant, le ciblage des zones spécifiques à l'aide de l'électroporation in ovo est un défi. Ici, nous montrons de manière efficace à des régions du mésencéphale ventral et dorsal sélectivement l'électroporation.
Abstract
Les ARN non codantes sont des acteurs supplémentaires dans la régulation de l'expression génique. Ciblée dans électroporation in ovo de domaines spécifiques fournit un outil unique pour le contrôle spatial et temporel de l'expression de microARN extra-utérine. Cependant, les structures du cerveau comme le mésencéphale ventral ventrales sont plutôt difficiles à atteindre pour tous les manipulations. Ici, nous démontrons un moyen efficace pour l'électroporation des miARN dans le mésencéphale ventral en utilisant des électrodes de platine minces. Cette méthode offre un moyen fiable pour transfecter des zones spécifiques du cerveau moyen et un outil utile pour les études in vivo.
Introduction
La reconnaissance de petits ARN non-codants que les joueurs supplémentaires pour l'expression du gène a lancé une nouvelle complexité à la réglementation génomique programmation / de gène. Différentes espèces d'ARN non-codants ont une importance fonctionnelle dans les cellules neuronales, y compris les petits ARN non-codant 1-4. Les microARN miR (ou miARN) par exemple montrent des profils d'expression distincts et l'évolution dans le cerveau en développement 5. Ciblée dans électroporation in ovo d'embryons de poulet offre une occasion unique pour le contrôle temporelle et spatiale de l'expression génique et de la répression au cours du développement.
Cette vidéo montre les différentes étapes de réalisation d'expression ectopique de mirs dans des zones spécifiques du cerveau moyen de poussin en utilisant l'électroporation in ovo 6-10. Pour assurer un effet de longue durée de ces petits ARN non codants dans les cellules, la séquence d'ADN de mirs ont été clones dans des vecteurs de mono-ou bi-cistroniques. Pour en électroporation in ovo, miR contenant vecteur est injecté dans le tube neural par exposition du mésencéphale embryonnaire après avoir effectué une petite fenêtre dans la coquille de l'oeuf. Pour transfecter des zones spécifiques du petit plus mésencéphale (anode) et moins (cathode) électrodes de platine sont placés à des positions spécifiques. Pour la transfection du mésencéphale ventral, l'anode est placée sous le mésencéphale ventral gauche et la cathode au-dessus de la moitié droite du mésencéphale avant l'application d'un courant. L'ouverture dans la coquille d'oeuf est fermé avec la bande et les embryons sont incubés pendant aussi longtemps que nécessaire pour toute l'analyse. Cette méthode a été décrite par Muramatsu et al. 6 et amélioré par Momose et al. 8 pour la zone transfection spécifique.
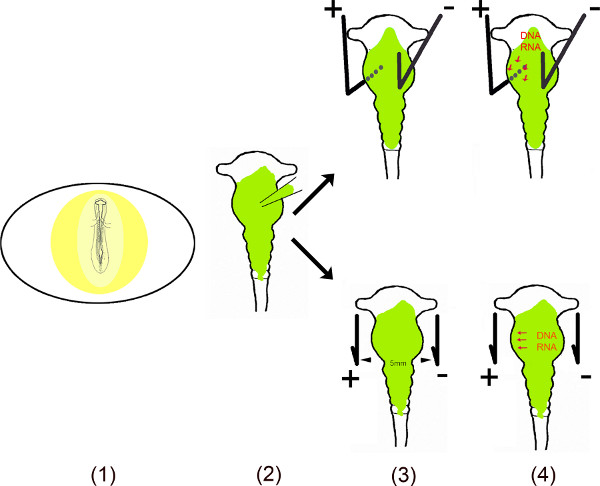
Vue d'ensemble schématique.
- L'embryon dans l'œuf est exposée en coupant une petite fenêtre en ee coquille.
- Le vecteur (s) en solution est injecté dans le mésencéphale en utilisant un micro-capillaire.
- Deux électrodes placées parallèlement – ou en dessous et au-dessus de l'embryon, – générer un champ électrique pulsé.
- Le champ électrique crée temporairement des pores dans la membrane cellulaire, ce qui facilite l'entrée dans la cellule par l'ADN chargé négativement (ou d'ARN) attirés par l'anode 11,12.
Protocol
Representative Results
Discussion
Cette vidéo montre une méthode efficace pour transfecter le plasmide dans les cellules neuro-épithéliales des zones spécifiques du cerveau moyen de poussin. Impulsions électriques rectangulaires de basse tension peuvent introduire de l'ADN dans des cellules du tube neural de poussin in ovo 6,16. Toutefois, la précision de ciblage de l'ADN est souvent entravée par le champ électrique de large, qui s'élève à travers les relativement grandes électrodes (Φ = 0,5 mm). Nous avons …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Nous reconnaissons K. Mikic, qui ont contribué à la phase initiale de ce film et M. Nicolescu pour l'image miR. C. Huber a été soutenue par une bourse de la IZKF du Universtitätsklinikum Tübingen, A. Alwin Prem Anand par le programme fortune de la Universtitätsklinikum Tübingen.
Materials
| Name | Company | Model | |
| Borosillicate glass capillaries | Hartenstein | Model: 0.9 mm | |
| Microcapillary puller | WPI, Berlin | Model: Pul1-E | |
| Electroporator | Intracel | Model: TSSIC | |
| Stereomicroscope – fluorescence | LEICA | Model: MZFLIII | |
| Stereomicroscope | Zeiss | Model: Stemi | |
| Camera and software | Zeiss | Model: Axiocam MRc/ Axiovision Re. 4.8 |
References
- Kutter, C., Svoboda, P. miRNA, siRNA, piRNA: Knowns of the unknown. RNA Biol. 5, 181-188 (2008).
- Szell, M., Bata-Csorgo, Z., Kemeny, L. The enigmatic world of mRNA-like ncRNAs: their role in human evolution and in human diseases. Semin. Cancer Biol. 18, 141-148 (2008).
- Li, X., Jin, P. Roles of small regulatory RNAs in determining neuronal identity. Nature reviews. Neuroscience. 11, 329-338 (2010).
- Riedmann, L. T., Schwentner, R. miRNA, siRNA, piRNA and argonautes: news in small matters. RNA Biol. 7, 133-139 (2010).
- Coolen, M., Bally-Cuif, L. MicroRNAs in brain development and physiology. Curr. Opin. Neurobiol. 19, 461-470 (2009).
- Muramatsu, T., Mizutani, Y., Ohmori, Y., Okumura, J. Comparison of three nonviral transfection methods for foreign gene expression in early chicken embryos in ovo. Biochem. Biophys. Res. Commun. 230, 376-380 (1997).
- Itasaki, N., Bel-Vialar, S., Krumlauf, R. Shocking’ developments in chick embryology: electroporation and in ovo gene expression. Nat. Cell Biol. 1, 203-207 (1999).
- Momose, T., et al. Efficient targeting of gene expression in chick embryos by microelectroporation. Dev. Growth Differ. 41, 335-344 (1999).
- Nakamura, H., Watanabe, Y. Misexpression of genes in brain vesicles by in ovo electroporation. Dev. Growth Differ. 42, 199-201 (2000).
- Voiculescu, O., Papanayotou, C., Stern, C. D. Spatially and temporally controlled electroporation of early chick embryos. Nat. Protoc. 3, 419-426 (2008).
- Neumann, E., Schaefer-Ridder, M., Wang, Y., Gene Hofschneider, P. H. transfer into mouse lyoma cells by electroporation in high electric fields. The EMBO journal. 1, 841-845 (1982).
- Potter, H., Weir, L., Leder, P. Enhancer-dependent expression of human kappa immunoglobulin genes introduced into mouse pre-B lymphocytes by electroporation. Proceedings of the National Academy of Sciences of the United States of America. 81, 7161-7165 (1984).
- Krull, C. E. A primer on using in ovo electroporation to analyze gene function. Dev. Dyn. 229, 433-439 (2004).
- Canto-Soler, M. V., Adler, R. Optic cup and lens development requires Pax6 expression in the early optic vesicle during a narrow time window. Developmental biology. , 294-2119 (2006).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. 1951. Dev Dyn. 195, 231-272 (1992).
- Muramatsu, T., Nakamura, A., Park, H. M. In vivo electroporation: a powerful and convenient means of nonviral gene transfer to tissues of living animals (Review). Int J Mol Med. 1, 55-62 (1998).
- Agoston, Z., Li, N., Haslinger, A., Wizenmann, A., Schulte, D. Genetic and physical interaction of Meis2, Pax3 and Pax7 during dorsal midbrain development. BMC Dev Biol. 12, 10 (2012).
- De Pietri Tonelli, D., et al. Single-cell detection of microRNAs in developing vertebrate embryos after acute administration of a dual-fluorescence reporter/sensor plasmid. Biotechniques. 41, 727-732 (2006).

