בביטוי אוב של microRNA בגחון צ'יק מוח התיכון
Summary
ביטוי מחוץ לרחם הוא טכניקה אחת על מנת להבהיר את תפקיד רנ"א בהתפתחות המוח. עם זאת, מיקוד באזורים מסוימים באמצעות ב electroporation אובו הוא מאתגר. כאן, אנו מציגים דרך יעילה לאזורי המוח התיכון הגחון ועל גב באופן סלקטיבי electroporate.
Abstract
RNAs ללא קידוד הם שחקנים נוספים בויסות ביטוי הגנים. ממוקד ב electroporation אובו של אזורים ספציפיים מספק כלי ייחודי לשליטה במרחב ובזמן של ביטוי microRNA מחוץ לרחם. עם זאת, מבנים מוחיים הגחון כמו המוח התיכון הגחון הם די קשים להגיע לכל מניפולציות. הנה, אנחנו מדגימים דרך יעילה לelectroporate מירנה למוח תיכון הגחון באמצעות אלקטרודות פלטינה דקות. שיטה זו מציעה דרך אמינה transfect אזורים ספציפיים של המוח התיכון וכלי שימושי במחקרי vivo.
Introduction
ההכרה של RNAs ללא קידוד הקטן כמו שחקנים נוספים לביטוי גנים השיקה מורכבות חדשות לרגולציה תכנות / גן הגנומי. יש מינים שונים של RNAs ללא קידוד חשיבות תפקודית בתאים עצביים, כוללים קטן RNAs 1-4 ללא קידוד. מיקרו RNA (miR או מירנה) למשל מראה פרופילי ביטוי שונים ומשתנים במוח המתפתח 5. ממוקדת ב electroporation אובו של עובר חומוס מספקת הזדמנות ייחודית לבקרת זמן ומרחב של ביטוי גנים והשתקה במהלך פיתוח.
סרט הווידאו הזה מדגים את השלבים השונים של ביצוע ביטוי מחוץ לרחם של מירס באזורים מסוימים של המוח התיכון חומוס שימוש באוב electroporation 6-10. כדי להבטיח השפעה ארוכה טווח של RNAs ללא קידוד אלה הקטנים בתאים, רצף ה-DNA של מירס היו משובט לתוך וקטורים מונו או דו cistronic. לב electroporation אובו, miR מכיל vEctor מוזרק לתוך הצינור עצבי המוח התיכון על ידי חשיפת העובר לאחר ביצוע חלון קטן בקליפת הביצה. כדי transfect אזורים ספציפיים במוח התיכון בתוספת הקטנה (האנודה) ומינוס (קטודה) אלקטרודות פלטינה ממוקמות בעמדות ספציפיות. עבור transfection המוח התיכון הגחון, האנודה ממוקמת מתחת למוח תיכון הגחון השמאל והקתודה מעל המחצית הימנית של המוח התיכון לפני היישום נוכחית. הפתיחה בקליפת הביצה סגורה עם קלטת ועוברים טופחו במשך כל זמן שנדרש לכל ניתוח. שיטה זו תוארה במקור על ידי Muramatsu et al. 6 ומשופרת על ידי Momose et al. 8 עבור transfection הספציפי לאזור.
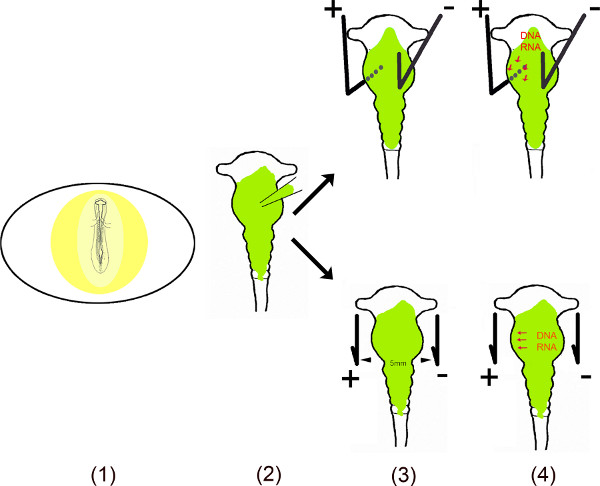
סקירת סכמטי.
- העובר בביצה חשוף על ידי חיתוך חלון קטן לתוך הדואר קליפת ביצה.
- הווקטור (ים) מומס מוזרק לתוך המוח התיכון באמצעות נימי מיקרו.
- שתי אלקטרודות – המונחות במקביל או מתחת ומעל לעובר – ליצור שדה חשמלי פעם.
- השדה החשמלי temporally יוצר נקבוביות בקרום התא, המאפשר כניסה לתא על ידי-DNA הטעון השלילי (או RNA) נמשך להאנודה 11,12.
Protocol
Representative Results
Discussion
וידאו זה מדגים שיטה יעילה לtransfect פלסמיד לתוך תאי neuroepithelial של אזורים הספציפיים של המוח התיכון החומוס. פולסים חשמליים מלבניים של מתח נמוך יכולים להציג את ה-DNA לתוך תאים של הצינור העצבי החומוס באוב 6,16. עם זאת, הדיוק של מיקוד DNA מתעכבת לעתים קרובות על ידי השדה …
Disclosures
The authors have nothing to disclose.
Acknowledgements
אנו מכירים ק Mikic, שתרם לשלב הראשוני של הסרט הזה ומ Nicolescu לתמונת miR. ג הובר נתמכה על ידי מענק של IZKF של טובינגן Universtitätsklinikum, א 'אלווין הפר אנאנד על ידי תכנית ההון של טובינגן Universtitätsklinikum.
Materials
| Name | Company | Model | |
| Borosillicate glass capillaries | Hartenstein | Model: 0.9 mm | |
| Microcapillary puller | WPI, Berlin | Model: Pul1-E | |
| Electroporator | Intracel | Model: TSSIC | |
| Stereomicroscope – fluorescence | LEICA | Model: MZFLIII | |
| Stereomicroscope | Zeiss | Model: Stemi | |
| Camera and software | Zeiss | Model: Axiocam MRc/ Axiovision Re. 4.8 |
References
- Kutter, C., Svoboda, P. miRNA, siRNA, piRNA: Knowns of the unknown. RNA Biol. 5, 181-188 (2008).
- Szell, M., Bata-Csorgo, Z., Kemeny, L. The enigmatic world of mRNA-like ncRNAs: their role in human evolution and in human diseases. Semin. Cancer Biol. 18, 141-148 (2008).
- Li, X., Jin, P. Roles of small regulatory RNAs in determining neuronal identity. Nature reviews. Neuroscience. 11, 329-338 (2010).
- Riedmann, L. T., Schwentner, R. miRNA, siRNA, piRNA and argonautes: news in small matters. RNA Biol. 7, 133-139 (2010).
- Coolen, M., Bally-Cuif, L. MicroRNAs in brain development and physiology. Curr. Opin. Neurobiol. 19, 461-470 (2009).
- Muramatsu, T., Mizutani, Y., Ohmori, Y., Okumura, J. Comparison of three nonviral transfection methods for foreign gene expression in early chicken embryos in ovo. Biochem. Biophys. Res. Commun. 230, 376-380 (1997).
- Itasaki, N., Bel-Vialar, S., Krumlauf, R. Shocking’ developments in chick embryology: electroporation and in ovo gene expression. Nat. Cell Biol. 1, 203-207 (1999).
- Momose, T., et al. Efficient targeting of gene expression in chick embryos by microelectroporation. Dev. Growth Differ. 41, 335-344 (1999).
- Nakamura, H., Watanabe, Y. Misexpression of genes in brain vesicles by in ovo electroporation. Dev. Growth Differ. 42, 199-201 (2000).
- Voiculescu, O., Papanayotou, C., Stern, C. D. Spatially and temporally controlled electroporation of early chick embryos. Nat. Protoc. 3, 419-426 (2008).
- Neumann, E., Schaefer-Ridder, M., Wang, Y., Gene Hofschneider, P. H. transfer into mouse lyoma cells by electroporation in high electric fields. The EMBO journal. 1, 841-845 (1982).
- Potter, H., Weir, L., Leder, P. Enhancer-dependent expression of human kappa immunoglobulin genes introduced into mouse pre-B lymphocytes by electroporation. Proceedings of the National Academy of Sciences of the United States of America. 81, 7161-7165 (1984).
- Krull, C. E. A primer on using in ovo electroporation to analyze gene function. Dev. Dyn. 229, 433-439 (2004).
- Canto-Soler, M. V., Adler, R. Optic cup and lens development requires Pax6 expression in the early optic vesicle during a narrow time window. Developmental biology. , 294-2119 (2006).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. 1951. Dev Dyn. 195, 231-272 (1992).
- Muramatsu, T., Nakamura, A., Park, H. M. In vivo electroporation: a powerful and convenient means of nonviral gene transfer to tissues of living animals (Review). Int J Mol Med. 1, 55-62 (1998).
- Agoston, Z., Li, N., Haslinger, A., Wizenmann, A., Schulte, D. Genetic and physical interaction of Meis2, Pax3 and Pax7 during dorsal midbrain development. BMC Dev Biol. 12, 10 (2012).
- De Pietri Tonelli, D., et al. Single-cell detection of microRNAs in developing vertebrate embryos after acute administration of a dual-fluorescence reporter/sensor plasmid. Biotechniques. 41, 727-732 (2006).

