В ово выражения микроРНК в Брюшной Chick мозга
Summary
Внематочная выражение одна техника для выяснения роли микроРНК в развитии мозга. Тем не менее, ориентированные на конкретные области применения в ово электропорации является сложной задачей. Здесь мы покажем это эффективный способ выборочно электропорации брюшной и спинной среднего мозга регионы.
Abstract
Некодирующих РНК дополнительные игроки в регуляции экспрессии генов. Целевые в ово электропорации конкретных областях предоставляет уникальный инструмент для пространственного и временного контроля эктопической экспрессии микроРНК. Тем не менее, брюшные структуры мозга, как брюшной мозга довольно трудно достичь за любые манипуляции. Здесь мы демонстрируем эффективный способ электропорации микроРНК в брюшной мозга с помощью тонких платиновых электродов. Этот метод предлагает надежный способ трансфекции конкретных областей мозга и полезный инструмент для естественных условиях исследования в.
Introduction
Признание малых некодирующих РНК в качестве дополнительных игроков для экспрессии генов запустила новый сложность геномной регуляции программирования / генов. Различные виды некодирующих РНК имеют функциональное значение в нервных клетках, в том числе малого некодирующих РНК 1-4. Микро РНК (микроРНК или микроРНК), например отчетливые и меняющиеся профили экспрессии в развивающихся мозгах 5. Целевые в ово электропорации куриных эмбрионов обеспечивает уникальная возможность для временной и пространственной контроля экспрессии генов и молчания во время развития.
Это видео демонстрирует различные этапы выполнения эктопическая экспрессия Мирс в конкретных областях куриного мозга использования в ово электропорации 6-10. Для обеспечения длительный эффект этих маленьких некодирующих РНК в клетках, последовательность ДНК Мирс, были клонированы в моно-или би-cistronic векторов. Ибо в ово электропорации, микроРНК, содержащий VEctor вводят в среднего мозга нервной трубки, подвергая эмбрион после внесения небольшое окно в яичной скорлупы. Для трансфекции конкретных областей среднего мозга небольшом плюсе (анод) и минус (катод) платиновые электроды размещаются на определенных позициях. Для среднего мозга вентральной трансфекции, анод находится под левой вентральной мозга и катодом над правой половине мозга перед нанесением ток. Отверстие в скорлупе закрывают лентой и эмбрионы инкубировали в течение тех пор, пока требуется для любого анализа. Этот метод первоначально был описан Мурамацу соавт. 6 и улучшить Momose соавт. 8 для конкретной области трансфекции.
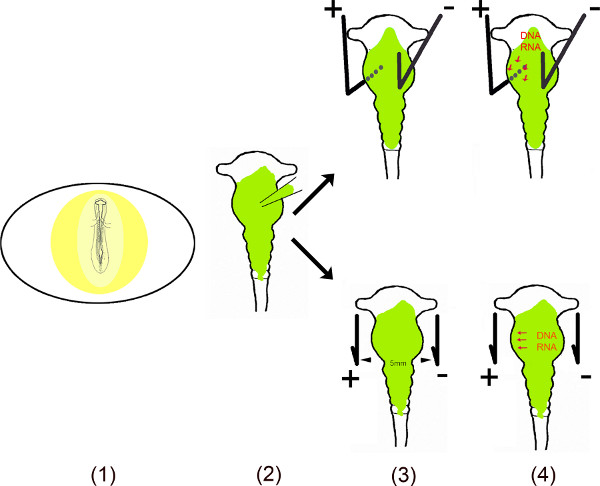
Принципиальная Обзор.
- Эмбрион в яйце подвергается путем разрезания небольшое окно в гоэ яичной скорлупы.
- Растворенный вектор (ы) вводят в мозге с помощью микро капилляр.
- Два электрода – размещенные параллельно или под и над эмбриона – генерировать импульсного электрического поля.
- Электрическое поле временно создает поры в клеточной мембране, которые облегчают вход в клетку отрицательно заряженным ДНК (или РНК) привлек к аноду 11,12.
Protocol
Representative Results
Discussion
Это видео демонстрирует эффективный метод для трансфекции плазмиды в нейроэпителиальных клетках конкретных областях куриного мозга. Прямоугольные электрические импульсы низкого напряжения можно ввести ДНК в клетках кур нервной трубки в ово 6,16. Однако точность таргетинга…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Мы признаем, К. Mikic, кто внес вклад в начальной фазе этого фильма и М. Николеску для картины микроРНК. С. Хубер была поддержана общение в IZKF от Universtitätsklinikum Тюбинген, А. Alwin Прем Ананд по программе состоянием на Universtitätsklinikum Тюбингене.
Materials
| Name | Company | Model | |
| Borosillicate glass capillaries | Hartenstein | Model: 0.9 mm | |
| Microcapillary puller | WPI, Berlin | Model: Pul1-E | |
| Electroporator | Intracel | Model: TSSIC | |
| Stereomicroscope – fluorescence | LEICA | Model: MZFLIII | |
| Stereomicroscope | Zeiss | Model: Stemi | |
| Camera and software | Zeiss | Model: Axiocam MRc/ Axiovision Re. 4.8 |
References
- Kutter, C., Svoboda, P. miRNA, siRNA, piRNA: Knowns of the unknown. RNA Biol. 5, 181-188 (2008).
- Szell, M., Bata-Csorgo, Z., Kemeny, L. The enigmatic world of mRNA-like ncRNAs: their role in human evolution and in human diseases. Semin. Cancer Biol. 18, 141-148 (2008).
- Li, X., Jin, P. Roles of small regulatory RNAs in determining neuronal identity. Nature reviews. Neuroscience. 11, 329-338 (2010).
- Riedmann, L. T., Schwentner, R. miRNA, siRNA, piRNA and argonautes: news in small matters. RNA Biol. 7, 133-139 (2010).
- Coolen, M., Bally-Cuif, L. MicroRNAs in brain development and physiology. Curr. Opin. Neurobiol. 19, 461-470 (2009).
- Muramatsu, T., Mizutani, Y., Ohmori, Y., Okumura, J. Comparison of three nonviral transfection methods for foreign gene expression in early chicken embryos in ovo. Biochem. Biophys. Res. Commun. 230, 376-380 (1997).
- Itasaki, N., Bel-Vialar, S., Krumlauf, R. Shocking’ developments in chick embryology: electroporation and in ovo gene expression. Nat. Cell Biol. 1, 203-207 (1999).
- Momose, T., et al. Efficient targeting of gene expression in chick embryos by microelectroporation. Dev. Growth Differ. 41, 335-344 (1999).
- Nakamura, H., Watanabe, Y. Misexpression of genes in brain vesicles by in ovo electroporation. Dev. Growth Differ. 42, 199-201 (2000).
- Voiculescu, O., Papanayotou, C., Stern, C. D. Spatially and temporally controlled electroporation of early chick embryos. Nat. Protoc. 3, 419-426 (2008).
- Neumann, E., Schaefer-Ridder, M., Wang, Y., Gene Hofschneider, P. H. transfer into mouse lyoma cells by electroporation in high electric fields. The EMBO journal. 1, 841-845 (1982).
- Potter, H., Weir, L., Leder, P. Enhancer-dependent expression of human kappa immunoglobulin genes introduced into mouse pre-B lymphocytes by electroporation. Proceedings of the National Academy of Sciences of the United States of America. 81, 7161-7165 (1984).
- Krull, C. E. A primer on using in ovo electroporation to analyze gene function. Dev. Dyn. 229, 433-439 (2004).
- Canto-Soler, M. V., Adler, R. Optic cup and lens development requires Pax6 expression in the early optic vesicle during a narrow time window. Developmental biology. , 294-2119 (2006).
- Hamburger, V., Hamilton, H. L. A series of normal stages in the development of the chick embryo. 1951. Dev Dyn. 195, 231-272 (1992).
- Muramatsu, T., Nakamura, A., Park, H. M. In vivo electroporation: a powerful and convenient means of nonviral gene transfer to tissues of living animals (Review). Int J Mol Med. 1, 55-62 (1998).
- Agoston, Z., Li, N., Haslinger, A., Wizenmann, A., Schulte, D. Genetic and physical interaction of Meis2, Pax3 and Pax7 during dorsal midbrain development. BMC Dev Biol. 12, 10 (2012).
- De Pietri Tonelli, D., et al. Single-cell detection of microRNAs in developing vertebrate embryos after acute administration of a dual-fluorescence reporter/sensor plasmid. Biotechniques. 41, 727-732 (2006).

