A Laser rápida Sondagem Método facilita a determinação não invasiva e sem contato das propriedades térmicas da folha
Summary
A method was developed to determine the specific heat capacity and thermal conductivity of leaf tissue by non-invasive, contact-free near infrared laser probing, which requires less than 1 min per sample.
Abstract
As plantas podem produzir substâncias valiosas tais como metabolitos secundários e proteínas recombinantes. A purificação deste último a partir da biomassa da planta pode ser racionalizada por tratamento térmico (branqueamento). Um aparelho de branqueamento pode ser concebido de forma mais precisa se as propriedades térmicas das folhas são conhecidos em detalhe, isto é, a capacidade de calor específico e condutividade térmica. A medição destas propriedades é demorado e trabalhoso, e geralmente requer métodos invasivos que em contacto com a amostra directamente. Isto pode reduzir o rendimento do produto e podem ser incompatíveis com as exigências de contenção, por exemplo, no contexto de boas práticas de fabrico. Para resolver estas questões, um método não-invasivo, sem contato foi desenvolvido que determina a capacidade de calor específico e condutividade térmica de uma folha da planta intacta em cerca de um minuto. O método envolve a aplicação de um curto impulso de laser de comprimento e intensidade definida a uma pequena área doamostra de folha, fazendo com que um aumento de temperatura que é medido usando um sensor de infravermelho próximo. O aumento da temperatura é combinada com as propriedades conhecidas da folha (espessura e densidade) para determinar a capacidade de calor específico. A condutibilidade térmica é então calculada com base no perfil da queda de temperatura subsequente, tomando radiação térmica e a transferência de calor por convecção em conta. Os cálculos associados e aspectos críticos da manipulação da amostra são discutidos.
Introduction
O processamento em larga escala de materiais biológicos, muitas vezes requer passos de tratamento térmico, tais como a pasteurização. O equipamento de tais processos pode ser concebido de forma mais precisa se as propriedades térmicas dos materiais biológicos estão bem caracterizadas, incluindo a capacidade de calor específico (c p, s) e da condutibilidade térmica (λ). Estes parâmetros podem ser determinados facilmente para líquidos, suspensões e homogeneizados por calorimetria 1. No entanto, medição tais parâmetros em amostras sólidas pode ser trabalhoso, e muitas vezes requer o contato direto com a amostra ou até mesmo sua destruição 2. Por exemplo, as técnicas fototérmicos requerem contato direto entre a amostra eo detector 3. Tais limitações são aceitáveis durante o processamento de alimentos, mas são incompatíveis com os processos altamente regulados, tais como a produção de proteínas biofarmacêuticas em plantas no contexto das boas práticas de fabricação 4. Eun tal contexto, repetido (por exemplo, semanalmente) monitoramento das propriedades térmicas podem ser necessárias durante um período de crescimento de sete semanas para as plantas individuais como uma ferramenta de controle de qualidade. Se uma tal monitorização exigiria e consumir uma folha para cada medição, não haveria esquerda para a processar, no momento da colheita da biomassa.
Além disso, utilizando apenas partes de folha em vez iria causar ferimentos para a planta e aumentar o risco de necrose ou infecção patogénica, novamente diminuindo o rendimento do processo. O risco de infecção patogénica pode também aumentar se com um método de contacto directo com a amostra seria usado, induzir o risco de que um lote inteiro de plantas podem ser infectados através de contacto com um sensor de dispositivo contaminado. Aspectos semelhantes têm que ser consideradas para o monitoramento da planta salienta como a seca, por exemplo, em um contexto ecofisiológico. Por exemplo, a perda de água é frequentemente acompanhada por uma alteração na biomassa fresca, o que requer uma Tre invasivaatment das plantas sob investigação 5, por exemplo, dissecando uma folha. Em vez disso, a determinação da capacidade de calor específico, que depende do teor de água de uma amostra, de um modo não-invasivo, como descrito aqui, pode ser utilizada como um parâmetro alternativo para o estado de hidratação das plantas. Em ambos os casos (produção farmacêutica e ecofisiologia), tensões artificiais induzidas por técnicas de medição destrutivas ou invasivos seria prejudicial uma vez que pode distorcer os dados experimentais. Métodos de flash Portanto, relatados anteriormente 6 ou a colocação de amostras entre as placas de prata 7 são inadequados para tais processos e experiências porque quer requerem contato direto com a amostra ou são destrutivos. Os parâmetros c p, s e λ deve ser determinada, a fim de projetar os equipamentos de processo para um passo de branqueamento que podem simplificar a purificação do produto e, assim, reduzir os custos de fabricação 8-10. ambos cp, s e λ agora pode ser rapidamente determinada por infravermelho próximo não destrutivo (NIR) de laser sem contacto de sondagem de um modo consistente e reprodutível 11 e este novo método irá ser explicado em detalhe a seguir. Os resultados obtidos com este método foram usadas com sucesso para simular a transferência de calor em folhas de tabaco 12, permitindo que o design do equipamento de processamento apropriado e a selecção dos parâmetros correspondentes, tais como a temperatura de branqueamento.
O método é fácil de configurar (Figura 1) e tem duas fases, medição e análise, cada um dos quais compreende duas etapas principais. Na fase de medição, uma amostra de folhas é em primeiro lugar aquecida localmente por um impulso laser curto e a temperatura máxima da amostra é registado. O perfil de temperatura da amostra é então registada para a duração de 50 s. Na fase de análise, as propriedades da folha, como a densidade (facilmente e com precisão determinada pelo measurem picnométricoENT) são combinados com a temperatura máxima da amostra para calcular c p, s. No segundo passo, o perfil de temperatura da folha é usada como entrada para uma equação do balanço de energia, tendo condução, convecção e radiação em consideração, para calcular λ.
As instruções detalhadas passo-a-passo são fornecidos na secção de protocolo, a expansão do conteúdo do vídeo de acompanhamento. medições típicas são mostrados na seção de resultados. Finalmente, os benefícios e as limitações do método são destacadas na seção de discussão, juntamente com potenciais melhorias e outras aplicações.
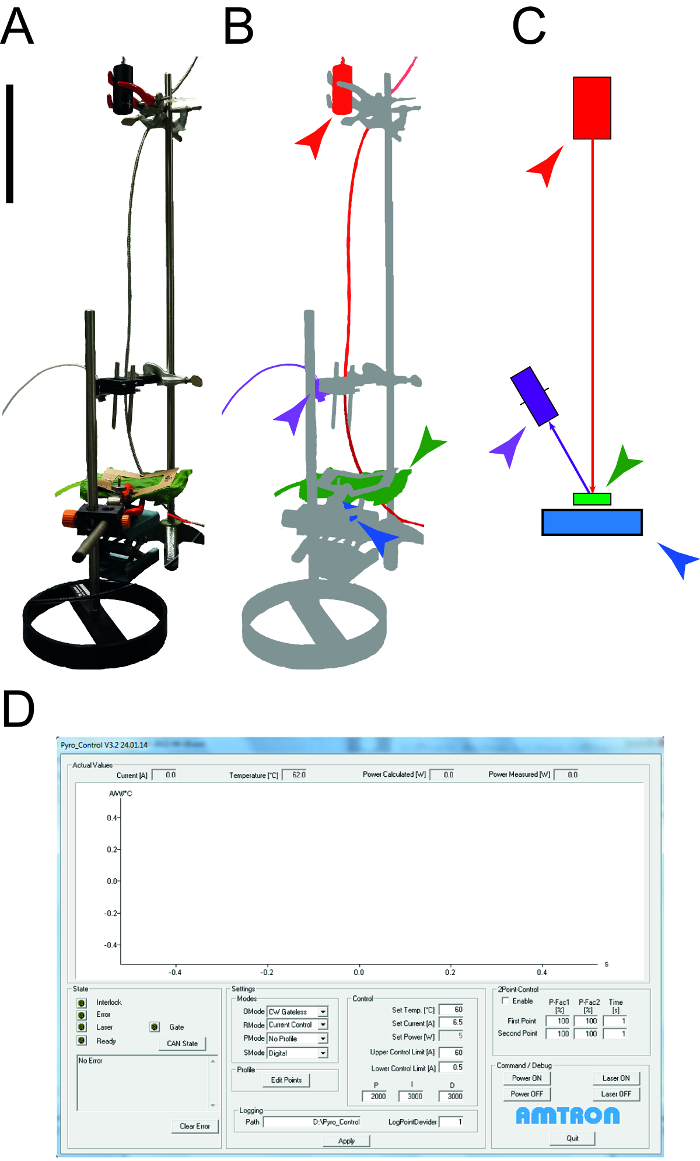
Figura 1: Os aparelhos utilizados para determinar as propriedades térmicas da folha. Uma. Fotografia do aparelho de medição utilizadas para determinar a capacidade de calor específico e condutividade térmica do leAves. Os dispositivos periféricos (computadores, osciloscópio) não são mostrados. B. Representação esquemática do aparelho de medição. O laser e os equipamentos conectados são destacadas em vermelho, o detector NIR para medição de temperatura é mostrado em roxo, a amostra da folha é verde e o sensor de potência fotodiodo é azul. C. Desenho dos elementos da configuração de medição, com o mesmo código de cores como em B. A barra indica o tamanho de 0,1 m. D. Screenshot ilustrando os elementos típicos do software de controle de laser. Por favor clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
A, método de medição não destrutivo sem contacto descrito acima pode ser utilizado para determinar c p, s e ʎ de uma forma simultânea e reprodutível. O cálculo de ʎ em particular depende de vários parâmetros que são sensíveis a erros. No entanto, o impacto dos erros era linear ou sub-proporcional, e o coeficiente de variação para todos os parâmetros se verificou ser inferior a 10%. Embora o método pode, assim, ser considerada como robusta, algumas melhorias técnicas podem ser feitas…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors are grateful to Dr. Thomas Rademacher and Ibrahim Al Amedi for cultivating the plants used in this study. We would like to thank Dr. Richard M. Twyman for his assistance with editing the manuscript. This work was in part funded by the European Research Council Advanced Grant “Future-Pharma”, proposal number 269110, the Fraunhofer Zukunftsstiftung (Future Foundation), the Fraunhofer-Gesellschaft Internal Programs under Grant No. Attract 125-600164.
Materials
| 1" tube | Thorlabs | SM1L10E | Tube for fiber holder |
| Agarose | Sigma Aldrich | A0701 | Agarose |
| Bi-Convex lense f=25.4 | Thorlabs | LB1761 | Lense |
| Digital Handheld Optical Power and Energy Meter Console | Thorlabs | PM100D | Console for thermal surface absorber sensor |
| Digital Phosphor Oscilloscope | Tektronix | DPO7104 | Oscilloscope |
| DMR light microscope | Leica | n.a. | Light microscope |
| Falcon 50mL Conical Centrifuge Tubes | Fisher Scientific | 14-432-2 | Pycnometer |
| Ferty 2 Mega | Kammlott | 5.220072 | Fertilizer |
| Fiber holder | Thorlabs | Fiber holder | |
| Forma -86C ULT freezer | ThermoFisher | 88400 | Freezer |
| Greenhouse | n.a. | n.a. | For plant cultivation |
| Grodan Rockwool Cubes 10x10cm | Grodan | 102446 | Rockwool block |
| Infrared Detector Optris CT | Optris | OPTCTLT15 | Infrared detector |
| Infrared Detector Software Compact Connect | Optris | n.a. | Control software for infrared detector |
| Lambda 1050 UV/Vis spectrophotometer | PerkinElmer | L1050 | UV/VIS Spectrophotometer |
| Laser 400μm, 1550nm Conduction Cooled Single Bar Fiber Coupled Module | DILAS | M1F-SS2.1 | Laser |
| Laser cover | Amtron | LM200 | Laser Cover |
| Laser Driver | Amtron | CS 408 | Laser Driver |
| Osram cool white 36 W | Osram | 4930440 | Light source |
| Photodiode sensor | Thorlabs | PDA20H-EC | Power sensor for transmission measurements |
| Precision weight Ohaus Analytical Plus | Ohaus | 80251552 | Precision weight |
| Sample frame | Fraunhofer ILT | n.a. | Fixation of the leaf sample |
| Software Pyro Control | Amtron | n.a. | Laser Power Control Software |
| Stainless-steel-holder | n.a. | n.a. | Holder for measurement set-up |
| Teflon plates 2cm | Fraunhofer ILT | n.a. | Teflon attenuation |
| Thermal surface absorber Power sensor | Thorlabs | S314C | Sensor for laser power measurements |
| Vibratome | Leica | 1491200S001 | Vibratome |
| Zoc/Pro 6.51 | EmTec Innovative Software | n.a. | Laser Control Software |
References
- Wilhelm, E. . Heat Capacities: Liquids, Solutions and Vapours. , 516 (2010).
- Costa, J. M., Grant, O. M., Chaves, M. M. Thermography to explore plant-environment interactions. J. Exp. Bot. 64, 3937-3949 (2013).
- Jayalakshmy, M. S., Philip, J. Thermophysical Properties of Plant Leaves and Their Influence on the Environment Temperature. International Journal of Thermophysics. 31, 2295-2304 (2010).
- Buyel, J. F. Process development strategies in plant molecular farming. Curr. Pharm. Biotechnol. 16, 966-982 (2015).
- Schuster, A. C., et al. Effectiveness of cuticular transpiration barriers in a desert plant at controlling water loss at high temperatures. AoB PLANTS. 8, (2016).
- Parker, W. J., Jenkins, R. J., Abbott, G. L., Butler, C. P. Flash Method of Determining Thermal Diffusivity, Heat Capacity, and Thermal Conductivity. J Appl Phys. 32, 1679-1684 (1961).
- Hays, R. L. The thermal conductivity of leaves. Planta. 125, 281-287 (1975).
- Menzel, S., et al. Optimized blanching reduces the host cell protein content and substantially enhances the recovery and stability of two plant derived malaria vaccine candidates. Front. Plant Sci. , (2015).
- Buyel, J. F., Hubbuch, J., Fischer, R. Blanching intact leaves or heat precipitation in an agitated vessel or heat exchanger removes host cell proteins from tobacco extracts. J. Vis. Exp. , (2015).
- Beiss, V., et al. Heat-precipitation allows the efficient purification of a functional plant-derived malaria transmission-blocking vaccine candidate fusion protein. Biotechnol. Bioeng. 112, 1297-1305 (2015).
- Buyel, J. F., Gruchow, H. M., Tödter, N., Wehner, M. Determination of the thermal properties of leaves by non-invasive contact free laser probing. J. Biotechnol. 217, 100-108 (2016).
- Buyel, J. F. Numeric simulation can be used to predict heat transfer during the blanching of leaves and intact. Biochem. Eng. J. , (2015).
- Hedlund, H., Johansson, P. Heat capacity of birch determined by calorimetry: implications for the state of water in plants. Thermochim Acta. 349, 79-88 (2000).
- Chandrakanthi, M., Mehrotra, A. K., Hettiaratchi, J. P. A. Thermal conductivity of leaf compost used in biofilters: An experimental and theoretical investigation. Environ. Pollut. 136, 167-174 (2005).
- Larcher, W. . Physiological Plant Ecology: Ecophysiology and Stress Physiology of Functional Groups. , (2003).
- Cowen, R. A gamma-ray burst’s enduring fireball. Science News. 152, 197 (1997).
- Jones, H. G., et al. Thermal infrared imaging of crop canopies for the remote diagnosis and quantification of plant responses to water stress in the field. Funct. Plant Biol. 36, 978-989 (2009).
- Defraeye, T., Verboven, P., Ho, Q. T., Nicolai, B. Convective heat and mass exchange predictions at leaf surfaces: Applications, methods and perspectives. Comput. Electron. Agric. 96, 180-201 (2013).
- Arndt, S. K., Irawan, A., Sanders, G. J. Apoplastic water fraction and rehydration techniques introduce significant errors in measurements of relative water content and osmotic potential in plant leaves. Physiol. Plant. 155, 355-368 (2015).
- Jones, H. G., Schofield, P. Thermal and other remote sensing of plant stress. General and Applied Plant Physiology. 34, 19-32 (2008).
- Jones, H. G., Archer, N., Rotenberg, E., Casa, R. Radiation measurement for plant ecophysiology. J. Exp. Bot. 54, 879-889 (2003).
- Dupont, C., Chiriac, R., Gauthier, G., Toche, F. Heat capacity measurements of various biomass types and pyrolysis residues. Fuel. 115, 644-651 (2014).
- Chaerle, L., et al. Multi-sensor plant imaging: Towards the development of a stress-catalogue. Biotechnol. J. 4, 1152-1167 (2009).
- Hackl, H., Baresel, J. P., Mistele, B., Hu, Y., Schmidhalter, U. A Comparison of Plant Temperatures as Measured by Thermal Imaging and Infrared Thermometry. J. Agron. Crop. Sci. , 415-429 (2012).
- Yuan, L., et al. Spectral analysis of winter wheat leaves for detection and differentiation of diseases and insects. Field Crops Res. 156, 199-207 (2014).

