Diabetes durch die Augen eines Fisches zu studieren: Mikrodissektion, Visualisierung und Analyse von den Erwachsenen tg(fli:EGFP) Zebrafisch Retinal Gefäßsystem
Summary
Hier diskutieren wir eine Methode-Protokoll ermöglicht eine einfache Analyse der Erwachsenen tg(fli:EGFP) Zebrafisch retinalen Gefäßsystem als eine schnelle Auslesung in Einstellungen des langfristigen vaskuläre Krankheiten Neoangiogenese und strukturelle Veränderungen verbunden.
Abstract
Die diabetische Retinopathie ist die häufigste Ursache für Erblindung bei Erwachsenen mittleren Alters. Die steigende Prävalenz des Diabetes weltweit machen die Verhinderung von diabetischen mikrovaskulärer Komplikationen eines der wichtigsten Forschungsfelder der nächsten Jahrzehnte. Spezielle, zielgerichtete Therapie und neuartige Medikamente werden benötigt, um die zunehmende Zahl von Patienten mit einem Risiko von Verlust der Sehkraft zu verwalten. Der Zebrabärbling ist ein etabliertes Tiermodell für Entwicklungsforschung Fragen mit zunehmender Bedeutung für die Modellierung von Prozessen der metabolischen multifaktorielle Erkrankung. Die Vorteile der Gattung ermöglichen optimale Visualisierung und Hochdurchsatz-Drogen-screening-Ansätze, kombiniert mit der starken Fähigkeit, knock out Gene von Interesse. Hier beschreiben wir ein Protokoll ermöglicht einfache Analyse der Erwachsenen tg(fli:EGFP) Zebrafisch retinalen Gefäßsystem als eine schnelle Auslesung in den Einstellungen der langfristigen vaskuläre Erkrankungen Neoangiogenese oder Schiff Schäden verbunden. Dies wird durch Dissektion der Zebrafisch Netzhaut und ganz-Montage des Gewebes erreicht. Visualisierung der exponierten Schiffe wird dann durch konfokale Mikroskopie des grünen EGFP Reporters in den Erwachsenen retinalen Gefäßsystem ausgedrückt erreicht. Korrekte Handhabung des Gewebes führt zu besseren Ergebnissen und weniger interne Schiff Bruch um die Visualisierung der unveränderten vaskuläre Struktur zu gewährleisten. Die Methode kann im Zebrafisch-Modelle der Netzhaut Vaskulopathie verbunden mit Veränderungen in der Schiff-Architektur sowie die Neoangiogenese genutzt werden.
Introduction
Diabetes Mellitus ist eine Stoffwechselerkrankung, die durch Hyperglykämie infolge gestörten Insulinsekretion oder unzureichende Gewebe Reaktion auf sekretierten Insulin definiert. Die WHO schätzt, dass 422 Millionen Erwachsene mit Diabetes Mellitus in 20141 lebten und die Prävalenz von Diabetes weltweit um ca. 8-10 % der Bevölkerung bis zum Jahr 20352 voraussichtlich, Diabetes und ist einer der wichtigsten Forschungsgebiete in der nächsten Jahrzehnten. Leben mit chronischen hohen Blutzucker führt zu langfristigen mikrovaskulärer Komplikationen, einschließlich diabetischer Retinopathie, Nephropathie und Polyneuropathie. Das Management und die Vorbeugung dieser Komplikationen sind schwer; in der Tat, Diabetes ist die häufigste Ursache von terminaler Niereninsuffizienz (ESRD), die zur Dialyse2führt, immer und Diabetes ist die häufigste Ursache für Erblindung bei Erwachsenen mittleren Alters3.
Die ersten Ursachen für mikrovaskuläre Schäden im diabetischen Auge sind chronische Hyperglykämie sowie Stoffwechselveränderungen und bestimmte Risikofaktoren (z.B.Bluthochdruck, Fettstoffwechselstörungen), führt zu vaskulären endothelialen Dysfunktion, Pericyte Dropout, und Kapillare Regression, die azellulären vaskulären Ärmel führt. Die daraus resultierende retinale Ischämie ist die Ursache der Neovaskularisation und erhöhten vaskulären Permeabilität, die Förderung der Entwicklung der proliferative diabetische Retinopathie (PDR)4. Diabetischer Retinopathie war in der Regel bei 37 % der Diabetes-Patienten entdeckt, während Anblick-bedrohlichen diabetischer Retinopathie bei 12 % der abgeschirmten weißen europäischen Kohorte in der UKADS Studie5festgestellt wurde. Die Behandlung kann nur verhindern, dass weitere Komplikationen und ist nicht in der Lage, die bereits verursachte Schäden vollständig wiederherstellen. Panretinale Photokoagulation, neben der glykämischen Kontrolle, ist die Standardtherapie für proliferative diabetische Retinopathie (PDR) wirkt sich auf das benachbarte gesunde Gewebe sowie Anti-VEGF Interventionen zeigen vielversprechende Ergebnisse als Alternative zu Laser Behandlung6,7, aber letztlich, spezielle, zielgerichtete Therapie und neue Medikamente sind erforderlich, um die wachsende Zahl von Patienten mit einem Risiko von Verlust der Sehkraft zu verwalten.
Die etablierten Tierforschung Modelle der diabetischen Retinopathie teilen nicht jeden Aspekt der menschlichen Pathophysiologie. Korrekte Verwendung an die spezifischen Anforderungen der wissenschaftlichen Fragestellung ist eines der wesentlichsten Teile des experimentellen Aufbaus. Der Zebrafischembryo (Danio Rerio) ist bereits weit verbreitet in Entwicklungsforschung und bietet einen optimale praktische Hintergrund zu Niederschlag oder Knockout spezifischer Gene über Morpholinos oder der CRISPR/Cas9-Technik-8. Diese Methoden können problemlos genutzt werden, im Zebrafisch, Gene, die durch groß angelegte genomweiten Assoziationsstudien (GWAS), Erzeugung von Einblicke in bestimmte Mechanismen der Progression der Erkrankung und Anfälligkeit9identifiziert wurden, zu untersuchen. Generationsübergreifende kurz, große Mengen an Nachkommen, einfach und kostengünstige Handhabung und wachsende Assay Unterstützung haben die Relevanz des Modells Zebrafisch, zumal ihr große Potenzial für die Modellierung von Stoffwechselerkrankung erhöht. Erhaltung der biologischen Mechanismen im Zebrafisch wurde als Grundlage für die pharmakologische Therapie Entwicklung gezeigt. Beispielsweise haben die antidiabetischen Medikament Metformin und Cholesterin-senkende Simvastatin nachweislich “Krankheiten” in den Modellen der cAMP/Dexamethason-induzierten hohen PEPCK Ausdruck und cholesterinreiche Diät-induzierten Hypercholesterinämie10 , 11 , 12. diese fortschreitende Einsicht in übergreifende konservierte metabolische Mechanismen wird weiter unterstützt durch die wachsende Zahl von Zebrafisch-Diabetes-Modelle durch Experimente wie z. B.: abwechselnd Inkubation in Glukose-Lösungen, Streptozotocin-induzierte Ablation von Beta-Zellen, Nitroreductase-vermittelten Beta-Zellen Ablation mit Prodrug Metronidazol, Monogene Diabetes vermittelt über pdx1 gen-Knockdown oder Ko, sowie Modelle der erhöhte Insulin-Resistenz in der Skelettmuskulatur 12. bereits etabliert diese Protokolle, die oben genannten Besonderheiten der Gattung, und die Fähigkeit, effizient zu manipulieren, das Genom in einer großen Anzahl von Proben alle zeigen die Vorteile der Zebrafisch für die Untersuchung der Mechanismen fahren komplexe Erkrankung Prozesse sowie die Fähigkeit zum Bildschirm für pharmakologische Interventionen.
Ein allgemeines Verständnis der grundlegenden Zebrafisch Auge Anatomie (Abbildung 1) ist notwendig für die Sezierer, um Zebrafisch als Modell für die Netzhaut Angiopathie nutzen. Der Zebrafisch-Auge hat sechs extraokularen Muskeln, vier Rectus und zwei schrägen Muskeln, die einfügen auf der Außenseite der Kugel auf der Sklera13. Die Hornhaut ist das transparente Gewebe für das Objektiv und geht direkt in die Lederhaut, bildet die äußere Hülle des Auges. Die Lederhaut ist undurchsichtig, hat eine teilweise Licht reflektierende Oberfläche und ist stark pigmentiert. Das Objektiv selbst ist mehr als das menschliche Gegenstück kugelförmige. Die Netzhaut besteht aus drei nukleare Schichten von neuronalen Zellen während der Sauerstoff anbietende retinale Gefäßsystem eng verbunden mit der inneren Ganglion Zellschicht ist aber keinen subretinalen Netzwerk bildet. Aderhautgefäße, im Gegensatz dazu liegen zwischen Lederhaut und Netzhaut und die Netzhaut pigmentiert Pigmentepithels (RPE) zugeordnet sind. Diese Kapillarnetzes liefert Sauerstoff auf die äußeren Teile der Netzhaut14.
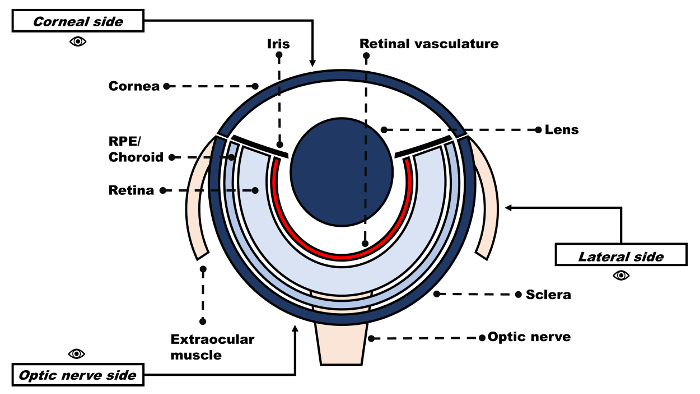
Abbildung 1: Schematische Darstellung des Auges Erwachsenen Zebrafisch. Bitte klicken Sie hier für eine größere Version dieser Figur.
Einfache Visualisierung der retinalen Gefäße kann durch Nutzung der transgenen tg(fli:EGFP) Zebrafisch Linie15erreicht werden. Das grüne fluoreszierende Protein unter Kontrolle der Fli-Promotor in Endothelzellen des Gefäßsystems ausgedrückt ist die Grundlage für die Visualisierung über einen Laser-scanning-Mikroskop in den späteren Schritten. Dies wird durch Dissektion der Zebrafisch Netzhaut und ganz-Montage des Gewebes erreicht. Diese transgenen Modell bietet eine schnelle vaskuläre Auslesen ohne jede Anwendung des intravaskulären Kennzeichnung oder ganze-Mount Immunohistochemistry. Diabetischen Retinopathie im Zebrafisch zu analysieren, sollte eine Schritt für Schritt und standardisierte Vorbereitung Routine durch jeden Sezierer verwendet werden.Das folgende Protokoll der Vorbereitung bietet anderer Forschungsgruppen die Möglichkeit, ganz einfach bewerten Gefäßveränderungen in den freiliegenden Gefäßen des Auges Erwachsenen Zebrafisch und Hilfestellung um eine optimierte Dissektion-Routine für die Netzhaut Zebrafisch zu etablieren.
Protocol
Representative Results
Discussion
Modelle der Hypoxie-induzierten retinalen Neoangiogenese zeigen erhöhten Anzahlen von Verzweigungspunkten, angiogenen Sprossen, vaskuläre Gesamtfläche und verringerte interkapilläre Abstand im Zebrafisch-20. Diese Ergebnisse unterstützen die Idee, dass der Zebrabärbling anfällig für diabetische mikrovaskulärer Komplikationen21, wie wichtige Erkenntnisse der später diabetischen Retinopathie Hypoxie-vermittelten Neoangiogenese umfassen, die stark an VEGF Ausdruck gebunden ist. Hyperglykämie-induzierten Veränderungen in der Zebrafisch Netzhaut führen zu erhöhte Dicke der Schiffe aber pflegen die insgesamt22Musterung. Eintauchen in Glukose-Lösungen für 30 Tage abwechselnd verringert auch die Dicke der IPL und INL23. Der direkte Einfluss von Glukose-Metaboliten im Zebrafisch als metabolische Befürworter der Vaskulopathie wurde auch bereits gezeigt. Weitere vaskuläre Hyperbranching wurde in das Gefäßsystem Stamm von Zebrafisch-Embryonen nach Inkubation mit Methylglyoxal24beobachtet. Im Moment gibt es kein Tiermodell bietet die wichtigsten Kriterien der diabetischen Retinopathie. Frühe Veränderungen finden sich oft, aber das Fortschreiten, proliferative diabetische Retinopathie fehlt25. Der Zebrabärbling fällt ebenfalls in diese Definition, wie wir nur Hypoxie-vermittelten Neoangiogenese oder Hyperglykämie-induzierte Veränderungen bis jetzt gesehen haben. Die aktuellen Erkenntnisse unterstützen die Idee, dass der Zebrabärbling anfällig für Hyperglykämie-vermittelten Gefäßveränderungen ist und als Tiermodell kann potenziell eine Progression, proliferative diabetische Retinopathie zeigen. Abhängig von der Stärke und Exposition gegenüber der Hyperglykämie-vermittelten Effekt Recht experimentelle Modell zu Ischämie in bestimmten Bereichen der Zebrafisch Netzhaut führen und Neoangiogenese als die wichtigsten Kriterien der proliferativen diabetischen Retinopathie fördern. Jedoch wie der Zebrabärbling ein vergleichsweise neuer Spieler auf dem Gebiet ist der Modellierung langfristiger mikrovaskulärer Pathologien, bevorstehenden Diabetes Modelle im Zebrafisch erhalten Sie weitere Informationen und ihre Bedeutung in Bezug auf andere Modelle und deren Pathologien zu klären. Beispielsweise könnte ein Kreuz tg(gata1a:DsRed) Zebrafisch mit rot-markierten Erythrozyten in die tg(fli:EGFP) Linie verwendet werden, um gleichzeitig potenzielle intraokulare Blutungen in Zukunft Zebrafisch-Modelle zeigen Mikroaneurysmen als Prädiktor für visualisieren Progression zu PDR.
Da die Netzhaut Gefäßsystem zu einer Folge von Arkaden fortschreitet, Bewertung der intervascular Abstand, Anzahl der Verzweigungspunkten und vaskuläre Gesamtfläche beziehen sich auf die Entfernung von der zentralen optischen Arterie. Um Verzerrungen in den untersuchten vaskulären Parametern zu vermeiden, ist ein Punkt der Orientierung erforderlich. Das IOC ist eine solche Struktur und ist von großer Bedeutung, da vaskulären Tätigkeitsbereiche in unmittelbarer räumlicher Nähe liegen. Für die einheitliche Bewertung sollte mehrere rechteckige Bildausschnitte mit einem einheitlichen Abstand gegenüber dem IOC der Netzhaut Scan aufgeteilt werden. Die gesamte Netzhaut sollte analysiert werden und Bilder numerisch symmetrisch verteilt. Die Zebrafisch Netzhaut zeigt Bereiche mit hohen und niedrigen Kapillardichte und eine ungleiche Verteilung von Bildausschnitten für zusätzliche Verzerrungen führen kann.
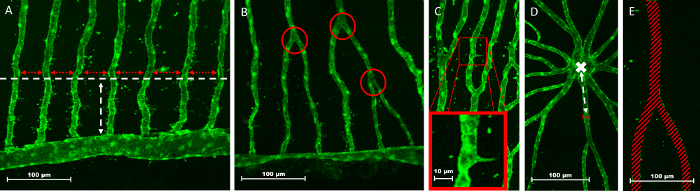
Abbildung 12: Beispiel-Präsentation der vaskulären Parameter als Auslesen der Netzhaut Gefäßsystem Visualisierung. Intervascular Abstandsmessung (roter Doppelpfeil) in der Nähe der inneren Optik Kreise (IOC) (A). Drei Verzweigungspunkten (rote Kreise) in der Nähe des IOC (B). Visualisierung der Zebrafisch retinalen Gefäßsystem mit einer erweiterten Fläche (rot markiert) zeigt eine sprießende Schiff (C). Schiffs Durchmesser gemessen über eine gewisse Distanz (weiße Doppelpfeil) von der central Artery (weißes Kreuz) (D). Schiff-Dichte ist der Prozentsatz der Netzhaut Fläche durch die Überlagerung von Schiffen (diagonale rote Linien) (E). Bitte klicken Sie hier für eine größere Version dieser Figur.
Um die intervascular Entfernung zu messen, muss man eine gewisse Distanz gegenüber dem IOC als Standard (Abbildung 12A, weiße Doppelpfeil) und Zeichnen einer gedachten horizontalen Linie (Abb. 12A, horizontale weiße Linie) parallel zu den IOC. Der Abstand zwischen den Schiffen in dieser Zeile addiert und arithmetisch gemittelt entspricht der intervascular Entfernung. Verzweigungspunkten zählen innerhalb jedes Bild, wann immer ein Schiff teilt und mehr als eine vaskuläre Lumen weiter unter dem Gesichtspunkt der Herkunft. Hierzu gehören auch horizontale Verbindungen zwischen Kapillaren. Es ist wichtig, bleiben Sie konsequent mit Analyse und entscheiden, welche Verzweigungspunkten zu zählen und halten diese Regeln in das ganze Experiment, nicht mehr benötigte Variante zu reduzieren. Vaskuläre sprießen, ist wie in Abbildung 12gezeigt ein weiterer Parameter, der in jedem Bild, Einfluss auf die Netzhaut Gefäßsystem zu bewerten gezählt werden kann. Angiogenen Sprossen folgen nicht die arkadenartige Nachfolge zwischen zentralen Arterie und IOC und Fokus in der Nähe der äußeren Teile der Netzhaut. Um bestimmte Schiffs Durchmesser zu beurteilen, Orientierungspunkt ist immer erforderlich, aus denen eine festgelegte Strecke markiert die Messung vor Ort. Die zentrale Arterie Herkunft innerhalb der Netzhaut enthält solche Anleitungen für den Hauptstamm Schiffe (Abbildung 12D, weißes Kreuz). Die Fläche von Schiffen (Abbildung 12E, diagonale rote Linien), als Prozentsatz der gesamten Netzhaut Gegend ist die vaskuläre Dichte und indirekt zum Bereich avaskulären korreliert.
Ein kompletter konfokale Scan einer Probe sollte mehrere detailreiche Bilder zur Visualisierung der kleinen Kapillaren Hypersprouting zulassen zusammensetzen. Zur Optimierung von Zeit und Ressourcen aufgewendet dieser Schritt sollte ein automatisches Körper Verfahren für jede Fliese mit einer allgemeinen Scan-Tiefe verwendet werden. Ungleichmäßige Montage der Netzhaut beträchtlich die Zeit damit verbracht, um das Gefäßsystem mit einem konfokalen Mikroskop zu scannen. In ein optimaler Ansatz möchte man nur die vaskuläre Schicht (Abbildung 13 b, white-Box), aber teilweiser Einbeziehung der GCL scan ist oft notwendig.Verlassen einer Überlänge des Sehnervs nach abschneiden, als auch die Kürzungen, die flach-Mount als zu kurz, zu erreichen führen zu ungleichen Montage.
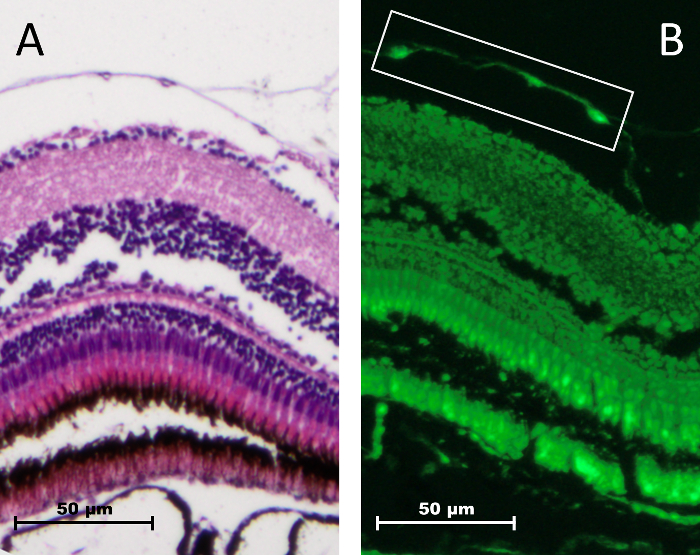
Abbildung 13: Vergleich der er Färbung und Autofluoreszenz in der Netzhaut Erwachsenen Zebrafisch. Netzhaut Gefäßsystem im Fokus über die GCL (A). Netzhaut Gefäßsystem (weißes Feld) zeigt grün ein EGFP Signal und Netzhaut Schichten ausstellenden starke Autofluoreszenz (B). Bitte klicken Sie hier für eine größere Version dieser Figur.
Wie die richtige Vorbereitung des Zebrafisch retinalen Gefäßsystems Vorbildung benötigt, eine kleinen Stichprobe mit ungeschulten Dissectors und stark variierende Vorbereitung Ergebnisse sind eine wesentliche Einschränkung der Technik. Während die Vorbereitung des tg(fli:EGFP) Zebrafisch Augen schnell Einblick in den Stand des Gefäßsystems gibt, nutzt die Technik immer noch rund 20 Minuten Arbeitszeit pro Retina für ein erfahrener Forscher. All diese Vorbereitungsschritte für die Netzhaut Gefäßsystem unter dem sezierenden Mikroskop durchgeführt werden müssen und Dissectors müssen bleiben konzentriert die ganze Zeit wie ein unvorsichtiger Schritt möglicherweise Schiff Bruch hervorrufen kann. Der Sezierer sollte regelmäßig üben, wie längerer Abwesenheit von der Vorbereitung einer Sezierer Verwechslungsgefahr Schiff Integrität reduziert.
Darüber hinaus ist zusätzliche Auslesen über immunhistochemische (IHC) noch begrenzt, da nur wenige Antikörper validiert auf menschliche und Nagetier Gewebe mit Zebrafisch arbeiten. Experimentatoren interessiert IHC geraten, suchen Zebrafisch-spezifische Antikörper, vor allem bei der Arbeit mit neuen Zielen. Alternativ empfiehlt es sich, zusätzliche Zebrafisch Reporter Linien verwenden die Zellen über das Gefäßsystem in das Auge zu studieren nützlich sind. Diese Strategie ist allerdings zeitaufwendig, da es ein paar Monate dauert zu Erwachsenen Zebrafisch Linien zu erzeugen, die mehrere transgene Reporter tragen.
Der Zebrafisch stellt dennoch eine einzigartige Palette von Vorteilen. Sie sind relativ klein und leicht zu reproduzieren. Sie können zu adulten Stadien schnell wachsen und ihre Embryonen sind optimal für Drogen-Screening. Das Feld wächst leicht und weitere Literatur ist immer zugänglich. Mit der Fähigkeit, gen Knockouts mit einer schnellen Geschwindigkeit und eine Fülle von Transgen Fluoreszenz Reporter Linien zu erzeugen ist die Wahl für Zebrafisch nur durch die gewählte Forschungsfrage zurückhaltend.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Die Autoren möchten Katrin Bennewitz und Marlene Hausner Zebrafisch Tierhaltung und technische Hilfe zu danken. Die Autoren erkennen die Unterstützung der Core Facility Live Cell Imaging Mannheim im Zentrum für Biomedizin und medizinischen Technik Mannheim (DFG INST 91027/9-1). Diese Studie wurde unterstützt durch die Deutsche Forschungsgemeinschaft (International Research Training Group 1874/1 “DIAMICOM” Projekt SP5 und SP9; Collaborative Research Center SFB1118, Projekt B1 und Collaborative Research Center SFB/TR23 Projekt Z5).
Materials
| NaOH | Roth | 6771.3 | |
| KCl | Merck | 1.04936 | |
| CaCl2*6H20 | Roth | 5239.2 | |
| MgSO4*7H20 | Merck | 1.05886.0500 | |
| Paraformaldehyd | Roth | 0335.3 | |
| Sodium dihydrogen phosphate | Roth | 2370.1 | |
| Ethyl 3-aminobenzoate methanesulfonate salt (MS-222,Tricaine) | Sigma | A5040 | |
| PBS | Roth | 9143.1 | |
| Agarose | Roth | 2267.3 | |
| Fluoromount-G | Thermo-Fischer | 00-4958-02 | |
| Petri dish | Greiner Bio one | 633180 | |
| Six-well plate | StarLab | CC7682-7506 | |
| Needle | MSG Praxisbedarf | BD 300900 | |
| Micro Tweezer | World Precision Instruments | 14095 | |
| Microdissection Scissor | World Precision Instruments | 501778 | |
| Glass slide | Carl Roth | H872.1 | |
| Coverslip 22mmx22mm | neoLab | 103512222 | |
| Scalpel | MSG Praxisbedarf | FEA111 | |
| Epi-Illumination | Leica | 10446389 | |
| Fluorescence stereomicroscope MZ10 F | Leica | NA | |
| Confocal laser-scanning microscope SP5 DS | Leica | NA | |
| Stereomicroscope M80 | Leica | NA | |
| Zebrafish line: Tg(fli:EGFP), ABTL wildtype | NA | NA | see Reference 15 |
| Mayer’s hematoxylin | Dr. K. Hollborn & Söhne | 0088663 | |
| 0.5% eosin | Dr. K. Hollborn & Söhne | NA | |
| 99,9% ethanol | Roth | 9065.2 | |
| Paraffin | Merck | 1,071,501,000 | |
| Xylol | Roth | 4436.2 | |
| Acetone | Emsure | 606-001-00-8 | |
| Microtome RM 2165 | Leica | NA |
References
- WHO. . Global report on diabetes. , 88 (2016).
- Lim, A. Diabetic nephropathy – complications and treatment. Int J Nephrol Renovasc Dis. 7, 361-381 (2014).
- Yau, J. W., et al. Global prevalence and major risk factors of diabetic retinopathy. Diabetes Care. 35 (3), 556-564 (2012).
- Cheung, N., Mitchell, P., Wong, T. Y. Diabetic retinopathy. The Lancet. 376 (9735), 124-136 (2010).
- Raymond, N. T., et al. Higher prevalence of retinopathy in diabetic patients of South Asian ethnicity compared with white Europeans in the community: a cross-sectional study. Diabetes Care. 32 (3), 410-415 (2009).
- Heng, L. Z., et al. Diabetic retinopathy: pathogenesis, clinical grading, management and future developments. Diabet Med. 30 (6), 640-650 (2013).
- Writing Committee for the Diabetic Retinopathy Clinical Research, N., et al. Panretinal Photocoagulation vs Intravitreous Ranibizumab for Proliferative Diabetic Retinopathy: A Randomized Clinical Trial. JAMA. 314 (20), 2137-2146 (2015).
- Jao, L. E., Wente, S. R., Chen, W. Efficient multiplex biallelic zebrafish genome editing using a CRISPR nuclease system. Proc Natl Acad Sci U S A. 110 (34), 13904-13909 (2013).
- Sharma, K. R., et al. ELMO1 protects renal structure and ultrafiltration in kidney development and under diabetic conditions. Sci Rep. 6, 37172 (2016).
- Baek, J. S., Fang, L., Li, A. C., Miller, Y. I. Ezetimibe and simvastatin reduce cholesterol levels in zebrafish larvae fed a high-cholesterol diet. Cholesterol. , 564705 (2012).
- Elo, B., Villano, C. M., Govorko, D., White, L. A. Larval zebrafish as a model for glucose metabolism: expression of phosphoenolpyruvate carboxykinase as a marker for exposure to anti-diabetic compounds. J Mol Endocrinol. 38 (4), 433-440 (2007).
- Gut, P., Reischauer, S., Stainier, D. Y. R., Arnaout, R. Little Fish, Big Data: Zebrafish as a Model for Cardiovascular and Metabolic Disease. Physiol Rev. 97 (3), 889-938 (2017).
- Kasprick, D. S., et al. Microanatomy of adult zebrafish extraocular muscles. PLoS One. 6 (11), e27095 (2011).
- Gestri, G., Link, B. A., Neuhauss, S. C. The visual system of zebrafish and its use to model human ocular diseases. Dev Neurobiol. 72 (3), 302-327 (2012).
- Lawson, N. D., Weinstein, B. M. In vivo imaging of embryonic vascular development using transgenic zebrafish. Dev Biol. 248 (2), 307-318 (2002).
- Matthews, M., Varga, Z. M. Anesthesia and euthanasia in zebrafish. ILAR J. 53 (2), 192-204 (2012).
- Bell, B. A., et al. Retinal vasculature of adult zebrafish: in vivo imaging using confocal scanning laser ophthalmoscopy. Exp Eye Res. 129, 107-118 (2014).
- Avanesov, A., Malicki, J. Analysis of the retina in the zebrafish model. Methods Cell Biol. 100, 153-204 (2010).
- Gramage, E., Li, J., Hitchcock, P. The expression and function of midkine in the vertebrate retina. Br J Pharmacol. 171 (4), 913-923 (2014).
- Cao, R., Jensen, L. D., Soll, I., Hauptmann, G., Cao, Y. Hypoxia-induced retinal angiogenesis in zebrafish as a model to study retinopathy. PLoS One. 3 (7), e2748 (2008).
- Jorgens, K., Hillebrands, J. L., Hammes, H. P., Kroll, J. Zebrafish: a model for understanding diabetic complications. Exp Clin Endocrinol Diabetes. 120 (4), 186-187 (2012).
- Alvarez, Y., et al. Predominant cone photoreceptor dysfunction in a hyperglycaemic model of non-proliferative diabetic retinopathy. Dis Model Mech. 3 (3-4), 236-245 (2010).
- Gleeson, M., Connaughton, V., Arneson, L. S. Induction of hyperglycaemia in zebrafish (Danio rerio) leads to morphological changes in the retina. Acta Diabetol. 44 (3), 157-163 (2007).
- Jorgens, K., et al. High tissue glucose alters intersomitic blood vessels in zebrafish via methylglyoxal targeting the VEGF receptor signaling cascade. Diabetes. 64 (1), 213-225 (2015).
- Lai, A. K., Lo, A. C. Animal models of diabetic retinopathy: summary and comparison. J Diabetes Res. 2013, 106594 (2013).

