Introduzione alla titolazione
English
分享
概述
Fonte: Laboratorio del Dr. Yee Nee Tan – Agenzia per la scienza, la tecnologia e la ricerca
La titolazione è una tecnica comune utilizzata per determinare quantitativamente la concentrazione sconosciuta di un analita identificato. 1-4 È anche chiamata analisi volumetrica, poiché la misurazione dei volumi è fondamentale nella titolazione. Esistono molti tipi di titolazioni basate sui tipi di reazioni che sfruttano. I tipi più comuni sono le titolazioni acido-base e le titolazioni redox. 5-11
In un tipico processo di titolazione, una soluzione standard di titolante in una buretta viene gradualmente applicata per reagire con un analita con una concentrazione sconosciuta in un matraccio di Erlenmeyer. Per la titolazione acido-base, un indicatore di pH viene solitamente aggiunto nella soluzione analita per indicare l’endpoint della titolazione. 12 Invece di aggiungere indicatori di pH, il pH può anche essere monitorato utilizzando un pHmetro durante un processo di titolazione e l’endpoint è determinato graficamente da una curva di titolazione del pH. Il volume del titolante registrato all’endpoint può essere utilizzato per calcolare la concentrazione dell’analita in base alla stechiometria di reazione.
Per la titolazione acido-base presentata in questo video, il titolante è una soluzione standardizzata di idrossido di sodio e l’analita è aceto domestico. L’aceto è un liquido acido che viene spesso usato come condimento culinario o aromi. L’aceto è costituito principalmente da acido acetico (CH3COOH) e acqua. Il contenuto di acido acetico dell’aceto commerciale può variare ampiamente e l’obiettivo di questo esperimento è determinare il contenuto di acido acetico dell’aceto commerciale mediante titolazione.
Principles
La determinazione dell’acido acetico nell’aceto si basa sul principio di un metodo di titolazione acido-base. La reazione tra NaOH e CH3COOH è mostrata nell’equazione 1:
CH3COOH(aq) + NaOH(aq) → H2O(l) + NaCH3CO2(aq) (1)
La soluzione standardizzata di NaOH viene progressivamente aggiunta all’aceto con concentrazione sconosciuta di acido acetico fino al raggiungimento del punto finale. Durante la titolazione acido-base, il pH può essere tracciato in funzione del volume del titolante aggiunto. Il punto di inflessione sulla curva, il punto in cui esiste una quantità stechiometrica uguale di acido e base in una soluzione, è chiamato punto di equivalenza. La maggior parte degli acidi e delle basi sono incolori, senza alcuna reazione visibile che si verifica nel punto di equivalenza. Per osservare quando è stato raggiunto il punto di equivalenza, viene aggiunto un indicatore di pH. L’endpoint non è il punto di equivalenza, ma un punto in cui l’indicatore di pH cambia colore. È importante selezionare un indicatore di pH appropriato in modo che il punto finale sia il più vicino possibile al punto di equivalenza della titolazione.
Al punto finale di questa reazione, la base coniugata NaCH3CO2 è leggermente basica. L’indicatore della fenolftaleina ha un intervallo di pH di lavoro di 8,3-10,0, che è incolore in soluzione acida e magenta sopra pH 8,2. Pertanto, la fenolftaleina è un indicatore preferito in quanto cambierà da incolore a rosa in questa condizione. Quando si esegue l’esperimento, è meglio mantenere bassa la concentrazione dell’indicatore di pH perché gli indicatori di pH stessi sono solitamente acidi deboli che reagiscono con la base.
Il volume della soluzione standardizzata di NaOH aggiunta al punto finale può quindi essere utilizzato per calcolare le concentrazioni molari di acido acetico in base alla stechiometria dell’equazione di cui sopra. In questo esperimento, il titolante NaOH è un forte alcalino e l’acido acetico analitico è un acido debole.
Prima di eseguire l’esperimento, è importante considerare la natura igroscopica del NaOH. Questa proprietà richiede che la sua soluzione sia standardizzata con uno standard primario stabile come l’idrogeno ftalato di potassio (KHC8H4O4). L’esatta concentrazione molare della soluzione di NaOH può quindi essere determinata con precisione dopo la standardizzazione. La reazione tra lo standard acido primario e NaOH è mostrata nell’equazione 2:
KHC8H4O4(aq) + NaOH(aq) → H2O(l) + NaKC8H4O4(aq) (2)
Un protocollo di titolazione dettagliato passo-passo è presentato nella sezione seguente.
Procedure
Results
| Unit | Trial 1 | Trial 2 | Trial 3 | |||
| Volume of diluted vinegar acid (VA) | mL | 25.00 | ||||
| Molar concentration of NaOH (cNaOH) | mol/L | 0.09928 | ||||
| Initial burette reading of NaOH | mL | 0.10 | 0. 05 | 1.20 | ||
| Final burette reading of NaOH | mL | 18.75 | 18.60 | 19.80 | ||
| Volume of NaOH dispensed | mL | 18.65 | 18.55 | 18.60 | ||
| Mean volume of NaOH dispensed (Vt) | mL | 18.60 | ||||
Table 1. Titration results.
Sample calculations:
Mass of KC8H5O4 = 4.0754 g
Molar mass of KC8H5O4 = 204.22 g/mol
Number of moles of KC8H5O4 in 25.00 mL standard solution = 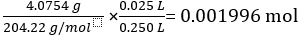
According to Equation 2,
Concentration of the diluted NaOH solution = 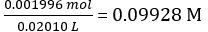
Moles of NaOH dispensed = concentration of NaOH × mean volume of NaOH dispensed = 0.09928 mol/L × 18.60 mL = 1.847 × 10-3 mol
According to Equation 1,
Number of moles of CH3COOH in 25.00 mL of diluted vinegar = 1.847 × 10-3 mol
Concentration of diluted vinegar = 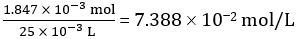
Hence concentration of undiluted vinegar = 10 × 7.388 102 mol/L = 0.7388 mol/L
The above steps are presented to illustrate the calculation procedure; we can simply apply Equation 3 to obtain the concentration of undiluted vinegar in one step.
Therefore 1.000 L of undiluted vinegar contains 0.7388 mol of CH3COOH.
Volume of CH3COOH=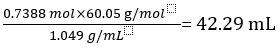
Volume percent of vinegar = 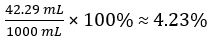
Applications and Summary
Titration is an important chemical method that is frequently applied in current chemistry research. For example, acid base titration is applied to determine amine or hydroxyl value of a sample. The amine value is defined as the number of milligrams of KOH equivalent to the amine content in one gram of sample. To determine the hydroxyl value, the analyte is first acetylated using acetic anhydride then titrated with KOH. The mass in milligrams of KOH then corresponds to hydroxyl groups in one gram of sample.13 Another example is the Winkler test, a specific type of redox titration used to determine the concentration of dissolved oxygen in water for water quality studies. Dissolved oxygen is reduced using manganese(II) sulfate, which then reacts with potassium iodide to produce iodine. Since the iodine released is directly proportional to the oxygen content, the oxygen concentration is determined by titrating iodine with thiosulfate using a starch indicator.14
Besides applications in basic chemical research, titration has also been widely adopted in industrial and everyday use. In biodiesel industry, waste vegetable oil (WVO) must first be neutralized to remove free fatty acids that would normally react to make undesired soap. A portion of WVO is titrated with a base to determine the sample acidity, so the rest of the batch could be properly neutralized.15 Benedict's method, a test for quantification of urine glucose level, is another example showing the importance of titration in healthcare. In this titration, cupric ions are reduced to cuprous ions by glucose, which then react with potassium thiocyanate to form a white precipitate, indicating the endpoint.16
References
- Llc, B. Titration: Ph Indicator, Thermometric Titration, Nonaqueous Titration, Equivalence Point, Acid-Base Titration, Amperometric Titration. General Books LLC, (2010).
- Jacobsen, J. J., Jetzer, K. H., Patani, N., Zweerink, G. & Zimmerman, J. Titration Techniques. J. Chem. Educ. 72, 612, doi:10.1021/ed072p612 (1995).
- Harris, D. C. Quantitative Chemical Analysis. 8th edn, W. H. Freeman, (2010).
- Mattock, G., Taylor, G. R. & Paul, M. A. pH Measurement and Titration. J. Electrochem. Soc. 110, 31C, doi:10.1149/1.2425702 (1963).
- De Levie, R. Aqueous Acid-base Equilibria and Titrations. Oxford University Press, (1999).
- Cannan, R. K. The Acid-Base Titration of Proteins. Chem. Rev. 30, 395-412, doi:10.1021/cr60097a005 (1942).
- Michalowski, T. & Lesiak, A. Acid-Base Titration Curves in Disproportionating Redox Systems. J. Chem. Educ. 71, 632, doi:10.1021/ed071p632 (1994).
- Waser, J. Acid-base Titration and Distribution Curves. J. Chem. Educ. 44, 274, doi:10.1021/ed044p274 (1967).
- Gorbikova, E. A., Vuorilehto, K., Wikström, M. & Verkhovsky, M. I. Redox Titration of All Electron Carriers of Cytochrome c Oxidase by Fourier Transform Infrared Spectroscopy. Biochemistry 45, 5641-5649, doi:10.1021/bi060257v (2006).
- Silverstein, T., Cheng, L. & Allen, J. F. Redox Titration of Multiple Protein Phosphorylations in Pea Chloroplast Thylakoids. Biochim. Biophys. Acta (BBA)-Bioenerg. 1183, 215-220, doi:10.1016/0005-2728(93)90022-8 (1993).
- Lenghor, N., Jakmunee, J., Vilen, M., Sara, R., Christian, G. D. & Grudpan, K. Sequential Injection Redox or Acid-Base Titration for Determination of Ascorbic Acid or Acetic Acid. Talanta 58, 1139-1144, doi:10.1016/S0039-9140(02)00444-7 (2002).
- Mitchell, P., Moyle, J. & Smith, L. Bromthymol Blue as a pH Indicator in Mitochondrial Suspensions. Eur. J. Biochem. 4, 9-19, doi:10.1111/j.1432-1033.1968.tb00166.x (1968).
- Perkins, E. G. Analyses of Fats, Oils and Derivatives. AOCS press, (1993).
- Spellman, F. R. Handbook of Water and Wastewater Treatment Plant Operations. 2 edn, CRC Press, (2009).
- Purcella, G. Do It Yourself Guide to Biodiesel: Your Alternative Fuel Solution for Saving Money, Reducing Oil Dependency, Helping the Planet. Ulysses Press, (2007).
- Nigam. Lab Manual Of Biochemistry. Tata McGraw-Hill Education (2007).
成績單
Titration is a commonly applied method of quantitative chemical analysis used to determine the unknown concentration of a solution. A typical titration is based on a reaction between a titrant and an analyte. The titrant of known concentration is gradually added to a precise volume of an unknown analyte until the reaction reaches an endpoint.
At the endpoint, the moles of titrant and analyte are equal. By manipulating the equation relating volume and concentration, the concentration of analyte can be deduced.
This video will illustrate the principles behind titration, present a protocol to determine the amount of acetic acid in commercial vinegar, and finally explore some common applications of the method.
Titrations are classified based on the type of reaction carried out. For example, redox titrations make use of an oxidation-reduction exchange between reactants which involves the transfer of electrons from one reactant to another. Complexometric titrations rely on the formation of a largely undissociated complex. However, acid-base titrations, which exploit the neutralization of an acid with a base, are one of the most widely studied. To determine the concentration of acid in an analyte, a base, such as sodium hydroxide, is used. Sodium hydroxide is hygroscopic, that is, it has the property of absorbing moisture from the atmosphere. Before it can be used as a titrant, its exact concentration in solution must be standardized.
To do this, it is first titrated with the primary standard, potassium hydrogen phthalate. A primary standard should be pure, stable, non-hygroscopic, and have a high molecular weight. Because the amount of hydronium ions contributed by the primary standard is known to a high degree of accuracy, it is used to determine the exact concentration of the hydroxide ions in the titrant. During an acid-base titration, the pH can be plotted as a function of the volume of the titrant added. The inflection point on the curve, the point at which there is a stoichiometric equal amount of acid and base in a solution, is called the equivalence point.
Most acids and bases are colorless, with no visible reaction occurring at the equivalence point. To observe when the equivalence point has been reached, a pH indicator is added. This is a pH sensitive dye that changes color in different pH environments. Its important to note that endpoint is not equal to the equivalence point, but indicates when a particular pH value has been reached. For example, phenolphthalein changes color around a pH of 8 and is commonly used as an indicator for acid-base titrations with an equivalence point around pH 7. While an accurate indicator for the titration is one that changes color as close to the equivalence point as possible, the titration curve has a steep slope around the equivalence point, leading to an acceptable level of error. At the equivalence point, the moles of base added are equal to the moles of acid initially present. An equation that utilizes the molarity and volume of each component can be used. With the other three values known, the acid concentration can be calculated. Now that you understand the principles behind the procedure, lets take a look at an actual protocol to determine the percent acetic acid in a commercial vinegar sample by reacting it with a standardized sodium hydroxide solution.
Typically, a rough estimate titration is performed to approximate where the endpoint will be. To begin, the titrant, sodium hydroxide, must be standardized. First, dissolve roughly 4 g of sodium hydroxide into 100 mL of deionized water. Make a 1:10 dilution by adding 25 mL of this stock sodium hydroxide solution to a glass container. Bring the total volume to 250 mL with deionized water and shake to mix. As sodium hydroxide absorbs carbon dioxide, it is important to use boiled, deionized water and an oven-dried bottle, and to cap the bottle quickly.
Calculate the approximate molar concentration of sodium hydroxide. Then, weigh out 5 g of the standard acid, potassium hydrogen phthalate, and place it in a drying oven. Once dried, allow the solid to cool to room temperature in a desiccator.
Weigh out 4 g of the dried potassium hydrogen phthalate to a high degree of precision, and dissolve in 250 mL of deionized water. Calculate the molar concentration of the potassium hydrogen phthalate solution.
Using a volumetric pipette, transfer 25 mL of the potassium hydrogen phthalate solution into a clean, dry Erlenmeyer flask. Add 2 drops of phenolphthalein pH indicator. Gently swirl the flask to mix. Flush a clean 50-mL burette with water and rinse at least three times with deionized water. Following this, rinse again with the diluted sodium hydroxide solution three times, making sure that the sodium hydroxide wets the entire inner surface. Mount the washed burette on a ringstand with a clamp and ensure that it stands vertically.
Fill the burette with the diluted sodium hydroxide solution. Air bubbles can affect the accuracy of volumetric readings. Gently tap the burette to free any air bubbles present, and open the stopcock to allow a few mL of titrant to flow through to release any trapped air. Read the volume of sodium hydroxide, at the bottom of the meniscus.
Place the flask containing potassium hydrogen phthalate under the burette. Add the titrant from the burette in 1–2 mL increments using one hand to control the flow rate by adjusting the stopcock, and the other swirling the flask.
When close to the endpoint, begin adding the titrant drop by drop. The endpoint is reached when the solution turns a faint, persistent pink color. Record the volume in the burette.
Repeat the titration at least two more times for consistent data and calculate the molar concentration of the diluted sodium hydroxide solution used as shown in the text protocol.
The sodium hydroxide solution is now standardized and can be used as a titrant to analyze vinegar. To reduce the pungent aroma, dilute 10 mL to a total volume of 100 mL.
Pipette 25 mL of the diluted vinegar into an Erlenmeyer flask, and add 2 drops of phenolphthalein. Fill the burette with the standardized sodium hydroxide solution and record the initial volume. Similar to the previous titration, slowly add the titrant to the analyte in the flask while swirling until the solution turns a light pink color, and record the final volume of sodium hydroxide used.
In this experiment, the titration was performed in triplicate and the mean volume of sodium hydroxide dispensed to neutralize the acetic acid in vinegar was calculated. The concentration and volume of base was used to elucidate the moles of acetic acid in the vinegar. The volume and molar mass were then used to calculate the concentration. It was determined that the vinegar had a molarity of 0.7388. Converting to percent, it was 4.23% acetic acid by volume.
Titrations are robust and easily customizable methods commonly applied in research, industry, and healthcare.
Scientists often use the measure of dissolved oxygen in freshwater bodies as an indicator of overall health that ecosystem. This is done by a redox titration. Unlike acid-base neutralizations, these titrations are based on a reduction-oxidation reaction between the analyte and the titrant. Dissolved oxygen in the water sample is reduced with chemicals in a reaction that results in the production of iodine. The amount of iodine produced and thus the level of dissolved oxygen can be determined by titration using a starch indicator. Glucose in urine can be indicative of a pathological condition like diabetes. A test to quantify urine glucose level, called Benedict’s Method, is another example of the importance of titration; in this case, in healthcare. In this titrimetric procedure, sugars from urine are first reacted with an alkali resulting in the formation of enediols with powerful reducing properties. These reduce copper two ions in Benedict’s reagent to copper one, in a colorimetric reaction that correlates with the initial concentration of glucose present in the urine sample.
You’ve just watched JoVE’s introduction to titration. You should now be familiar with the principles behind this method, know how to perform an acid-base titration, and appreciate some of the ways it is being applied in research and industry.
As always, thanks for watching!
