植物の鉄含有量を測定するための比色定量法
Summary
比色のプルシアン ブルーを用いた植物組織の鉄含有量を測定するための簡潔かつ信頼できるプロトコルを提案します。
Abstract
鉄生体内で最も重要な栄養素の一つは、呼吸や光合成などの基本的なプロセスに関与しています。鉄の含有量は乾燥重量の約 0.009% に相当する植物で、すべての生物で幾分低いです。日付、火炎吸収原子分光学植物組織中の鉄濃度を測定する最も正確な方法の一つです。ただし、この方法は時間がかかり、高価な一般的植物研究所は、特定の機器が必要です。したがって、日常的に使用することができます簡単に、まだ正確な方法が必要です。比色のプルシアン ブルー メソッドは、動物や植物の組織切片の染色質の鉄の定期的に使用されます。本研究では、タバコ中の鉄の定量計測法の葉プルシアン ブルーを適応.原子分光学と同じ試料中の鉄の含有量を測定し、線形回帰を発見する染色プルシアン ブルーの両方を使用してこのメソッドの精度を検証しました (R2 = 0.988) 2 つのプロシージャの間。我々 はプルシアン ブルーの植物組織定量的鉄測定法は正確な単純な安価な結論します。しかし、ここで紹介する線形回帰はサンプルと試薬の潜在的な相互作用のための他の植物種のために適切かもしれない。回帰曲線の確立は別の植物種にしたがって必要です。
Introduction
鉄 (Fe) は、すべての生物に重要な微量栄養素です。植物の呼吸、光合成とクロロフィル生合成などの基本的なプロセスに関与のため必須微量栄養素1についてです。無料鉄多価イオンの高集積植物細胞酸化ストレスを引き起こすフリーラジカルのリリースにつながる反応のために有害です。植物細胞内鉄の恒常性を維持するために、イオンは液胞に格納され、フェリチン、鉄の恒常性2に直接関与するタンパク質ケージおよびすべての生きている有機体の鉄の主要な記憶域構造内で隔離。同時には、鉄欠乏性貧血は、植物鉄 biofortification の増加が必要で、その結果、人間の人口のかなりの割合を影響します。植物フェリチンのユニークな性質上、フェリチン鉄食品濃縮栄養失調3のこの問題を戦うために有望な戦略を提供しています。
鉄イオンは、主に 2 つ酸化状態、すなわち鉄 (2価 Fe2 +または鉄 (II))、鉄 (三価 Fe3 +または鉄 (III)) フォーム。鉄、鉄クラスター4などのいくつかの他の形態はまた細胞であります。Fe はセルと自然フォーム ヘマタイト (Fe2O3) と ferryhidrites 内の酸化鉄として格納されます ((Fe3 +)2O3•0.5 H2O)5生理学的な条件の下で。これらの反応は、特に鉄のフォームに形成された水酸化物非常に低い容解性があります。鉄保持は、pH 56上固体状態で主はその結果、溶液の pH によって影響を受けます。
溶解性が悪い、Fe の高反応性を考慮した植物組織や器官の間での転送が適切なキレート分子と関連付ける必要があります。また、鉄と鉄のフォーム1の間の酸化還元状態を制御する必要があります。葉、内鉄の約 80% は、電子伝達系、チトクローム、葉緑素と他のヘム分子の生合成に重要な役割はそのための光合成細胞で発見され、鉄 S の形成におけるクラスター7。セル内の余分な鉄の場合、黒字はフェリチン分子8金属が保存されている液胞に転流します。
鉄は、いくつかの方法、含む火炎原子吸収分光法9 (FAAS) または比色試金10, 前者は後者よりもはるかに正確な植物組織で測定できます。FAAS は、個々 の要素の電磁放射に基づくサンプルの元素組成を決定することができる精度の高い手法です。FAAS に変換します金属イオン原子状態のサンプルでは、炎加熱による特定イオンの基底状態に戻るときに特定の波長のイオン励起と放射に 。別のイオンからの排出量は、分光器で区切られ、吸収センサー11によって検出されました。したがって、FAAS は直接鉄濃度を定量化する提供しています。しかし、生体組織中の鉄を可視化するための他の手法が利用できます。誘導結合プラズマ質量分析法 (ICP-MS)12は、鉄などの微量要素を測定するための非常に正確な技術、機器、FAAS と ICP-MS の両方の不足が共通問題。その一方で、チオシアン酸測色13による鉄の測定は、精度を欠いている、サンプル間の小さな変化を検出する失敗します。プルシアン ブルー染色14,15,16,17は鉄フェロシアン化カリウム (K4Fe(CN)6) 生産、鉄イオンとの反応に基づく間接法、青い色の強い、動物や植物の組織の組織学的セクションで質的な鉄の検出に使用されます。
金属 (ゼロ原子価) 鉄は、リソスフェアのまれです。環境中の鉄の支配的な非複合イオンの形態は、ほとんど無酸素環境で比較的より豊富である鉄と鉄有酸素サイトの色合いが強い、周囲の酸素の量によって決まります。鉄酸化の原因となるエージェントはしばしば無酸素、酸性環境18で異なるが、この後者の形式、非常に酸性環境で支配的なも。4% で鉄を溶解するとき HCl (pH 0) 好気性環境で、希薄化後の鉄の主要な部分として存在する、鉄 (Fe3 +)19,20を形成します。
鉄イオンと K4Fe(CN)6の反応は次のとおりです。
Fe3 +: した FeCl3 + K4Fe(CN)6 KFe(III)Fe(II)(CN)6̄ + 3KCl =
Fe2 +: 2 K4Fe(CN)6 + 4 のした FeCl2 = 鉄4(Fe(CN)6)2 + 8 KCl
本研究で我々 はプルシアン ブルー染色することができますソリューションの鉄のレベルを測定するために役立つかどうか尋ねた。
当初は、水溶液中の Fe の濃度とプルシアン ブルー染色の相関関係を検証しました。水溶液中で (した FeCl2、した FeCl3または 2 つの 1:1 混合物) として Fe 濃度は、プルシアン ブルーの付加の後で原子分光法と吸光度 (OD) の両方を測定しました。図 1は、それぞれの方法によって得られる測定の線形回帰曲線を示しています。溶液中の鉄濃度の定量分析のためプルシアン ブルーのメソッドを使用できますと結論づけた。
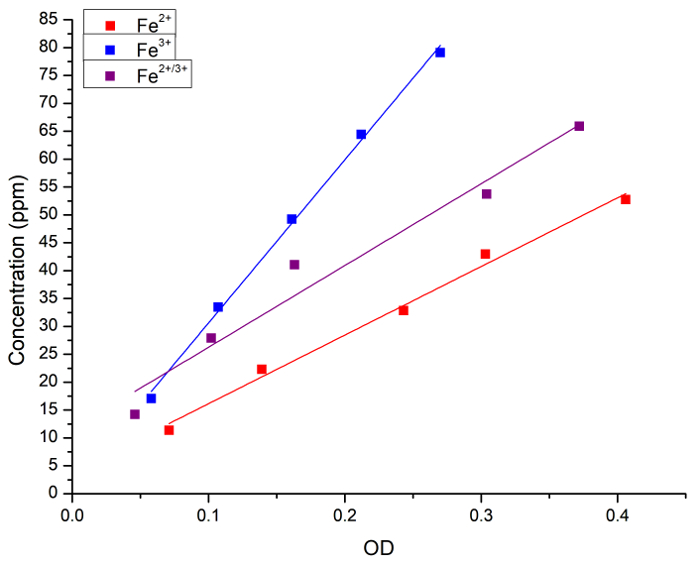
図 1: FAAS と光の吸光度によって測定される Fe 濃度の線形回帰 (OD、715 nm) プルシアン ブルーによる得られた。青い正方形とラインは Fe2 +ソリューションを表す、赤い四角形と線 Fe3 +ソリューションおよび黒い正方形を表しライン Fe2 +と Fe3 +の間の 1:1 混合物。次の回帰が得られた: [Fe2 +] = 3 + 123 x 外径 r 0.996、R2 = = 0.989;[Fe3 +] = 1 + 292 x 外径 r = 0.999、R2 = 0.997;[Fe2 +/3 +] = 11 + 146 x 外径 r = 0.983、R2 = 0.956。Fe2 +ドナーした FeCl2 Fe3 +ドナーした FeCl3であった。この図の拡大版を表示するのにはここをクリックしてください。
比色プルシアン ブルー植物組織の鉄の定量分析法を適応し、火炎吸収原子分光学とプルシアン ブルー染色によりタバコ葉灰の鉄含有量を測定しました。2 つの手法から結果の相関があった。
Protocol
Representative Results
Discussion
植物組織の鉄の測定は、灌漑や他の環境条件の影響を評価するために非常に重要です。ここでは、他の植物種や組織に容易に合わせることができるタバコ葉における Fe コンテンツ測定のための簡単で正確な比色定量法について述べる。
比色法のための条件を最適化する、鉄の溶解性を許可するように低 pH 媒体 (pH < 1.0) を使用しました。書き込み処理を行った鉄のすべて…
Disclosures
The authors have nothing to disclose.
Acknowledgements
この作品は、イスラエル農業 (#16-16-0003) 省の主任研究員からの助成金によってイスラエル省、科学、技術およびスペースによって支えられました。
Materials
| Potassium Hexacyanoferrate(II) | Fisher Chemical | 14459-95-1 | Reagent for the Pussian Blue |
| Millex Syringe Filter Unit, Vial Vent 0.22 μm | Millec | SLGP033RS | Filter used to filter the ashes + 4% HCl Solution |
| Scintillation Vials | Fisherbrand | 03-337-4 | Used to keep the dry powdered plant material during the burning procedure. |
| Disposable Syringe 10 ml | Medi-Plus | 1931 | Syringe used during the filtration |
| Hydrochloric acid | Sigma-Aldrich | 231-595-7 | Used in the 4% HCl solution to dilute the ashes and clean the materials |
| Tobacco, Nicotiana tabacum cv. Samsun NN | Obtained from Prof. Simon Barak and routinely used in the Zaccai Lab | Barak S, Nejidat A, Heimer Y, Volokita M. Transcriptional and posttranscriptional regulation of the glycolate oxidase gene in tobacco seedlings. Plant Molecular Biology. 2001 Mar 1;45(4):399-407. | Tobacco cultivar used in this protocol |
| Glass Wool (Rock Wool) | Sigma-Aldrich | 659997-17-3 | Used in the procedure of burning samples in the furnace. |
References
- Kobayashi, T., Nishizawa, N. K. Iron uptake, translocation, and regulation in higher plants. Annual Review of Plant Biology. 63 (1), 131-152 (2012).
- Bradley, J. M., Le Brun, N. E., Moore, G. R. Ferritins: Furnishing proteins with iron. Journal of Biological Inorganic Chemistry. 21 (1), 13-28 (2012).
- Zielińska-Dawidziak, M. Plant ferritin – a source of iron to prevent its deficiency. Nutrients. 7 (2), 1184-1201 (2015).
- Johnson, D. C., Dean, D. R., Smith, A. D., Johnson, M. K. Structure, function, and formation of biological iron-sulfur clusters. Annual Review of Biochemistry. 74 (1), 247-281 (2015).
- Guo, H., Barnard, A. S. Naturally occurring iron oxide nanoparticles: morphology, surface chemistry and environmental stability. Journal of Materials Chemistry A. 1 (1), 27-42 (2013).
- Hem, J. D., Cropper, W. H. Chemistry of iron in natural water. Report US Geological Survey. , 1-31 (1962).
- Rout, G. R., Sahoo, S. Role of iron in plant growth and metabolism. Reviews in Agricultural Science. 3, 1-24 (2015).
- Speretto, R. A., Ricachenevsky, F. K., Stein, R. J., de Abreu Waldow, V., Fett, J. P. Iron stress in plants Dealing with deprivation and overload. Plant Stress. 4, 57-69 (2010).
- Tautkus, S., Steponeniene, L., Kazlauskas, R. Determination of iron in natural and mineral waters by flame atomic absorption spectrometry. Journal of the Serbian Chemical Society. 69 (5), 393-402 (2006).
- Braunschweig, J., Bosch, J., Heister, K., Kuebeck, C., Meckenstock, R. U. Reevaluation of colorimetric iron determination methods commonly used in geomicrobiology. Journal of Microbiological Methods. 89 (1), 41-48 (2012).
- PerkinElmer. . Atomic Spectroscopy – Guide to Selecting the Appropriate Technique and System. 16, (2011).
- Wachasunder, S. D., Nafade, A. Precision and accuracy control in the determination of heavy metals by atomic absorption spectrometry. Science. 58, 517-528 (2001).
- Woods, J. T., Mellon, M. G. Thiocyanate method for iron. A spectrophotometric study. Industrial & Engineering Chemistry Analytical Edition. 13 (8), 551-554 (1941).
- Perls, M. Nachweis von Eisenoxyd in gewissen Pigmenten. Virchows Archiv Fur Pathologische Anatomie Und Physiologie Und Fur Klinische Medizin. 39 (1), 42-48 (1867).
- Connorton, J. M., Jones, E. R., Rodriguez-Ramiro, I., Fairweather-Tait, S., Uauy, C., Balk, J. Altering expression of a vacuolar iron transporter doubles iron content in white wheat flour. bioRxiv. , 1-25 (2017).
- de la Fuente, V., Rufo, L., Rodríguez, N., Franco, A., Amils, R. Comparison of iron localization in wild plants and hydroponic cultures of Imperata cylindrica (L.) P. Beauv. Plant Soil. 418 (1-2), 25-35 (2017).
- Hsiao, P. Y., Cheng, C. P., Koh, K. W., Chan, M. T. The Arabidopsis defensin gene, AtPDF1.1, mediates defence against Pectobacterium carotovorum subsp. carotovorum via an iron-withholding defence system. Science Reports. 7 (1), 1-14 (2017).
- Johnson, D. B., Kanao, T., Hedrich, S. Redox transformations of iron at extremely low pH: Fundamental and applied aspects. Frontiers in Microbiology. 3, 1-13 (2012).
- Stumm, W., Lee, G. F. Oxygenation of ferrous iron. Industrial & Engineering Chemistry. 53 (2), 143-146 (1961).
- Jones, A. M., Griffin, P. J., Collins, R. N., Waite, T. D. Ferrous iron oxidation under acidic conditions – The effect of ferric oxide surfaces. Geochimica et Cosmochimica Acta. 145, 1-12 (2014).
- Hawkesworth, C. J., Kemp, A. I. S. Evolution of the continental crust. Nature. 443 (7113), (2006).
- Thompson, L. M., Louis, M., Troeh, F. R., Thompson, L. M. . Soils and soil fertility. , (1973).
- Krueger, B. J., Grassian, V. H., Cowin, J. P., Laskin, A. Heterogeneous chemistry of individual mineral dust particles from different dust source regions: The importance of particle mineralogy. Atmospheric Environment. 38 (36), 6253-6261 (2004).
- Bewick, V., Cheek, L., Ball, J. Statistics review 7: Correlation and regression. Journal of Critical Care. 7 (6), 451-459 (2003).
- Asuero, A. G., Sayago, A., González, A. G. The correlation coefficient: An overview. Critical Reviews in Analytical Chemistry. 36 (1), 41-59 (2006).
- . Analytical Chemistry. Calibration Curves Available from: https://www.jove.com/science-education/10188/calibration-curves (2018)

