Summary
Apresentado aqui é um protocolo para avaliar quantitativamente a injeção de um material através de um sistema de agulha de seringa usando uma plataforma de teste mecânico padrão.
Abstract
Biomateriais injetáveis estão se tornando cada vez mais populares para a entrega minimamente invasiva de drogas e células. Esses materiais são tipicamente mais viscosos do que as injeções aquosas tradicionais e podem ser semissólidos, portanto, sua injebilidade não pode ser assumida. Este protocolo descreve um método para avaliar objetivamente a injecência desses materiais usando um testador mecânico padrão. O êmbolo da seringa é comprimido pela cabeça cruzada a uma taxa definida, e a força é medida. O valor máximo ou de força do planalto pode então ser usado para comparação entre amostras, ou para um limite de força absoluta. Este protocolo pode ser usado com qualquer material, e qualquer seringa e tamanho de agulha ou geometria. Os resultados obtidos podem ser usados para tomar decisões sobre formulações, seringas e tamanhos de agulha no início do processo translacional. Além disso, os efeitos da alteração das formulações sobre a injeção podem ser quantificados, e o tempo ideal para injetar materiais de mudança temporal determinados. Este método também é adequado como uma forma reprodutível de examinar os efeitos da injeção em um material, para estudar fenômenos como auto-cura e filtrar prensagem ou estudar os efeitos da injeção nas células. Este protocolo é mais rápido e diretamente aplicável à injetabilidade do que a reologia rotacional, e requer um processo mínimo pós-processamento para obter valores-chave para comparações diretas.
Introduction
Os biomaterias são frequentemente estudados e utilizados como andaimes para regeneração tecidual baseada em células e depósitos para entrega direcionada e sustentada de terapêutica1. Nesse campo, os biomateriais injetáveis estão crescendo em popularidade, pois são minimamente invasivos, o que reduz o risco de infecção, dor e cicatrizes associadas à implantação2. Além disso, como geralmente são aplicados como fluidos, eles se conformam perfeitamente com defeitos teciduais, e drogas e células podem ser misturadas neles imediatamente antes da aplicação3,4,5. Como tal, enquanto os biomateriais injetáveis podem ser fabricados como seringas pré-carregadas, eles são frequentemente preparados por médicos diretamente antes da aplicação. Por exemplo, os cimentos começam a definir uma vez que as fases de pó e líquido são misturadas, e por isso não podem ser armazenados por longos períodos antes do uso6. A caracterização desses materiais é, portanto, dependente do tempo e indissociável mente ligada à sua preparação.
Os biomateriais injetáveis comuns incluem cimentos de cálcio, metacrilato de polimetila, bioglasses e vários hidrogéis poliméricos3,7. Ao contrário das injeções tradicionais de drogas, que têm as mesmas propriedades reológicas que a água, esses biomateriais injetáveis são tipicamente mais viscosos, não newtonianos, podem ter algum caráter elástico, e também podem mudar com o tempo. Portanto, a injebilidade desses materiais não pode ser assumida, mas deve ser avaliada experimentalmente. Ao quantificar a força necessária para a injeção e correlacioná-la à facilidade da injeção, as decisões iniciais sobre quais formulações biomateriais, seringas e tamanhos de agulha para levar adiante podem ser tomadas no início do processo de desenvolvimento8. Tais experimentos também podem quantificar os efeitos da mudança de formulações na injeção9.
Existem vários métodos para avaliar as propriedades dos materiais injetáveis. A reologia rotacional é frequentemente utilizada para avaliar a viscosidade, o comportamento não newtoniano, a recuperação pós-tesoura, o tempo de configuração e outras propriedades desses materiais10,11,12. Embora este tipo de teste seja útil para estabelecer propriedades fundamentais dos materiais, essas propriedades não se correlacionam diretamente com a injeçãobilidade. Para um fluido newtoniano e seringa cilíndrica e agulha, a força de injeção pode ser estimada a partir de uma forma da equação Hagen-Poiseuille13:
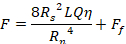
Onde F é a força necessária para a injeção (N), Rs é o raio de seringa interna (m), Rn é o raio da agulha interna (m), L é o comprimento da agulha (m), Q é taxa de fluxo de fluido (m3 s-1),η é a viscosidade dinâmica (Pa.s) e Ff é a força de atrito entre o êmbolo e a parede do barril (N). Assim, se a viscosidade for medida via reologia rotacional, as dimensões da seringa e da agulha são conhecidas e a taxa de fluxo estimada, a força de injeção pode ser estimada. No entanto, esta equação não explica a extremidade cônica da seringa ou quaisquer outras geometrias, como tomadas fora do centro, e Ffdeve ser estimada ou encontrada experimentalmente por testes mecânicos. Além disso, os biomateriais normalmente não são newtonianos, mas exibem propriedades reológicas complexas. Para um simples fluido de afinamento de tesoura, a equação torna-se14:
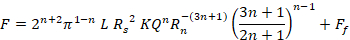
Onde n está o índice de potência (-) e K é o índice de consistência (Pa.sn) da expressão Ostwald de Waele: , onde está a taxa 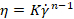 de
de 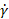 cisalhamento (s-1). A complexidade aumenta consideravelmente para materiais cujas propriedades reológicas não podem ser caracterizadas por dois valores, e particularmente para materiais dependentes do tempo, como a fixação de cimentos. Além disso, se as propriedades do material forem dependentes da tesoura, o material deve ser testado na taxa de corte esperada na agulha, que pode exceder em muito a faixa de um reômetro rotacional15.
cisalhamento (s-1). A complexidade aumenta consideravelmente para materiais cujas propriedades reológicas não podem ser caracterizadas por dois valores, e particularmente para materiais dependentes do tempo, como a fixação de cimentos. Além disso, se as propriedades do material forem dependentes da tesoura, o material deve ser testado na taxa de corte esperada na agulha, que pode exceder em muito a faixa de um reômetro rotacional15.
Outro método quantitativo para medir a injeção envolve a fixação de sensores de pressão e deslocamento a uma seringa durante a realização de uma injeção, seja à mão ou usando uma bomba de seringa. Este equipamento é relativamente barato, no entanto, exige que os usuários gerem scripts e curvas de calibração para converter em dados de força16. Além disso, uma bomba de seringa pode não possuir torque suficiente para comprimir o êmbolo a uma taxa precisa se forem necessárias forças altas para extrusão de materiais viscosos ou semissólidos. Alternativamente, utilizar esses sensores ao injetar à mão pode ser útil, pois eles podem ser usados em um cenário clínico real, durante os procedimentos clínicos17. No entanto, isso levará muito mais tempo e pode introduzir viés de usuário, e, portanto, precisará de um número maior de repetições com diferentes usuários para obter resultados confiáveis. Isso pode, portanto, ser mais apropriado para materiais que estão mais abaixo do pipeline translacional, ou produtos já em uso clínico.
Neste protocolo, um testador mecânico é usado para comprimir o êmbolo a uma taxa definida, e medir a força necessária para fazê-lo. Este tipo de testador mecânico é comum em laboratórios de materiais e tem sido usado para quantificar a injeção para vários biomateriais18,19,20,21,22,23,24. Este teste pode ser usado com qualquer tamanho e geometria de seringa e agulha, contendo qualquer material. Além disso, no caso de biomateriais que são feitos imediatamente antes do uso, o procedimento exato de formulação que seria utilizado na clínica ou cirurgia pode ser seguido antes do teste. Outra vantagem deste procedimento é que ele é relativamente rápido; uma vez configurado o testador mecânico, dezenas de amostras podem ser estudadas em uma hora, dependendo da velocidade de extrusão e do volume da seringa. Isso contrasta com a reologia rotacional, que normalmente leva pelo menos 5 a 10 minutos por teste, além de tempo de carga, equilíbrio e limpeza. O uso de um testador mecânico produz uma taxa de extrusão confiável igualmente sobre o êmbolo, o que é particularmente vantajoso para formulações viscosas ou aquelas com propriedades dependentes do tempo. Após o teste, é necessário um mínimo pós-processamento de dados para extrair valores importantes para comparações objetivas.
Protocol
Representative Results
Discussion
Testes mecânicos são talvez a maneira mais simples e confiável de quantificar a injeção. Uma das principais vantagens deste protocolo é que não é necessário nenhum equipamento especial, além do testador mecânico, o que é comum em laboratórios de materiais. Este protocolo é altamente versátil; qualquer material, medidor de agulha e tamanho da seringa pode ser usado, desde que a seringa possa ser acomodada pelos grampos. Isso foi verificado neste protocolo para seringas de até 10 mL. Além disso, o material pode ser preparado exatamente como seria para a aplicação do mundo real25. Finalmente, este procedimento é muito rápido, levando apenas até alguns minutos por amostra, permitindo que dezenas de amostras sejam processadas por hora.
Para amostras que dão curvas típicas, dois valores podem ser extraídos: a força máxima e as curvas de força do planalto. A força máxima é indiscutivelmente mais objetiva e pode ser extraída computacionalmente da tabela de dados para cada amostra. Por outro lado, a força do planalto pode ser mais representativa, pois esta será a força experimentada pela maior quantidade de tempo e, como média, é menos afetada por curvas com grandes flutuações. Essas flutuações podem ser causadas por bolhas de ar ou partículas no material que causam alterações intermitentes à medida que são extrudadas, ou por baixa precisão de instrumentos para medições de pequenas forças. No entanto, é notável que, para muitas amostras, não há pico de força máxima, e por isso o valor máximo e planalto são os mesmos. Comparações objetivas entre forças de injeção podem ser feitas desde que um valor consistente seja usado.
Os dados obtidos podem ser usados de várias maneiras. Os valores da força de injeção podem ser comparados à facilidade de injeção, para estabelecer quais formulações, seringas e tamanhos de agulha são viáveis para tradução8. Alternativamente, a comparação entre as amostras permite a quantificação de alterações nas formulações sobre a injeção. Por exemplo, nos cimentos, alterar a viscosidade da fase líquida, a distribuição do tamanho das partículas e adicionar aditivos como citrato para alterar as propriedades coloidais, podem ter grandes alterações na injebilidade9. Esses testes também podem informar o protocolo de formulação de cimentos, por exemplo, tempo de mistura, tempo de carregamento e tempo de aplicação, para ótima injeção e desempenho pós-injeção. Além disso, este método pode ser usado para testar a viabilidade inicial de novos bioinks para impressão 3D.
Este protocolo pode ser modificado de várias maneiras. O sistema de grampos pode ser substituído por uma construção impressa 3D sob medida para segurar a seringa, o que pode facilitar a garantia de que a seringa e o êmbolo sejam perpendiculares à cabeça-de-cruz, e a seringa seja mantida com segurança. A agulha pode ser substituída por uma cânula ou qualquer dispositivo que extrude o material por compressão de um êmbolo e pode ser de qualquer tamanho e geometria. A fim de aumentar a fidelidade dos resultados, a ponta da agulha pode ser colocada em um tecido ou hidrogel, a fim de simular com mais precisão a injeção clínica. No entanto, isso adiciona mais complexidades ao protocolo, já que a composição do tecido/gel e a profundidade da agulha devem ser mantidas constantes. Além disso, este protocolo utiliza extrusão controlada por deslocamento, para medir a força necessária para injetar na velocidade especificada. Alternativamente, a força de injeção pode ser especificada, e a quantidade de extrusão pode ser medida contra o tempo. Isso pode ser útil para materiais com propriedades dependentes do tempo, como cimentos. Por exemplo, usando uma correlação entre a força de injeção e a facilidade de injeção para selecionar uma força8,este protocolo pode ser usado para estabelecer se todo o volume de cimento pode ser injetado com essa velocidade antes da configuração. Finalmente, este protocolo pode ser facilmente combinado com outros experimentos, a fim de testar o efeito da injeção nas propriedades do material e examinar fenômenos como prensagem de filtros e auto-cura, ou o efeito da injeção nas células.
A principal limitação deste protocolo é que um testador mecânico universal é necessário. Embora estes sejam comuns em laboratórios de testes de materiais, eles são caros de comprar se o usuário não puder acessar um. Além disso, o testador mecânico fornece compressão uniaxial em uma força definida ou taxa de deslocamento, enquanto a força aplicada e a velocidade de injeção podem variar ao longo da injeção manualmente. Este protocolo também é inadequado para replicar algumas injeções do mundo real, como injeções em tecidos complexos no teatro, ou injetar em diferentes ângulos. Para quantificar a força da injeção na clínica, transdutores de força e deslocamento podem ser um método melhor.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este trabalho foi financiado pelo CDT EPSRC para Engenharia de Formulação na Escola de Engenharia Química da Universidade de Birmingham, Reino Unido, referência de Grant EP/L015153/1, e pelo Royal Centre for Defense Medicine.
Materials
| Alginic Acid Sodium Salt | Sigma | A2033-100G | |
| Blunt Needles | Needlez | NB19G1.5 | Any size may be used, depending on application |
| Calcium Sulphate Hemihydrate | Acros Organics | 22441.296 | |
| Clamp stand | Eisco | MTST5 | Two required |
| Clamps | R&L Enterprises | 41 | Two required, should have flat tops |
| Syringes | BD | 307731 | Any size can be used, depending on application |
| Universal Mechanical Tester | Zwick Roell | Z030 |
References
- Webber, M. J., Appel, E. A., Meijer, E. W., Langer, R. Supramolecular biomaterials. Nature Materials. 15, 13-26 (2015).
- Mathew, A. P., Uthaman, S., Cho, K. -. H., Cho, C. -. S., Park, I. -. K. Injectable hydrogels for delivering biotherapeutic molecules. International Journal of Biological Macromolecules. 110, 17-29 (2018).
- Zhou, H., et al. Injectable biomaterials for translational medicine. Materials Today. 28, 81-97 (2019).
- Alves, H. L. R., dos Santos, L. A., Bergmann, C. P. Injectability evaluation of tricalcium phosphate bone cement. Journal of Materials Science: Materials in Medicine. 19, 2241-2246 (2008).
- Yu, L., Ding, J. Injectable hydrogels as unique biomedical materials. Chemical Society Reviews. 37, 1473 (2008).
- Pawelec, K. M., Planell, J. A. . Bone Repair Biomaterials: Regeneration and Clinical Applications. , (2019).
- Fernandez de Grado, G., et al. Bone substitutes: a review of their characteristics, clinical use, and perspectives for large bone defects management. Journal of Tissue Engineering. 9, 204173141877681 (2018).
- Robinson, T. E., et al. Filling the Gap: A Correlation between Objective and Subjective Measures of Injectability. Advanced Healthcare Materials. , 1901521 (2020).
- O’Neill, R., et al. Critical review: Injectability of calcium phosphate pastes and cements. Acta Biomaterialia. 50, 1-19 (2017).
- Gantar, A., et al. Injectable and self-healing dynamic hydrogel containing bioactive glass nanoparticles as a potential biomaterial for bone regeneration. RSC Advances. 6, 69156-69166 (2016).
- Ramin, M. A., Latxague, L., Sindhu, K. R., Chassande, O., Barthélémy, P. Low molecular weight hydrogels derived from urea based-bolaamphiphiles as new injectable biomaterials. Biomaterials. 145, 72-80 (2017).
- Ren, K., He, C., Xiao, C., Li, G., Chen, X. Injectable glycopolypeptide hydrogels as biomimetic scaffolds for tissue engineering. Biomaterials. 51, 238-249 (2015).
- Burckbuchler, V., et al. Rheological and syringeability properties of highly concentrated human polyclonal immunoglobulin solutions. European Journal of Pharmaceutics and Biopharmaceutics. 76, 351-356 (2010).
- Allmendinger, A., et al. Rheological characterization and injection forces of concentrated protein formulations: An alternative predictive model for non-Newtonian solutions. European Journal of Pharmaceutics and Biopharmaceutics. 87, 318-328 (2014).
- Davison, P. F. The Effect of Hydrodynamic Shear on the Deoxyribonucleic Acid from T2 and T4 Bacteriophages. Proceedings of the National Academy of Sciences of the United States of America. 45, 1560-1568 (1959).
- Chen, M. H., et al. Methods to Assess Shear-Thinning Hydrogels for Application As Injectable Biomaterials. ACS Biomaterials Science and Engineering. 3, 3146-3160 (2017).
- Krebs, J., et al. Clinical measurements of cement injection pressure during vertebroplasty. Spine. 30, (2005).
- Bohner, M., Baroud, G. Injectability of calcium phosphate pastes. Biomaterials. 26, 1553-1563 (2005).
- Gbureck, U., Barralet, J. E., Spatz, K., Grover, L. M., Thull, R. Ionic Modification of Calcium Phosphate Cement Viscosity. Part I: Hypodermic Injection and Strength Improvement of Apatite Cement. Biomaterials. 25, 2187-2195 (2004).
- Habib, M., Baroud, G., Galea, L., Bohner, M. Evaluation of the ultrasonication process for injectability of hydraulic calcium phosphate pastes. Acta Biomaterialia. 8, 1164-1168 (2012).
- Martin, B. C., Minner, E. J., Wiseman, S. L., Klank, R. L., Gilbert, R. J. Agarose and methylcellulose hydrogel blends for nerve regeneration applications. Journal of Neural Engineering. 5, 221-231 (2008).
- Borzacchiello, A., Russo, L., Malle, B. M., Schwach-Abdellaoui, K., Ambrosio, L. Hyaluronic Acid Based Hydrogels for Regenerative Medicine Applications. BioMed Research International. 2015, 871218 (2015).
- Zhao, L., Weir, M. D., Xu, H. H. K. An injectable calcium phosphate-alginate hydrogel-umbilical cord mesenchymal stem cell paste for bone tissue engineering. Biomaterials. 31, 6502-6510 (2010).
- Ji, D. -. Y., Kuo, T. -. F., Wu, H. -. D., Yang, J. -. C., Lee, S. -. Y. A novel injectable chitosan/polyglutamate polyelectrolyte complex hydrogel with hydroxyapatite for soft-tissue augmentation. Carbohydrate Polymers. 89, 1123-1130 (2012).
- Vaishya, R., Chauhan, M., Vaish, A. Bone cement. Journal of Clinical Orthopaedics and Trauma. 4, 157-163 (2013).

