La quantificazione dell'iniettabilità mediante prove meccaniche
Summary
Qui è presentato un protocollo per valutare quantitativamente l’iniettabilità di un materiale attraverso un sistema di aghi per siringhe utilizzando un banco di prova meccanico standard.
Abstract
I biomateriali iniettabili stanno diventando sempre più popolari per la somministrazione minimamente invasiva di farmaci e cellule. Questi materiali sono tipicamente più viscosi delle tradizionali iniezioni acquose e possono essere semi-solidi, quindi la loro iniettabilità non può essere assunta. Questo protocollo descrive un metodo per valutare oggettivamente l’iniettabilità di questi materiali utilizzando un tester meccanico standard. Lo stantuffo della siringa viene compresso dalla traversa a una velocità prestabilita e la forza viene misurata. Il valore di forza massima o plateau può quindi essere utilizzato per il confronto tra campioni o per un limite di forza assoluto. Questo protocollo può essere utilizzato con qualsiasi materiale e qualsiasi dimensione o geometria di siringa e ago. I risultati ottenuti possono essere utilizzati per prendere decisioni su formulazioni, dimensioni di siringhe e aghi all’inizio del processo traslizionale. Inoltre, possono essere quantificati gli effetti dell’alterazione delle formulazioni sull’iniettabilità e determinare il tempo ottimale per iniettare materiali che cambiano temporaneamente. Questo metodo è adatto anche come modo riproducibile per esaminare gli effetti dell’iniezione su un materiale, per studiare fenomeni come l’autoguarigione e la pressatura del filtro o studiare gli effetti dell’iniezione sulle cellule. Questo protocollo è più veloce e più direttamente applicabile all’iniettabilità rispetto alla reologia rotazionale e richiede una post-elaborazione minima per ottenere valori chiave per i confronti diretti.
Introduction
I biomateriali sono spesso studiati e utilizzati come impalcature per la rigenerazione dei tessuti a base cellulare e depositi per la somministrazione mirata e sostenuta di terapie1. All’interno di questo campo, i biomateriali iniettabili stanno crescendo in popolarità in quanto sono minimamente invasivi, il che riduce il rischio di infezione, dolore e cicatrici associate all’impianto2. Inoltre, poiché di solito vengono applicati come fluidi, si conformano perfettamente ai difetti tissutali e farmaci e cellule possono essere mescolati in essi immediatamente primadell’applicazione 3,4,5. Pertanto, mentre i biomateriali iniettabili possono essere fabbricati come siringhe precaricate, sono spesso preparati dai medici direttamente prima dell’applicazione. Ad esempio, i cementi iniziano a essere impostati una volta mescolate le fasi polvere e liquido e quindi non possono essere conservati per lunghi periodi primadell’uso 6. La caratterizzazione di questi materiali dipende quindi dal tempo e indissolubilmente legata alla loro preparazione.
I comuni biomateriali iniettabili includono cementi di calcio, metacrilato di polimetile, biosessi e vari idrogel polimerici3,7. A differenza delle iniezioni tradizionali di farmaci, che hanno le stesse proprietà reologiche dell’acqua, questi biomateriali iniettabili sono tipicamente più viscosi, non newtoniani, possono avere un certo carattere elastico e possono anche cambiare nel tempo. Pertanto, l’iniettabilità di questi materiali non può essere assunta, ma deve essere valutata sperimentalmente. Quantificando la forza necessaria per l’iniezione e correlandla alla facilità di iniezione, le prime decisioni su quali formulazioni di biomateriali, siringa e dimensioni dell’ago portare avanti possono essere prese all’inizio del processo di sviluppo8. Tali esperimenti possono anche quantificare gli effetti del cambiamento delle formulazioni sull’iniettabilità9.
Esistono diversi metodi per valutare le proprietà dei materiali iniettabili. La reologia rotazionale viene spesso utilizzata per valutare la viscosità, il comportamento non newtoniano, il recupero post-taglio, il tempo di impostazione e altreproprietà di questi materiali 10,11,12. Sebbene questo tipo di test sia utile per stabilire proprietà fondamentali dei materiali, queste proprietà non sono direttamente correlate all’iniettabilità. Per un fluido newtoniano e una siringa cilindrica e un ago, la forza di iniezione può essere stimata da una forma dell’equazione di Hagen-Poiseuille13:
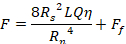
Dove F è la forza richiesta per l’iniezione (N), R s è il raggio interno della siringa (m), R nè il raggio interno dell’ago (m), L è la lunghezza dell’ago (m), Q è la portata del fluido (m3 s-1), η è la viscosità dinamica (Pa.s) e F f èla forza di attrito tra lo stantuffo e la parete della canna (N). Pertanto, se la viscosità viene misurata tramite reologia rotazionale, le dimensioni della siringa e dell’ago sono note e la portata stimata, la forza di iniezione può essere stimata. Tuttavia, questa equazione non tiene conto dell’estremità conica della siringa o di altre geometrie, come le prese fuori centro, e Ff deveessere stimato o trovato sperimentalmente mediante prove meccaniche. Inoltre, i biomateriali non sono tipicamente newtoniani, ma mostrano proprietà reologiche complesse. Per un semplice fluido di assottigliamento a taglio, l’equazionediventa 14:
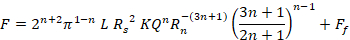
Dove n è l’indice di potenza (-) e K è l’indice di coerenza (Pa.sn) dall’espressione di Ostwald de Waele: , dove è la velocità di 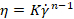 taglio
taglio 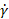 (s-1). La complessità aumenta notevolmente per i materiali le cui proprietà reologiche non possono essere caratterizzate da due valori, e in particolare per i materiali dipendenti dal tempo come l’impostazione dei cementi. Inoltre, se le proprietà del materiale dipendono dalla cesoia, il materiale deve essere testato alla velocità di taglio prevista nell’ago, che può superare di gran lunga l’intervallo di un reometro rotazionale15.
(s-1). La complessità aumenta notevolmente per i materiali le cui proprietà reologiche non possono essere caratterizzate da due valori, e in particolare per i materiali dipendenti dal tempo come l’impostazione dei cementi. Inoltre, se le proprietà del materiale dipendono dalla cesoia, il materiale deve essere testato alla velocità di taglio prevista nell’ago, che può superare di gran lunga l’intervallo di un reometro rotazionale15.
Un altro metodo quantitativo per misurare l’iniettabilità consiste nel collegare sensori di pressione e spostamento a una siringa durante l’esecuzione di un’iniezione, a mano o utilizzando una pompa per siringhe. Questa apparecchiatura è relativamente economica, tuttavia, richiede agli utenti di generare script e curve di calibrazione per convertire in forza i dati16. Inoltre, una pompa per siringhe potrebbe non possedere una coppia sufficiente per comprimere lo stantuffo a una velocità precisa se sono necessarie forze elevate per estrudere materiali viscosi o semi-solidi. In alternativa, l’utilizzo di questi sensori durante l’iniezione a mano può essere utile in quanto possono essere utilizzati in uno scenario clinico reale, durante le procedurecliniche 17. Tuttavia, ciò richiederà molto più tempo e potrebbe introdurre pregiudizi da parte degli utenti e, pertanto, avrà bisogno di un numero maggiore di ripetizioni con utenti diversi per ottenere risultati affidabili. Questo può, quindi, essere più appropriato per i materiali che si trovano più in basso nella pipeline traslizionale o per i prodotti già in uso clinico.
In questo protocollo, un tester meccanico viene utilizzato per comprimere lo stantuffo a una velocità prestabilita e misurare la forza necessaria per farlo. Questo tipo di tester meccanico è comune nei laboratori dei materiali ed è stato utilizzato per quantificare l’iniettabilità per vari biomateriali18,19,20,21,22,23,24. Questo test può essere utilizzato con qualsiasi dimensione e geometria di siringa e ago, contenente qualsiasi materiale. Inoltre, nel caso di biomateriali che vengono realizzati immediatamente prima dell’uso, la procedura di formulazione esatta che sarebbe stata utilizzata in clinica o in chirurgia può essere seguita prima del test. Un ulteriore vantaggio di questa procedura è che è relativamente veloce; una volta impostato il tester meccanico, decine di campioni possono essere studiati in un’ora, a seconda della velocità di estrusione e del volume della siringa. Questo è in contrasto con la reologia rotazionale, che in genere richiede almeno 5 – 10 minuti per test, oltre a tempo di caricamento, equilibrazione e pulizia. L’utilizzo di un tester meccanico produce un tasso di estrusione affidabile equamente rispetto allo stantuffo, il che è particolarmente vantaggioso per le formulazioni viscose o quelle con proprietà dipendenti dal tempo. Dopo i test, è necessaria una post-elaborazione minima dei dati per estrarre valori importanti per confronti oggettivi.
Protocol
Representative Results
Discussion
I test meccanici sono forse il modo più semplice e affidabile per quantificare l’iniettabilità. Un vantaggio fondamentale di questo protocollo è che non è richiesta alcuna attrezzatura speciale, a parte il tester meccanico, che è comune nei laboratori di materiali. Questo protocollo è altamente versatile; è possibile utilizzare qualsiasi materiale, misuratore di ago e dimensione della siringa, a condizione che la siringa possa essere alloggiata dai morsetti. Questo è stato verificato in questo protocollo per siringhe fino a 10 ml. Inoltre, il materiale può essere preparato esattamente come farebbe per l’applicazione del mondo reale25. Infine, questa procedura è molto veloce, prendendo solo fino a pochi minuti per campione, consentendo l’elaborazione di decine di campioni all’ora.
Per i campioni che forniscono curve tipiche, è possibile estrarre due valori: la forza massima e le curve di forza del plateau. La forza massima è probabilmente più oggettiva e può essere estratta computazalmente dalla tabella dati per ogni campione. Al contrario, la forza dell’altopiano può essere più rappresentativa, in quanto questa sarà la forza sperimentata per la maggior quantità di tempo e, come media, è meno influenzata da curve con grandi fluttuazioni. Queste fluttuazioni possono essere causate da bolle d’aria o particelle nel materiale che causano cambiamenti intermittenti man mano che vengono estruse, o da una bassa precisione dello strumento per piccole misurazioni della forza. Tuttavia, è notevole che, per molti campioni, non ci sia un picco massimo di forza, e quindi il valore massimo e plateau sono gli stessi. I confronti oggettivi tra le forze di iniezione possono essere effettuati purché venga utilizzato un valore coerente.
I dati ottenuti possono essere utilizzati in diversi modi. I valori della forza di iniettabilità possono essere confrontati con la facilità di iniezione, per stabilire quali formulazioni, siringhe e aghi sono praticabili per la traduzione8. In alternativa, il confronto tra campioni consente la quantificazione delle modifiche alle formulazioni sull’iniettabilità. Ad esempio, nei cementi, cambiare la viscosità della fase liquida, la distribuzione delle dimensioni delle particelle e aggiungere additivi come il citrato per alterare le proprietà colloidali, può avere grandi cambiamenti nell’iniettabilità9. Questi test possono anche informare il protocollo di formulazione per i cementi, ad esempio il tempo di miscelazione, il tempo di caricamento e il tempo di applicazione, per prestazioni ottimali di iniezione e post-iniezione. Inoltre, questo metodo può essere utilizzato per testare la fattibilità iniziale di nuovi bioinchiostri per la stampa 3D.
Questo protocollo può essere modificato in diversi modi. Il sistema di morsetto può essere sostituito con un costrutto stampato in 3D su misura per contenere la siringa, il che può rendere più facile garantire che la siringa e lo stantuffo siano perpendicolari alla traversa e che la siringa sia tenuta saldamente. L’ago può essere sostituito con una cannula o qualsiasi dispositivo che estrude il materiale per compressione di uno stantuffo e può essere di qualsiasi dimensione e geometria. Al fine di aumentare la fedeltà dei risultati, la punta dell’ago può essere posizionata in un tessuto o in un idrogel, al fine di simulare più accuratamente l’iniezione clinica. Tuttavia, ciò aggiunge ulteriori complessità al protocollo, poiché la composizione dei tessuti / gel e la profondità dell’ago devono essere mantenute costanti. Inoltre, questo protocollo utilizza l’estrusione controllata dallo spostamento, per misurare la forza necessaria per iniettare alla velocità specificata. In alternativa, è possibile specificare la forza di iniezione e misurare la quantità di estrusione rispetto al tempo. Questo può essere utile per materiali con proprietà dipendenti dal tempo, come i cementi. Ad esempio, utilizzando una correlazione tra forza di iniezione e facilità di iniettabilità per selezionare una forza8, questo protocollo può essere utilizzato per stabilire se l’intero volume di cemento può essere iniettato con questa velocità prima dell’impostazione. Infine, questo protocollo può essere facilmente combinato con altri esperimenti, al fine di testare l’effetto dell’iniezione sulle proprietà del materiale ed esaminare fenomeni come la pressatura del filtro e l’autoguarigione, o l’effetto dell’iniezione sulle cellule.
La limitazione principale di questo protocollo è che è necessario un tester meccanico universale. Sebbene questi siano comuni nei laboratori di test dei materiali, sono costosi da acquistare se l’utente non può accedervi. Inoltre, il tester meccanico fornisce una compressione uniassiale a una forza impostata o a una velocità di spostamento, mentre la forza applicata e la velocità di iniezione possono variare nel corso dell’iniezione a mano. Questo protocollo non è adatto anche per replicare alcune iniezioni del mondo reale, come iniezioni in tessuti complessi in teatro o iniettare da diverse angolazioni. Per quantificare la forza di iniezione in clinica, i trasduttori di forza e spostamento possono essere un metodo migliore.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Questo lavoro è stato finanziato dall’EPSRC CDT for Formulation Engineering presso la School of Chemical Engineering dell’Università di Birmingham, Regno Unito, Grant reference EP/L015153/1 e dal Royal Centre for Defence Medicine.
Materials
| Alginic Acid Sodium Salt | Sigma | A2033-100G | |
| Blunt Needles | Needlez | NB19G1.5 | Any size may be used, depending on application |
| Calcium Sulphate Hemihydrate | Acros Organics | 22441.296 | |
| Clamp stand | Eisco | MTST5 | Two required |
| Clamps | R&L Enterprises | 41 | Two required, should have flat tops |
| Syringes | BD | 307731 | Any size can be used, depending on application |
| Universal Mechanical Tester | Zwick Roell | Z030 |
References
- Webber, M. J., Appel, E. A., Meijer, E. W., Langer, R. Supramolecular biomaterials. Nature Materials. 15, 13-26 (2015).
- Mathew, A. P., Uthaman, S., Cho, K. -. H., Cho, C. -. S., Park, I. -. K. Injectable hydrogels for delivering biotherapeutic molecules. International Journal of Biological Macromolecules. 110, 17-29 (2018).
- Zhou, H., et al. Injectable biomaterials for translational medicine. Materials Today. 28, 81-97 (2019).
- Alves, H. L. R., dos Santos, L. A., Bergmann, C. P. Injectability evaluation of tricalcium phosphate bone cement. Journal of Materials Science: Materials in Medicine. 19, 2241-2246 (2008).
- Yu, L., Ding, J. Injectable hydrogels as unique biomedical materials. Chemical Society Reviews. 37, 1473 (2008).
- Pawelec, K. M., Planell, J. A. . Bone Repair Biomaterials: Regeneration and Clinical Applications. , (2019).
- Fernandez de Grado, G., et al. Bone substitutes: a review of their characteristics, clinical use, and perspectives for large bone defects management. Journal of Tissue Engineering. 9, 204173141877681 (2018).
- Robinson, T. E., et al. Filling the Gap: A Correlation between Objective and Subjective Measures of Injectability. Advanced Healthcare Materials. , 1901521 (2020).
- O’Neill, R., et al. Critical review: Injectability of calcium phosphate pastes and cements. Acta Biomaterialia. 50, 1-19 (2017).
- Gantar, A., et al. Injectable and self-healing dynamic hydrogel containing bioactive glass nanoparticles as a potential biomaterial for bone regeneration. RSC Advances. 6, 69156-69166 (2016).
- Ramin, M. A., Latxague, L., Sindhu, K. R., Chassande, O., Barthélémy, P. Low molecular weight hydrogels derived from urea based-bolaamphiphiles as new injectable biomaterials. Biomaterials. 145, 72-80 (2017).
- Ren, K., He, C., Xiao, C., Li, G., Chen, X. Injectable glycopolypeptide hydrogels as biomimetic scaffolds for tissue engineering. Biomaterials. 51, 238-249 (2015).
- Burckbuchler, V., et al. Rheological and syringeability properties of highly concentrated human polyclonal immunoglobulin solutions. European Journal of Pharmaceutics and Biopharmaceutics. 76, 351-356 (2010).
- Allmendinger, A., et al. Rheological characterization and injection forces of concentrated protein formulations: An alternative predictive model for non-Newtonian solutions. European Journal of Pharmaceutics and Biopharmaceutics. 87, 318-328 (2014).
- Davison, P. F. The Effect of Hydrodynamic Shear on the Deoxyribonucleic Acid from T2 and T4 Bacteriophages. Proceedings of the National Academy of Sciences of the United States of America. 45, 1560-1568 (1959).
- Chen, M. H., et al. Methods to Assess Shear-Thinning Hydrogels for Application As Injectable Biomaterials. ACS Biomaterials Science and Engineering. 3, 3146-3160 (2017).
- Krebs, J., et al. Clinical measurements of cement injection pressure during vertebroplasty. Spine. 30, (2005).
- Bohner, M., Baroud, G. Injectability of calcium phosphate pastes. Biomaterials. 26, 1553-1563 (2005).
- Gbureck, U., Barralet, J. E., Spatz, K., Grover, L. M., Thull, R. Ionic Modification of Calcium Phosphate Cement Viscosity. Part I: Hypodermic Injection and Strength Improvement of Apatite Cement. Biomaterials. 25, 2187-2195 (2004).
- Habib, M., Baroud, G., Galea, L., Bohner, M. Evaluation of the ultrasonication process for injectability of hydraulic calcium phosphate pastes. Acta Biomaterialia. 8, 1164-1168 (2012).
- Martin, B. C., Minner, E. J., Wiseman, S. L., Klank, R. L., Gilbert, R. J. Agarose and methylcellulose hydrogel blends for nerve regeneration applications. Journal of Neural Engineering. 5, 221-231 (2008).
- Borzacchiello, A., Russo, L., Malle, B. M., Schwach-Abdellaoui, K., Ambrosio, L. Hyaluronic Acid Based Hydrogels for Regenerative Medicine Applications. BioMed Research International. 2015, 871218 (2015).
- Zhao, L., Weir, M. D., Xu, H. H. K. An injectable calcium phosphate-alginate hydrogel-umbilical cord mesenchymal stem cell paste for bone tissue engineering. Biomaterials. 31, 6502-6510 (2010).
- Ji, D. -. Y., Kuo, T. -. F., Wu, H. -. D., Yang, J. -. C., Lee, S. -. Y. A novel injectable chitosan/polyglutamate polyelectrolyte complex hydrogel with hydroxyapatite for soft-tissue augmentation. Carbohydrate Polymers. 89, 1123-1130 (2012).
- Vaishya, R., Chauhan, M., Vaish, A. Bone cement. Journal of Clinical Orthopaedics and Trauma. 4, 157-163 (2013).

