Contribución de la bomba Na+/ K+ a la explosión rítmica, explorada con modelado y análisis dinámicos de abrazadera
Summary
Aquí se presenta un método para la investigación de los roles de la bomba Na+/ K+ y la corriente persistente de Na+ en interneuronas cardíacas de sanguijuela utilizando pinza dinámica.
Abstract
La bomba Na+/ K+, a menudo considerada como una función de fondo en la actividad neuronal, contribuye con una corriente hacia afuera(bombaI)que responde a la concentración interna de Na+ ([Na+]i). En las neuronas en explosión, como las que se encuentran en las redes neuronales generadoras de patrones centrales (CPG) que producen movimientos rítmicos, se puede esperar que el [Na+]i y, por lo tanto, la bombaI , varíe a lo largo del ciclo de estallido. Esta capacidad de respuesta a la actividad eléctrica, combinada con la independencia del potencial de membrana, dota a la bomba I de propiedades dinámicas que no son comunes a las corrientes basadas en canales (por ejemplo, canales de voltaje o transmisores o fugas). Además, en muchas neuronas, la actividad de la bomba es modulada por una variedad de moduladores, ampliando aún más el papel potencial de la bomba I en la actividad de estallido rítmico. Este artículo muestra cómo utilizar una combinación de modelado y métodos de pinza dinámica para determinar cómo bombeo y su interacción con la corriente persistente de Na+ influyen en la actividad rítmica en una GPC. Específicamente, este artículo se centrará en un protocolo de pinza dinámica y métodos de modelado computacional en interneuronas cardíacas de sanguijuelas medicinales.
Introduction
Los latidos del corazón en las sanguijuelas son impulsados por una GPC que consiste en 9 pares bilaterales de interneuronas cardíacas (HN) distribuidas en la mayor cantidad de ganglios segmentarios de la mitad del cuerpo. En el núcleo de la GPC se encuentran pares mutuamente inhibitorios de interneuronas ubicadas en los ganglios segmentarios3º y4º que forman osciladores semicéntricos (HCO)(Figura 1A). Estas neuronas continúan estallando cuando se aíslan sinápticamente farmacológicamente usando bicucullina1. Otros, como el par en los ganglios segmentarios7 (el foco de este protocolo), también son ráfagas, capaces de producir actividad de estallido cuando se aíslan sinápticamente. No están mutuamente conectados y reciben solo entrada descendente, y por lo tanto se aíslan fácilmente al separar el ganglio del resto del cordón nervioso. Esta actividad de estallido independiente es sensible a la corriente de fuga introducida causada por la penetración con microelectrodos afilados para la grabación, pero estalla vigorosamente cuando se graba con métodos de parche suelto1.
Se han modelado tanto las neuronas HN individuales como las HN HNO HCOs (modelos de compartimento isopotencial único basados en Hodgkin-Huxley de neuronas HN que contienen todas las corrientes sinápticas y de voltaje identificadas experimentalmente), y todas las características de estallido del sistema vivo se han capturado con éxito2. La miomodulina, un neuropéptido endógeno en las sanguijuelas, disminuye notablemente el período (T) del ritmo de estallido de las neuronas HN aisladas y las HN HNo. Este modulador actúa para aumentar la corriente h (corriente interna activada por hiperpolarización, Ih)y para disminuir labombaI3. Esta observación llevó a la exploración de cómo labomba I interactúa con Ih,y cómo su co-modulación contribuye a la actividad rítmica de las neuronas HN. La activación de la bomba mediante el aumento de [Na+]i (utilizando el ionóforo monensina) acelera el ritmo de estallido de HN tanto en HN HCOs como en neuronas HN aisladas4. Esta aceleración dependía de Ih. Cuando Ih estaba bloqueado (2 mM Cs+),el período de ráfaga no se alteraba por este método de activación de la bomba; sin embargo, la duración de la ráfaga (BD) se redujo y el intervalo de interbursura (IBI) aumentó tanto en HN HCOs como en neuronas HN aisladas4.
Para este protocolo, todas las corrientes de una neurona HN(7) viva, incluida la corriente de bomba, I bomba,se incorporan en el modelo HN de la siguiente manera:
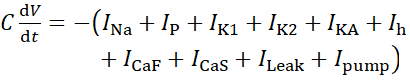 (1)
(1)
donde C es la capacitancia de membrana (en nF), V es el potencial de membrana (en V), t es el tiempo (en s). Las descripciones y ecuaciones detalladas de la corriente iónica se han descrito en otra parte2,4. La neurona modelo HN completa se ejecuta en tiempo real (Figura 2). El software estará disponible en GitHub en el momento de su publicación y será adecuado para ejecutarse en la placa de procesamiento de señal digital descrita en la Tabla de materiales. Aquí, el foco de investigación es la corriente de la bomba Na+/ K+ (bombaI) y las corrientes de voltaje que contribuyen con un flujo significativo de Na+: una corriente rápida de Na+ (INa) y una corriente persistente de Na+ (IP). Las conductancias máximas de estas corrientes son 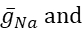
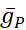 respectivamente. La bomba Na+/K+ intercambia tres iones intracelulares Na+ por dos iones K+ extracelulares, produciendo así una corriente neta hacia el exterior. Es importante destacar que bombea 3 veces más Na+ fuera de la neurona de lo que indica esta corriente, lo cual es importante para calcular la concentración intracelular de Na+.
respectivamente. La bomba Na+/K+ intercambia tres iones intracelulares Na+ por dos iones K+ extracelulares, produciendo así una corriente neta hacia el exterior. Es importante destacar que bombea 3 veces más Na+ fuera de la neurona de lo que indica esta corriente, lo cual es importante para calcular la concentración intracelular de Na+.
La corriente de bomba Na+/K+ depende de las concentraciones intracelulares de Na+ y se expresa mediante la siguiente función sigmoidal:
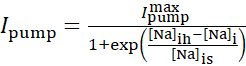 (2)
(2)
donde [Na]i es la concentración intracelular de Na+, 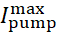 es la corriente máxima de la bomba Na+/K+, [Na]ih es la concentración intracelular de Na+ para la media activación de la bomba Na+/K+, y [Na]es la sensibilidad de la bomba Na+/K+ a [Na]i. [Na]i se construye como resultado de las afluencias de Na+ transportadas por IP e INa y se ve disminuida por el eflujo na+ de la bomba Na+/ K+. La contribución de Ih e ILeak al flujo total deNa+ es pequeña y no se considera en el modelo en tiempo real.
es la corriente máxima de la bomba Na+/K+, [Na]ih es la concentración intracelular de Na+ para la media activación de la bomba Na+/K+, y [Na]es la sensibilidad de la bomba Na+/K+ a [Na]i. [Na]i se construye como resultado de las afluencias de Na+ transportadas por IP e INa y se ve disminuida por el eflujo na+ de la bomba Na+/ K+. La contribución de Ih e ILeak al flujo total deNa+ es pequeña y no se considera en el modelo en tiempo real.
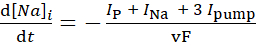 (3)
(3)
donde, v es el volumen (~6.7 pL) del reservorio intracelular de Na+, F es la constante de Faraday, y la concentración extracelular de Na+ se mantiene constante.
Se han diferenciado las conductancias dependientes de voltaje y fugas, que responden al potencial de membrana, de la corriente de la bomba, que está regulada por la concentración intracelular calculada de Na+ ([Na+]i). [Na+] i se construye a través de na+ entrada a través de la corriente rápida Na+ (INa) que produce potenciales de acción (picos) y la corriente persistente Na+ (IP) que proporciona la despolarización para soportar el aumento. [Na+] i es, a su vez, reducido por la acción de la bomba a través de la extrusión deNa+. Se han asumido valores basales de HN vivo de 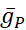 (5nS) y
(5nS) y 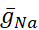 (150 nS), y tenemos en cuenta cualquier abrazadera dinámica
(150 nS), y tenemos en cuenta cualquier abrazadera dinámica 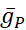 añadida.
añadida.
El objetivo del protocolo descrito aquí es manipular la bomba de forma precisa y reversible en tiempo real para descubrir cómo interactúa con las corrientes de voltaje (corriente persistente de Na+ en el protocolo actual) para controlar el estallido rítmico en HNs individuales. Para lograr este objetivo, se utilizó una abrazadera dinámica, que introduce artificialmente, por orden, una cantidad precisa de cualquier corriente que se puede calcular a medida que se ejecuta el modelo. Este método tiene ventajas sobre la manipulación farmacológica de la bomba, que afecta a todo el tejido, puede tener efectos fuera del objetivo que a menudo son difíciles de revertir y no se pueden manipular con precisión. La abrazadera dinámica5,6 lee el voltaje de una neurona registrada en tiempo real(Figura 1B)y calcula e inyecta, en tiempo real, la cantidad de cualquier corriente basada en ecuaciones del modelo y los valores establecidos de 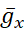 cualquiera o
cualquiera o 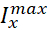 . Métodos similares se pueden aplicar fácilmente a cualquier neurona que se pueda registrar intracelularmente. Sin embargo, los parámetros tendrán que ser reescalados a la neurona elegida, y la neurona debe aislarse de las entradas sinápticas, por ejemplo, farmacológicamente.
. Métodos similares se pueden aplicar fácilmente a cualquier neurona que se pueda registrar intracelularmente. Sin embargo, los parámetros tendrán que ser reescalados a la neurona elegida, y la neurona debe aislarse de las entradas sinápticas, por ejemplo, farmacológicamente.
Protocol
Representative Results
Discussion
El modelado, la pinza dinámica y los análisis resultantes que permiten son técnicas útiles para explorar cómo los individuos y los grupos de conductancia /corrientes iónicas contribuyen a la actividad eléctrica de las neuronas(Figura 1, Figura 2,Figura 4y Figura 5). El uso de estas técnicas muestra cómo la corriente de la bomba Na+/ K+ (bombaI)interactúa con las corrientes de voltaje, particularmente la corriente persistente de Na+ (IP),para promover un estallido robusto en las HN centrales del generador del patrón de latidos del corazón de la sanguijuela. Al combinar experimentos de abrazadera dinámica y modelado, es posible probar modelos más directamente de lo que es posible con el registro de voltaje ordinario y las técnicas de abrazadera de corriente. Los resultados obtenidos de los experimentos de abrazadera dinámica(Figura 5)se utilizarán para refinar aún más el modelo HN. El método básico de pinzamiento dinámico demostrado aquí se puede personalizar para reflejar las propiedades de cualquier neurona en estudio si se puede determinar un modelo matemático de corrientes neuronales con experimentos de pinza de voltaje.
La finalización exitosa de los experimentos del tipo que se muestra aquí requiere un empalamiento cuidadoso de un HN u otra neurona cuando se usa un microelectrodo afilado, porque el estallido fuerte se reduce por la penetración del electrodo1. (Las técnicas de registro de parches de células enteras, que minimizan las fugas introducidas, también son aplicables a otras neuronas, pero no funcionan bien en las neuronas sanguijuelas). Es fundamental que el empalamiento de la neurona HN cause un daño mínimo a la neurona (fuga añadida), y la resistencia de entrada debe ser monitoreada y debe estar en el rango de 60-100 MOhms para experimentos exitosos4.
La pinza dinámica es una técnica poderosa, pero tiene limitaciones impuestas por la geometría neuronal porque las conductancias artificiales se implementan en el sitio del electrodo de grabación -generalmente el cuerpo celular- no en el sitio donde las corrientes generadoras de ritmo generalmente se localizan5,6,10. En las neuronas HN sanguijuelas, el cuerpo celular está eléctricamente cerca de la zona de integración (neurita principal) de la neurona donde se localizan la mayoría de las corrientes activas y se inician picos.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Agradecemos a Christian Erxleben por los experimentos preliminares de pinza dinámica en neuronas HN(7) que demostraron sus capacidades de estallido. Angela Wenning ayudó a los experimentos con el asesoramiento de expertos. Reconocemos a los NIH por financiar este trabajo a través de la Subvención 1 R21 NS111355 a GSC y RLC.
Materials
| ANIMALS | |||
| Hirudo verbana | Leech.com, https://www.leech.com/collections/live-leeches | live leeches 2-3 grams | |
| CHEMICALS | |||
| ARTIFICIAL POND WATER | |||
| CaCl2 | Sigma Aldrich | C5670-100G | 1.8 mM add last after adjusting pH |
| glucose | Sigma Aldrich | G7021-100G | 10 mM |
| HEPES | Sigma Aldrich | H4034-100G | 10 mM |
| Instant Ocean (sea salt ) | Spectrum Brands Inc., Madison, WI | 0.05% (w/v) diluted in deionized water | |
| KCl | Sigma Aldrich | P9333-500G | 4 mM |
| NaCl | Sigma Aldrich | S7653-250G | 115 mM |
| NaOH 0.1 N Solution | Sigma Aldrich | 2105-50ML | Adjust to pH 7.4 with NaOH |
| MICROELECTRODES | |||
| K Acetate | Sigma Aldrich | P1190-100G | 2 M |
| KCl | Sigma Aldrich | P9333-500G | 20 mM |
| SALINE | |||
| EQUIPMENT | |||
| #5 Forceps | Fine Science Tools Dumont | 11251-30 OR 11251-20 | For general leech dissection |
| AxoClamp 2A/2B DCC electrometer | Axon Instruments Molecular Devices | 2A/2B | For recording of neuronal membrane potential and discontinuous current clamp |
| Black resin | Dow Sylguard | 170 | Lines general dissect dish |
| Capilary glass 1 mm outer diameter, 0.75 mm inner diameter | A-M Systems | 615000 | For fabricating sharp microelectrodes |
| Clear resin | Dow Sylguard | 184 | Lines Petri dish used to mount ganglion for electrophysilogy |
| Dark field condenser | Nikon | Dry 0.95-0.80 MBL 1210 | For illuminating the ganglion preparation during cell impalement |
| Digidata 1440A | Axon CNS Molecular Devices | 1440A | Performs A to D and D to A for data acquisition and stimulation during electrophysiology |
| Digital signal processing board | dSpace | CLP1104 | Our software implements all the conductances/currents in our model HN neuron on a DS1103 dSPACE PPC Controller Board in real-time at a rate of 20 kHz with a ControlDesk GUI (dSPACE, Paderborn, Germany)9. |
| Falming/Brown Microelectrode Puller | Sutter Instruments | P-97 | For fabricating sharp microelectrodes |
| Fiber-Lite high intensity illuminator | Dolan Jenner Industries | 170D | For illuminating the general dissection and for illuminating the ganglion preparation during cell impalement |
| Headstage amplifier for AxoClamp 2A | Axon Instruments | HS-2A Gain:0.1LU | Now part of Molecular Devices for recording of neuronal membrane potential and discontinuous current clamp |
| Light guide | Dolan Jenner Industries | Rev R 38 08 3729107 | For illuminating the general dissection and for illuminating the ganglion preparation during cell impalement |
| Micromanipulator | Sutter Instruments | MPC-385 | Micromanipulator for cell impalement with microelectrodes |
| Micromanipulator controller | Sutter Instruments | MPC-200 | Controls micromanipulators for cell impalement with microelectrodes |
| Minuten pins | BioQuip | 0.15 mm diameter 1208SA | Should be shortened by curtting to ~5 mm |
| Optical Breadboard 3' x 5' x 8" | Newport | Obsolete | With the 4 pneumatic Isolators below used to construct a vibration free workspace for electrophysiology |
| Oscilloscope | HAMEG Instruments | HM303-6 | To monitor electrode setteling during DCC |
| Pascheff-Wolff spring scissors | Moria | Supplied by Fine Science Tools (Foster City, CA) catalog # 15371-92 | |
| pClamp 9 Software | Axon Instruments | 9 | Now part of Moleculear Devices uses the Digidata 1440 for data acquisition and stimulation during electrophysiology |
| Pneumatic Isolators 28" | Newport | Obsolete | With optical breadboard used to construct a vibration free workspace for electrophysiology |
| Simulink / MATLAB software | MathWorks | 2006 (Obsolete) | Implements dynamic clamp on the digital signal processing board |
| Stereomicroscope | Wild | M5A | 10x Eye Pieces used for dissecting the leech and removingand desheathing ganglia |
| Steromicroscope | Wild | M5 | 20x Eye Pieces used in electrophysiologcal station to visualize neuron for microelectrode penetration |
| Student Vannas Spring Scissors | Fine Science Tools | 91500-09 | For general leech dissection |
References
- Cymbalyuk, G. S., Gaudry, Q., Masino, M. A., Calabrese, R. L. Bursting in leech heart interneurons: cell-autonomous and network-based mechanisms. Journal of Neuroscience. 22, 10580-10592 (2002).
- Hill, A. A., Lu, J., Masino, M. A., Olsen, O. H., Calabrese, R. L. A model of a segmental oscillator in the leech heartbeat neuronal network. Journal of Computational Neuroscience. 10, 281-302 (2001).
- Tobin, A. E., Calabrese, R. L. Myomodulin increases Ih and inhibits the NA/K pump to modulate bursting in leech heart interneurons. Journal of Neurophysiology. 94, 3938-3950 (2005).
- Kueh, D., Barnett, W. H., Cymbalyuk, G. S., Calabrese, R. L. Na(+)/K(+) pump interacts with the h-current to control bursting activity in central pattern generator neurons of leeches. eLife. 5, 19322 (2016).
- Sharp, A. A., O’Neil, M. B., Abbott, L. F., Marder, E. Dynamic clamp: computer-generated conductances in real neurons. Journal of Neurophysiology. 69, 992-995 (1993).
- Prinz, A. A., Abbott, L. F., Marder, E. The dynamic clamp comes of age. Trends in Neuroscience. 27, 218-224 (2004).
- Barnett, W., Cymbalyuk, G., Jung, R. Hybrid systems analysis: real-time systems for design and prototyping of neural interfaces and prostheses. Biohybrid systems: nerves, interfaces, and machines. , 115-138 (2011).
- Sorensen, M., DeWeerth, S., Cymbalyuk, G., Calabrese, R. L. Using a hybrid neural system to reveal regulation of neuronal network activity by an intrinsic current. Journal of Neuroscience. 24, 5427-5438 (2004).
- Olypher, A., Cymbalyuk, G., Calabrese, R. L. Hybrid systems analysis of the control of burst duration by low-voltage-activated calcium current in leech heart interneurons. Journal of Neurophysiology. 96, 2857-2867 (2006).
- Calabrese, R. L., Prinz, A. A., DeSchutter, E. Realistic modeling of small neuronal networks. Computational Modeling Methods for Neuroscientists. , 285-316 (2010).
- Rybak, I. A., Molkov, Y. I., Jasinski, P. E., Shevtsova, N. A., Smith, J. C. Rhythmic bursting in the pre-Bötzinger complex: mechanisms and models. Progress in Brain Research. 209, 1-23 (2014).
- Picton, L. D., Nascimento, F., Broadhead, M. J., Sillar, K. T., Miles, G. B. Sodium pumps mediate activity-dependent changes in mammalian motor networks. Journal of Neuroscience. 37, 906-921 (2017).

