Na+/K+ リシカルバーストへのポンプの寄与、モデリングとダイナミッククランプ解析で探索
Summary
ここで提示されるNa+/K+ポンプの役割と、動的クランプを用いたリーチ心臓インターニューロンにおける持続Na+電流の調査方法を示す。
Abstract
Na+/K+ポンプは、しばしば神経活動の背景機能と考え、Na+の内部濃度に応答する外向きの電流(Iポンプ)に寄与する([Na+]i)。リズミカルな動きを生む中心パターン発生器(CPG)ニューロンネットワークのようなバーストニューロンでは、[Na+]iとIポンプは、バーストサイクルを通して変化することが期待できます。この電気的活動への応答性は、膜電位からの独立性と相まって、チャネルベースの電流(例えば、電圧または送信機ゲートまたはリークチャネル)に共通しない動的特性を有するIポンプを与える。さらに、多くのニューロンにおいて、ポンプの活動は様々な変調器によって変調され、リズミカルな破裂活動におけるIポンプの潜在的役割をさらに拡大する。この論文では、モデリングと動的クランプ法の組み合わせを使用して、ポンプの方法と、その持続的なNa+電流との相互作用がCPGのリズミカルな活動に影響を与える方法を示します。具体的には、薬用リーチの心臓インターニューロンにおける動的クランププロトコルと計算モデリング法に焦点を当てる。
Introduction
リーチの心拍は、多くの中半体の分節性神経節に分布する9つの両側対の心臓インターニューロン(HN)からなるCPGによって駆動される。CPGの中核は、半中心発振器(HKO)を形成する第3および 第4の セグメント性神経節に位置するニューロン間の相互阻害対である(図1A)。これらのニューロンは、共分的に単離された薬理学的にビキュリン1を使用すると破裂し続ける。第7の セグメント性神経節(このプロトコルの焦点)のペアのような他のものは、バーバーサでもあり、同種分離時にバースト活動を生じさせることができる。それらは相互に接続されておらず、下降入力のみを受け取るため、神経節を神経コードの残りの部分から切断することによって容易に単離される。この独立したバースト活動は、記録用の鋭い微小電極での浸透によって引き起こされる導入されたリーク電流に敏感であるが、緩いパッチ法1で記録されると激しく破裂する。
個々のHNニューロンとHNHCOの両方がモデル化されている(全ての実験的に同定された電圧ゲート電流及びシナプス電流を含むHNニューロンのホジキン・ハクスリーベースの単一イソポテンシャルコンパートメントモデル)、及び生きているシステムのすべてのバースト特性が正常に捕捉された2。ミオモジュリンは、リーチ中の内因性神経ペプチドであり、孤立したHNニューロンおよびHNHKOのバーストリズムの期間(T)を著しく減少させる。この変調器は、h-電流を増加させる(超分極活性化内流、Ih)とIポンプ3を減少させる作用をする。この観察は、私がポンプがIhとどのように相互作用するか、そしてそれらの共変調がHNニューロンのリズミカルな活動にどのように寄与するかを探求することにつながった。[Na+]iを増加させることによるポンプの活性化(イオノフォアモネンシンを使用)は、HNHKOと単離されたHNニューロン4の両方でHNバーストリズムを高速化する。この高速化はIhに依存していましたが、hがブロックされたとき(2mM Cs+)、バースト期間はこのポンプ活性化の方法によって変更されませんでした。しかし、バースト持続時間(BD)は縮小され、HN HKOと単離されたHNニューロン4の両方でインターバースト間隔(IBI)が増加した。
このプロトコルでは、ポンプ電流を含む生きているHN(7)ニューロンのすべての電流は、次のようにHNモデルに組み込まれています。
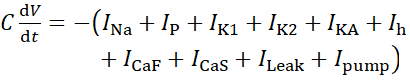 (1)
(1)
ここでCは膜容量(nF)、Vは膜電位(V)、tは時間(s)である。 詳細なイオン電流の記述と方程式は、他の2,4に記載されています。完全なHNモデルニューロンはリアルタイムで実行されます(図2)。ソフトウェアは公開時にGitHubで利用可能になり、資料一覧に記載されているデジタル信号処理ボードで実行するのに適しています。ここでは、問い合わせの焦点は、Na+/K+ポンプ電流(Iポンプ) と重要な Na+フラックスに寄与する電圧ゲート電流です: 高速 Na+電流 (INa) と持続的な Na+電流 (IP).これらの電流の最大の伝導度 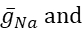
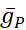 は、それぞれです。Na+/K+ポンプは、2つの細胞外K+イオンに対して3つの細胞内Na+イオンを交換し、したがって正味の外流を生成する。重要なことに、この電流が示すニューロンの3倍のNa+をポンプで送り出し、これは細胞内Na+濃度を計算するために重要である。
は、それぞれです。Na+/K+ポンプは、2つの細胞外K+イオンに対して3つの細胞内Na+イオンを交換し、したがって正味の外流を生成する。重要なことに、この電流が示すニューロンの3倍のNa+をポンプで送り出し、これは細胞内Na+濃度を計算するために重要である。
Na+/K+ ポンプ電流は細胞内Na+ 濃度に依存し、以下のシグモイド関数によって表されます。
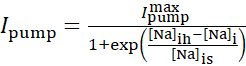 (2)
(2)
ここで[Na]i は細胞内Na+濃度 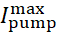 、最大Na+/K+ポンプ電流、及び[Na]ihはNa+/K+ポンプの半活性化のための細胞内Na+濃度であり、[Na]はNa+/K+ポンプの感度である。 [Na]Iは 、IPとINaによって運ばれるNa+流入の結果として構築され、Na+/K+ポンプのNa+流出によって減少する。Na+フラックスの合計に対するIhとIリークの寄与は小さく、リアルタイムモデルでは考慮されません。
、最大Na+/K+ポンプ電流、及び[Na]ihはNa+/K+ポンプの半活性化のための細胞内Na+濃度であり、[Na]はNa+/K+ポンプの感度である。 [Na]Iは 、IPとINaによって運ばれるNa+流入の結果として構築され、Na+/K+ポンプのNa+流出によって減少する。Na+フラックスの合計に対するIhとIリークの寄与は小さく、リアルタイムモデルでは考慮されません。
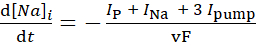 (3)
(3)
ここで、vは細胞内Na+ 貯留層の体積(約6.7pL)であり、Fはファラデーの一定であり、細胞外Na+ 濃度は一定に保たれている。
電圧ゲート付きおよびリーク伝導度は、膜電位に対する応答が分化されており、計算された細胞内Na+濃度によって調節されるポンプ電流とは異なっている([Na+]i)。[ナ+]iは、アクションポテンシャル(スパイク)と、スパイクをサポートする脱分極を提供する持続Na+電流(IP)を生成する高速Na+電流(INa)を介してNa+エントリを介して構築されます。[ナ+]iは、今度は、Na+の押出を通してポンプの作用によって減少する。ベースラインの生きているHN値 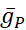 (5nS)と
(5nS)と 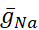 (150 nS)が想定されており、追加された動的クランプを考慮に入れます
(150 nS)が想定されており、追加された動的クランプを考慮に入れます 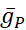 。
。
ここで説明するプロトコルの目的は、私が正確かつ可逆的にリアルタイムでポンプを操作して、電圧ゲート電流(電流プロトコル内の持続的なNa+電流)とどのように相互作用するかを発見し、単一のHNsでリズミカルな破裂を制御することです。この目標を達成するために、動的クランプを使用し、これは、モデルの実行中に計算できる電流の正確な量を、コマンドで人為的に導入しました。この方法は、組織全体に影響を与えるポンプの薬理学的操作よりも利点があり、しばしば逆転しにくいオフターゲット効果を有し、正確に操作することができない。動的クランプ5、6は、記録されたニューロンの電圧をリアルタイムで読み取り(図1B)、モデル方程式に基づいて任意の電流量および任意のまたはのいずれかの設定値に基づいて、リアルタイムで、任意の電流量を計算し、注入 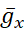
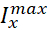 する。同様の方法は、細胞内で記録することができる任意のニューロンに簡単に適用することができます。しかし、パラメーターは選択されたニューロンに再スケールする必要があり、ニューロンはシナプス入力から分離する必要があります, 例えば, 薬理学的.
する。同様の方法は、細胞内で記録することができる任意のニューロンに簡単に適用することができます。しかし、パラメーターは選択されたニューロンに再スケールする必要があり、ニューロンはシナプス入力から分離する必要があります, 例えば, 薬理学的.
Protocol
Representative Results
Discussion
モデリング、動的クランプ、およびそれらが可能になる結果の分析は、個々およびイオン伝導度/電流のグループがニューロンの電気的活動にどのように寄与するかを探索するのに有用な技術である(図1、図2、図4、および図5)。これらの技術の使用は、Na+/K+ポンプ電流(Iポンプ) が電圧ゲート電流、特に持続性Na+電流(IP)と相互作用して、リーチハートビートパターンジェネレータのコアHNにおける堅牢な破裂を促進する方法を示しています。動的クランプ実験とモデリングを組み合わせることで、通常の電圧記録や電流クランプ技術で可能な限り直接的にモデルをテストすることが可能です。ダイナミッククランプ実験から得られた結果(図5)を用い、HNモデルをさらに改良します。ここで示す動的クランプの基本的な方法は、ニューロン電流の数学的モデルを電圧クランプ実験で決定できる場合、研究中のニューロンの特性を反映するようにカスタマイズすることができます。
ここで示すタイプの実験を成功させるには、鋭利な微小電極を用いた場合にHNまたは他のニューロンの入念な不形成が必要であり、電極浸透1によって強い破裂が抑制されるためである。(全細胞パッチ記録技術は、導入されたリークを最小限に抑え、他のニューロンにも適用可能ですが、リーチニューロンではうまく機能しません。HNニューロンの障害がニューロンへの損傷を最小限に(追加リーク)させ、入力抵抗を監視し、実験を成功させるためには60-100MOhmsの範囲になければならないことが重要である。
動的クランプは強力な技術であるが、人工的なコンダクタンスは記録電極の部位で実施されるため、ニューロン幾何学によって課される限界がある。リーチHNニューロンでは、細胞体は、ほとんどの活性電流が局在するニューロンの統合ゾーン(主神経突起)に電気的に近く、スパイクが開始される。
Disclosures
The authors have nothing to disclose.
Acknowledgements
我々は、その破裂能力を実証したHN(7)ニューロンの予備的な動的クランプ実験のためのクリスチャン・エルクスレーベンに感謝する。アンジェラ・ウェニングは専門家のアドバイスで実験を支援しました。我々は、グラント1 R21 NS111355を通じてGSCおよびRLCに資金を提供したNIHを認める。
Materials
| ANIMALS | |||
| Hirudo verbana | Leech.com, https://www.leech.com/collections/live-leeches | live leeches 2-3 grams | |
| CHEMICALS | |||
| ARTIFICIAL POND WATER | |||
| CaCl2 | Sigma Aldrich | C5670-100G | 1.8 mM add last after adjusting pH |
| glucose | Sigma Aldrich | G7021-100G | 10 mM |
| HEPES | Sigma Aldrich | H4034-100G | 10 mM |
| Instant Ocean (sea salt ) | Spectrum Brands Inc., Madison, WI | 0.05% (w/v) diluted in deionized water | |
| KCl | Sigma Aldrich | P9333-500G | 4 mM |
| NaCl | Sigma Aldrich | S7653-250G | 115 mM |
| NaOH 0.1 N Solution | Sigma Aldrich | 2105-50ML | Adjust to pH 7.4 with NaOH |
| MICROELECTRODES | |||
| K Acetate | Sigma Aldrich | P1190-100G | 2 M |
| KCl | Sigma Aldrich | P9333-500G | 20 mM |
| SALINE | |||
| EQUIPMENT | |||
| #5 Forceps | Fine Science Tools Dumont | 11251-30 OR 11251-20 | For general leech dissection |
| AxoClamp 2A/2B DCC electrometer | Axon Instruments Molecular Devices | 2A/2B | For recording of neuronal membrane potential and discontinuous current clamp |
| Black resin | Dow Sylguard | 170 | Lines general dissect dish |
| Capilary glass 1 mm outer diameter, 0.75 mm inner diameter | A-M Systems | 615000 | For fabricating sharp microelectrodes |
| Clear resin | Dow Sylguard | 184 | Lines Petri dish used to mount ganglion for electrophysilogy |
| Dark field condenser | Nikon | Dry 0.95-0.80 MBL 1210 | For illuminating the ganglion preparation during cell impalement |
| Digidata 1440A | Axon CNS Molecular Devices | 1440A | Performs A to D and D to A for data acquisition and stimulation during electrophysiology |
| Digital signal processing board | dSpace | CLP1104 | Our software implements all the conductances/currents in our model HN neuron on a DS1103 dSPACE PPC Controller Board in real-time at a rate of 20 kHz with a ControlDesk GUI (dSPACE, Paderborn, Germany)9. |
| Falming/Brown Microelectrode Puller | Sutter Instruments | P-97 | For fabricating sharp microelectrodes |
| Fiber-Lite high intensity illuminator | Dolan Jenner Industries | 170D | For illuminating the general dissection and for illuminating the ganglion preparation during cell impalement |
| Headstage amplifier for AxoClamp 2A | Axon Instruments | HS-2A Gain:0.1LU | Now part of Molecular Devices for recording of neuronal membrane potential and discontinuous current clamp |
| Light guide | Dolan Jenner Industries | Rev R 38 08 3729107 | For illuminating the general dissection and for illuminating the ganglion preparation during cell impalement |
| Micromanipulator | Sutter Instruments | MPC-385 | Micromanipulator for cell impalement with microelectrodes |
| Micromanipulator controller | Sutter Instruments | MPC-200 | Controls micromanipulators for cell impalement with microelectrodes |
| Minuten pins | BioQuip | 0.15 mm diameter 1208SA | Should be shortened by curtting to ~5 mm |
| Optical Breadboard 3' x 5' x 8" | Newport | Obsolete | With the 4 pneumatic Isolators below used to construct a vibration free workspace for electrophysiology |
| Oscilloscope | HAMEG Instruments | HM303-6 | To monitor electrode setteling during DCC |
| Pascheff-Wolff spring scissors | Moria | Supplied by Fine Science Tools (Foster City, CA) catalog # 15371-92 | |
| pClamp 9 Software | Axon Instruments | 9 | Now part of Moleculear Devices uses the Digidata 1440 for data acquisition and stimulation during electrophysiology |
| Pneumatic Isolators 28" | Newport | Obsolete | With optical breadboard used to construct a vibration free workspace for electrophysiology |
| Simulink / MATLAB software | MathWorks | 2006 (Obsolete) | Implements dynamic clamp on the digital signal processing board |
| Stereomicroscope | Wild | M5A | 10x Eye Pieces used for dissecting the leech and removingand desheathing ganglia |
| Steromicroscope | Wild | M5 | 20x Eye Pieces used in electrophysiologcal station to visualize neuron for microelectrode penetration |
| Student Vannas Spring Scissors | Fine Science Tools | 91500-09 | For general leech dissection |
References
- Cymbalyuk, G. S., Gaudry, Q., Masino, M. A., Calabrese, R. L. Bursting in leech heart interneurons: cell-autonomous and network-based mechanisms. Journal of Neuroscience. 22, 10580-10592 (2002).
- Hill, A. A., Lu, J., Masino, M. A., Olsen, O. H., Calabrese, R. L. A model of a segmental oscillator in the leech heartbeat neuronal network. Journal of Computational Neuroscience. 10, 281-302 (2001).
- Tobin, A. E., Calabrese, R. L. Myomodulin increases Ih and inhibits the NA/K pump to modulate bursting in leech heart interneurons. Journal of Neurophysiology. 94, 3938-3950 (2005).
- Kueh, D., Barnett, W. H., Cymbalyuk, G. S., Calabrese, R. L. Na(+)/K(+) pump interacts with the h-current to control bursting activity in central pattern generator neurons of leeches. eLife. 5, 19322 (2016).
- Sharp, A. A., O’Neil, M. B., Abbott, L. F., Marder, E. Dynamic clamp: computer-generated conductances in real neurons. Journal of Neurophysiology. 69, 992-995 (1993).
- Prinz, A. A., Abbott, L. F., Marder, E. The dynamic clamp comes of age. Trends in Neuroscience. 27, 218-224 (2004).
- Barnett, W., Cymbalyuk, G., Jung, R. Hybrid systems analysis: real-time systems for design and prototyping of neural interfaces and prostheses. Biohybrid systems: nerves, interfaces, and machines. , 115-138 (2011).
- Sorensen, M., DeWeerth, S., Cymbalyuk, G., Calabrese, R. L. Using a hybrid neural system to reveal regulation of neuronal network activity by an intrinsic current. Journal of Neuroscience. 24, 5427-5438 (2004).
- Olypher, A., Cymbalyuk, G., Calabrese, R. L. Hybrid systems analysis of the control of burst duration by low-voltage-activated calcium current in leech heart interneurons. Journal of Neurophysiology. 96, 2857-2867 (2006).
- Calabrese, R. L., Prinz, A. A., DeSchutter, E. Realistic modeling of small neuronal networks. Computational Modeling Methods for Neuroscientists. , 285-316 (2010).
- Rybak, I. A., Molkov, Y. I., Jasinski, P. E., Shevtsova, N. A., Smith, J. C. Rhythmic bursting in the pre-Bötzinger complex: mechanisms and models. Progress in Brain Research. 209, 1-23 (2014).
- Picton, L. D., Nascimento, F., Broadhead, M. J., Sillar, K. T., Miles, G. B. Sodium pumps mediate activity-dependent changes in mammalian motor networks. Journal of Neuroscience. 37, 906-921 (2017).

